1과목: 화공열역학
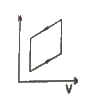
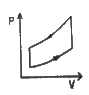
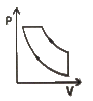
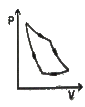
1. 표준디젤사이클의 P-V선도에 해당하는 것은?
2. 두 절대온도 T1, T2(T1<T2)이에서 운전하는 엔진의 효율에 관한 설명 중 틀린 것은?
- 가역과정인 경우 열효율이 최대가 된다.
- 가역과정인 경우 열효율은 (T2-T1)/T2 이다.
- 비가역 과정인 경우 열효율은 (T2-T1)/T2보다 크다.
- T1이 0K인 경우 열효율은 100%가 된다.
3. 기체-액체 평형을 이루는 순수한 물에 대한 다음 설명 중 옳지 않은 것은?
- 자유도는 1이다.
- 기체의 내부에너지는 액체의 내부에너지 보다 크다.
- 기체의 엔트로피가 액체의 엔트로피 보다 크다.
- 기체의 깁스에너지가 액체의 깁스에너지보다 크다.
4. 과잉특성과 혼합에 의한 특성치의 변화를 나타낸 상관식으로 옳지 않은 것은? (단, H:엔탈피, V:용적, M:열역학특성치, id:이상 용액 이다.)
- HE=△H
- VE=△V
- ME=M-Mid
- △ME=△M
5. 이상기체 3mol이 50℃에서 등온으로 10atm에서 1atm까지 팽창할 때 행해지는 일의 크기는 몇 J인가?
- 4433
- 6183
- 18550
- 21856
6. 이상용액의 활동도계수 γ는 어느 값을 가지는가?
- γ>1
- γ<1
- γ= 0
- γ= 1
7. 이상기체에 대하여 일(W)이 다음과 같은 식으로 표현될 때, 이 계는 어떤 과정으로 변화하였는가? (단, Q는 열, V1은 초기부피, V2는 최종부피이다.)
- 단열 과정
- 등압 과정
- 등온 과정
- 정용 과정
8. 퓨개시티(Fugacity) fi 및 퓨개시티 계수에 관한 설명으로 틀린 것은? (단, 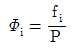 이다.)
이다.)
- 이상 기체에 대한 fi/P의 값은 1이 된다.
- 잔류 깁스(Gibbs) 에너지
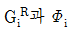 의 관계
의 관계 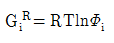 로 표시 된다.
로 표시 된다. - 퓨개시티 계수
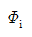 의 단위는 압력의 단위를 가진다.
의 단위는 압력의 단위를 가진다. - 주어진 성분의 퓨개시티가 모든 상에서 동일할 때, 접촉하고 있는 상들은 평형상태에 도달할 수 있다.
9. 다음 중 잠열에 해당되지 않는 것은?
- 반응열
- 증발
- 융해열
- 승화열
10. 다음 중 에너지 변화를 나타내지 않는 것은? (단, P : 압력 S : 엔트로피 T : 절대온도 V : 부피 m : 질량 Cp: 정압열용량 )
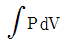
- TdS+VdP
- △S
- mCp△T
11. 0℃로 유지되고 있는 냉장고가 27℃의 방안에 놓여 있다. 어떤 시간동안에 1000cal의 열이 냉장고 속으로 새어 들어 갔다고 한다. 방안의 공기의 엔트로피 변화의 크기는 몇 cal/K인가?
- 3
- 6
- 30
- 60
12. 다음 중 기-액 상평형 자료의 건전성을 검증하기 위하여 사용하는 것으로 가장 옳은 것은?
- 깁스-두헴(Gibbs-Duhem)식
- 클라우지우스-클레이페이론(Clausius-Clapeyron) 식
- 맥스웰 관계(Maxwell relation)식
- 헤스의 법칙(Hess’s Law)
13. 1kWh는 약 몇 kcal에 해당되는가?
- 860
- 632
- 550
- 427
14. 어떤 기체가 부피는 변하지 않고서 150cal의 열을 흡수하여 그 온도가 30℃로부터 32℃로 상승하였다. 이 기체의 △U는 얼마인가?
- 50cal
- 75cal
- 150cal
- 300cal
15. 초기에 1몰의 H2S와 2몰의 O2를 포함하는 계에서 다음 반응이 일어난다. 반응이 일어나는 동안 O2와 H2S의 몰분율을 반응좌표 Є의 함수 로 옳게 나타낸 것은?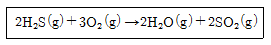
16. 어떤 연료의 발열량이 10000kcal/kg일 때 이 연료 1kg이 연소해서 30%가 유용한 일로 바뀔수 있다면 500kg의 무게를 들어올릴 수 있는 높이는 약 얼마인가?
- 26m
- 260m
- 2.6km
- 26km
17. 액상과 기상이 서로 평형이 되어 있을 때에 대한 설명으로 틀린 것은?
- 두 상의 온도는 서로 같다.
- 두 상의 압력은 서로 같다.
- 두 상의 엔트로피는 서로 같다.
- 두 상의 화학포텐셜은 서로 같다.
18. 오토(Otto)엔진과 디젤(Diesel)엔진에 대한 설명 중 틀린 것은?
- 디젤엔진에서는 압축 과정의 마지막에 연료가 주입된다.
- 디젤 엔진의 효율이 높은 이유는 오토 엔진보다 높은 압축비로 운전할 수 있기 때문이다.
- 디젤 엔진의 연소 과정은 압력이 급격히 변화하는 과정 중에 일어난다.
- 오토 엔진의 효율은 압축비가 클수록 좋아진다.
19. 1100K, 1bar에서 2mol의 H2O와 1mol의 CO가 다음과 같이 전이반응한다. 이 반응의 표준 깁스(Gibbs) 에너지 변화는 △G°= 0이다. 혼합물을 이상기체로 가정하면, 반응한 수중기의 분율은?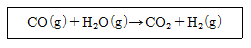
- 0.333
- 0.367
- 0.500
- 0.667
20. 압력 20Pa, 온도 200K의 초기상태의 이상기체가 정용과정(constant volume process)을 통하여 온도 800K까지 가열되었다면 나중 압력은?
- 5Pa
- 20Pa
- 40Pa
- 80Pa
2과목: 단위조작 및 화학공업양론
21. 도관 내 흐름을 해석할 때 사용되는 베르누이식에 대한 설명으로 틀린 것은?
- 마찰손실이 압력손실 또는 속도수두 손실로 나타나는 흐름을 해석할 수 있는 식이다.
- 수평흐름이면 압력손실이 속도수두 증가로 나타나는 흐름을 해석할 수 있는 식이다.
- 압력수두, 속도수두, 위치수두의 상관관계 변화를 예측할 수 있는 식이다.
- 비점성, 비압축성, 정상상태, 유선을 따라 적용할 수 있다.
22. 탄산가스 30vol%, 일산화탄소 5vol%, 산소 10vol%, 질소55vol%인 혼합가스의 평균 분자량은? (단, 모두 이상기체로 가정한다.)
- 33.2
- 43.2
- 45.2
- 47.2
23. 1atm, 100℃의 1000kg/h 포화수증기(△H=2676kJ/kg)와 1atm, 400℃의 과열수증기(△H=3278kJ/kg)가 단열 혼합기로 유입되어 1atm, 300℃의 과열수증기(△H=3074kJ/kg)가 배출될때 배출되는 양(kg/h)은?
- 2921
- 2931
- 2941
- 2951
24. 에탄올 20wt% 수용액 200kg을 증류장치를 통하여 탑 위에서 에탄올 40wt% 수용액 20kg을 얻다. 탑 밑으로 나오는 에탄올 수용액의 농도는 약 얼마인가?
- 3wt%
- 8wt%
- 12wt%
- 18wt%
25. 1atm, 비점(78℃)에서 에탄올의 분자증발열은 38580J/mol이다. 70℃에서 에탄올의 증기압은 몇 mmHg인가?
- 558.3
- 578.3
- 598.3
- 618.3
26. 10ppm SO2을 %로 나타내면?
- 0.0001%
- 0.001%
- 0.01%
- 0.1%
27. 0℃, 1atm에서 22.4m3의 가스를 정압하에서 3000kcal의 열을 주었을 때 이 가스의 온도는? (단, 가스는 이상기체로 보고 정압 평균분자 열용량은 4.5kcal/kmol*℃이다.)
- 500.0℃
- 555.6℃
- 666.7℃
- 700.0℃
28. 40℃에서 벤젠과 톨루엔의 혼합물이 기액평형에 있다. Raoult의 법칙이 적용된다고 볼 때 다음 설명 중 옳지 않은 것은? (단, 40℃에서의 증기압은 벤젠 180mmHg, 톨루엔 60mmHg이고, 액상의 조성은 벤젠30mol%, 톨루엔 70mol%이다.)
- 기상의 평형분압은 톨루엔42mmHg이다.
- 기상의 평형분압은 벤젠54mmHg이다.
- 이 계의 평형전압은 240mmHg이다.
- 기상의 평형조성은 벤젠56.25mol%, 톨루엔 43.75mol%이다.
29. 이상기체를 T1에서 T2까지 일정압력과 일정 용적에서 가열할 때 열용량에 관한 식 중 옳은 것은? (단, Cp는 정압열용량이고, Cv는 정적열용량이다.)
- Cp+Cv=R
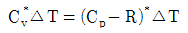

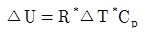
30. 반응에 관한 설명으로 옳지 않은 것은?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- 강산과 강염기의 중화열은 일정하다.
- 수소이온의 생성열은 편의상 0으로 정한다.
- 약산과 강염기의 중화열은 강산과 강염기의 중화열과 같다.
- 반응전후의 온도 변화가 없을 때 엔탈피 변화는 0이다.
31. 복사전열에서 총괄교환인자 F12가 다음과 같이 표현되는 경우는? (Є1, Є2는 복사율이다.)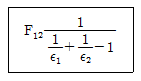
- 두면이 무한히 평행한 경우
- 한면이 다른면으로 완전히 포위된 경우
- 한점이 반구에 의하여 완전히 포위된 경우
- 한면은 무한 평면이고 다른 면은 한점인 경우
32. 그림은 어떤 회분 추출공정의 조성변화를 보여 주고 있다. 평형에 있는 추출 및 추잔상의 조성이 E와 R인 계에 추제를 더 가하면 M점은 그림 a, b, c, d 중 어느 쪽으로 이동하겠는가? (단, F는 원료의 조성이다.)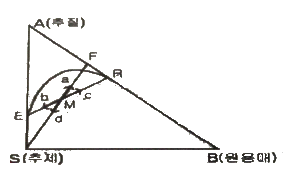
- a
- b
- c
- d
33. 40%의 수분을 포함하고 있는 고체 1000kg을 수분 10%까지 건조시킬 때 제거한 수분량은 약 몇 kg인가?
- 333
- 450
- 550
- 667
34. 증발장치에서 수증기를 열원으로 사용할 때 장점으로 거리가 먼 것은?
- 가열을 고르게 하여 국부과열을 방지한다.
- 온도변화를 비교적 쉽게 조절할 수 있다.
- 열전도도가 작으므로 열원쪽의 열전달 계수가 작다.
- 다중효용관, 압축법으로 조작할 수 있어 경제적이다.
35. 경사 마노미터를 사용하여 측정한 두 파이프 내 기체의 압력차는?
- 경사각의 sin값에 반비례한다.
- 경사각의 sin값에 비례한다.
- 경사각의 cos값에 반비례한다.
- 경사각의 cos값에 비례한다.
36. 2중관 열교환기를 사용하여 500kg/h의 기름을 240℃의 포화수증기를 써서 60℃에서 200℃까지 가열하고자 한다. 이때 총괄전열계수가 500kcal/m2*h*℃, 기름의 정압비열은 1.0kcal/kg*℃이다. 필요한 가열면적은 몇 m2인가?
- 3.1
- 2.4
- 1.8
- 1.5
37. 증발기에서 용액의 비점 상승도가 증가할수록 감소하는 것은?
- 가열 면적
- 유효 온도차
- 필요한 수증기의 양
- 용액의 비점
38. 다음 중 Drag Coefficient(C0)를 구하고자 할때 사용되는 법칙에 대한 설명으로 가장 옳은 것은?
- 레이놀즈수가 아주 작을 때 stoke의 법칙을 사용한다.
- 레이놀즈수와 관계없이 stoke의 법칙을 사용한다.
- 일반적으로 stoke의 법칙을 사용하되 레이놀즈수가 작을 때는 Newton의 법칙을 사용한다.
- 점도의 크기에 따라 stoke의 법칙과 Newton의 법칙을 구별하여 사용한다.
39. 벤젠과 톨루엔의 2성분계 정류조작에 있어서의 자유도(degrees of freedom)는 얼마인가?
- 0
- 1
- 2
- 3
40. 상계점(Plait point)에 대한 설명으로 옳지 않은 것은?
- 추출상과 추잔상의 조성이 같아지는 점이다.
- 상계점에서 2상(相)이 1상이 된다.
- 추출상과 평형에 있는 추잔상의 대응선(tie line)의 길이가 가장 길어지는 지점이다.
- 추출상과 추잔상이 공존하는 점이다.
3과목: 공정제어
41. 다음 공정에 단위 계단입력이 가해졌을 때 최종치는?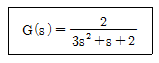
- 0
- 1
- 2
- 3
42. 다음 공정에 P제어기가 연결된 닫힌루프 제어계가 안정하려면 비례이득 Kc의 범위는? (단, 나머지 요소의 전달함수는 1이다.)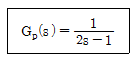
- Kc<1
- Kc>1
- Kc<2
- Kc>2
43. 특성방정식이 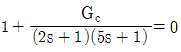 와 같이 주어지는 시스템에서 제어기 Gc로 비례제어기를 이용할 경우 진동응답이 예상되는 경우는? (단, Kc는 비례이득이다.)
와 같이 주어지는 시스템에서 제어기 Gc로 비례제어기를 이용할 경우 진동응답이 예상되는 경우는? (단, Kc는 비례이득이다.)
- Kc=0
- Kc=1
- Kc=-1
- Kc에 관계없이 진동이 발생된다.
44. 3개의 안정한 pole들로 구성된 어떤 3차계에 대한 Bode diagram에서 위상각은?
- 0° ~ -180° 사이의 값
- 0° ~ 180° 사이의 값
- 0° ~ -270° 사이의 값
- 0° ~ 270° 사이의 값
45. 안정도 판정을 위한 개회로 전달함수가 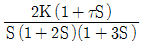 인 피드백 제어계가 안정할 수 있는 K와 τ의 관계는?
인 피드백 제어계가 안정할 수 있는 K와 τ의 관계는?
- 12K<(5+2τK)
- 12K<(5+10τK)
- 12K>(5+10τK)
- 12K>(5+2τK)
46. 운전자의 눈을 가린 후 도로에 대한 자세한 정보를 주고 운전을 시킨다면 이는 어느 공정제어 기법이라고 볼 수 있는가?
- 되먹임제어
- 비례제어
- 앞먹임제어
- 분산제어
47. 설정값의 계단변화에 대하여 잔류편차가 발생하지 않는 것은?
- P제어기
- PI제어기
- PD제어기
- ON/OFF제어기
48. 일차계 공정에 사인파 입력이 들어갔을 때 시간이 충분히 지난 후의 출력은?
- 사인파 입력의 주파수가 커질수록 출력의 진폭은 작아진다.
- 공정의 시상수가 클수록 출력의 진폭도 커진다.
- 공정의 이득이 클수록 출력의 진폭은 작아진다.
- 출력의 진폭은 사인파 입력의 주파수와 공정의 시상수에는 무관하다.
49. 다음 블록선도에서 서보 문제(servo problem)의 전달함수는?
50. Anti Reset Windup에 관한 설명으로 가장 거리가 먼 것은?
- 제어기 출력이 공정 입력 한계에 걸렸을 때 작동한다.
- 적분 동작에 부과된다.
- 큰 설정치 변화에 공정 출력이 크게 흔들리는 것을 방지한다.
- Offset을 없애는 동작이다.
51. 현대의 화학공정에서 공정제어 및 운전을 엄격하게 요구하는 주요 요인으로 가장 거리가 먼 것은?
- 공정 간의 통합화에 따른 외란의 고립화
- 엄격해지는 환경 및 안전 규제
- 경쟁력 확보를 위한 생산공정의 대형화
- 제품 질의 고급화 및 규격의 수시 변동
52. 다음 공정의 단위 임펄스응답은?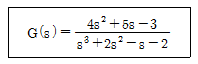
- y(t)=2et+e-t+2e-2t
- y(t)=et+2e-t+e-2t
- y(t)=et+e-t+2e-2t
- y(t)=2et+2e-t+e-2t
53. 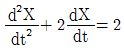 에서 X(t)의 Laplace 변환은? (단, X(0)=X’(0)=0)
에서 X(t)의 Laplace 변환은? (단, X(0)=X’(0)=0)
- 2s/(s2+2s)
- 2/(s+2)s
- 2/(s3+2s2)
- 2s/(s3-2s)
54. 다음 block선도로부터 전달함수 Y(s)/X(s)를 구하면?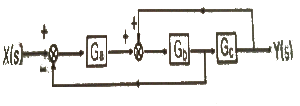
55. 여름철 사용되는 일반적인 에어콘(air conditioner)의 동작에 대한 설명 중 틀린 것은?
- 온도 조절을 위한 피드백 제어 기능이 있다.
- 희망온도가 피드백 제어의 설정값에 해당 된다.
- 냉각을 위하여 에어콘으로 흡입되는 공기의 온도변화가 외란에 해당된다.
- 사용되는 제어방법은 주로 On/Off제어이다.
56. 다단제어에 대한 설명으로 옳은 것은?
- 종속제어기 출력이 주제어기의 설정점으로 작용하게 된다.
- 종속제어루프 공정의 동특성이 주제어루프 공정의 동특성보다 충분히 빠를수록 바람직하다.
- 주제어루프를 통하여 들어오는 외란을 조기에 보상하는 것이 주 목적이다.
- 종속제어기는 빠른 보상을 위하여 피드포워드 제어알고리즘을 사용한다.
57. 순수한 적분공정에 대한 설명으로 옳은 것은?
- 진폭비(Amplitude ratio)는 주파수에 비례 한다.
- 입력으로 단위임펄스가 들어오면 출력은 계단형 신호가 된다.
- 작은 구멍이 뚫린 저장탱크의 높이와 입력흐름의 관계는 적분공정이다.
- 이송지연(transportation lag) 공정이라고 부르기도 한다.
58. 측정 가능한 외란(measurable disturbance)을 효과적으로 제거하기 위한 제어기는?
- 앞먹임 제어기(Feedforward Controller)
- 되먹임 제어기(Feedback Controller)
- 스미스 예측기(Smith Predictor)
- 다단 제어기(Cascade Controller)
59. 초기상태가 공정입출력이 0이고 정상상태일때, 어떤 선형 공정에 계단 입력 u(t)=1을 입력했더니, 출력 y(t)는 y(1)=0.1, y(2)=0.2, y(3)=0.4이었다. 입력 u(t)=0.5를 입력할 때 출력은 각각 얼마인가?
- y(1)=0.1, y(2)=0.2, y(3)=0.4
- y(1)=0.05, y(2)=0.1, y(3)=0.2
- y(1)=0.1, y(2)=0.3, y(3)=0.7
- y(1)=0.2, y(2)=0.4, y(3)=0.8
60. 어떤 항온조에서 항온조 내의 온도계가 나타내는 온도와 항온조 내의 실제 유체온도 사이의 관계는 이득이 1인 1차계로 나타낼 수 있으며 이때 시간상수는 0.2min이다. 평형상태에 도달한 후 항온조의 유체온도가 1℃/min의 속도로 평형상태의 값에서 시간에 따라 선형적으로 증가하기 시작하였다. 이 경우 1min경과 후 온도계의 온도와 항온조 내 실제 유체온도 사이의 온도차는 얼마인가?
- 0.2℃
- 0.8℃
- 1.5℃
- 2.0℃
4과목: 공업화학
61. H2와 Cl2의 직접결합에 의한 합성염산법에서 사용되는 장치가 아닌 것은?
- 촉매실
- 연소실
- 냉각기
- 흡수기
62. 아닐린에 대한 설명으로 옳은 것은?
- 무색, 무취의 액체이다.
- 니트로벤젠은 아닐린으로 산화될 수 있다.
- 비점이 약 184℃이다.
- 알코올과 에테르에 녹지 않는다.
63. 접촉식 황산제조 방법에 대한 설명 중 옳지 않은 것은?
- 백금, 바나듐 등의 촉매가 이용된다.
- SO3는 물에만 흡수시켜야 한다.
- 촉매층의 온도는 410~420℃로 유지하면 좋다.
- 주요 공정별로 온도 조절이 중요하다.
64. 다음 중 Nylon 6 제조의 주된 원료로 사용되는 것은?
- 카프로락탐
- 세바크산
- 아디프산
- 헥사메틸렌디아민
65. 니트로벤젠을 환원시켜 아닐린을 얻고자 할 때 사용하는 것은?
- Fe, HCl
- Ba, H2O
- C, NaOH
- S, NH4Cl
66. 분자량 1.0× 104g/mol인 고분자 100g과 분자량 2.5×104 g/mol인 고분자 50g, 그리고 분자량 1.0×105g/mol인 고분자 50g이 혼합되어 있다. 이 고분자 물질의 수평균 분자량은?
- 16000
- 28500
- 36250
- 57000
67. 다음 중 고분자의 유리전이온도를 측정하는 방법이 아닌 것은?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- differential scanning calorimetry
- dilatometry
- thermal gravimetric analysis
- dynamic mechanical analysis
68. 인광석을 가열처리하여 불소를 제거하고 아파 타이트 구조를 파괴하여 구용성인 비료로 만든 것은?
- 메타인산칼슘
- 소성인비
- 과린산석회
- 인산암모늄
69. 무수염산의 제법에 속하지 않는 것은?
- 직접합성법
- 농염산증류법
- 염산분해법
- 흡착법
70. 다음 중 중과린산 석회의 반응은?
- Ca(PO4)2+2H2SO4+5H2O⇔CaH4(PO4)2∙H2O+2[CaSO4∙2H2O]
- Ca3(PO4)2+4H3PO4+3H2O⇔2[CaH4(PO4)2∙H2O]
- Ca3PO4+4HCl⇔CaH4(PO4)2+2CaCl2
- CaH4(PO4)2+NH3⇔NH4H2PO4+CaHPO4
71. 다음 중 황산암모늄의 제조법이 아닌 것은?
- 합성황안법
- 순환황안법
- 변성황안법
- 부생황안법
72. 석유정제에 사용되는 용제가 갖추어야 하는 조건이 아닌 것은?
- 선택성이 높아야 한다.
- 추출할 성분에 대한 용해도가 높아야 한다.
- 용제의 비점과 추출성분의 비점의 차이가 적어야 한다.
- 독성이나 장치에 대한 부식성이 적어야 한다.
73. 산과 알코올이 어떤 반응을 일으켜 에스테르가 생성되는가?
- 검화
- 환원
- 축합
- 중화
74. 암모니아 소오다법에서 NH3회수에 사용하는 것은?
- CaCO3
- CaCl2
- Ca(OH)2
- H2O
75. HNO3 14.5%, H2SO4 50.5%, HNOSO4 12.5%, H2O 20.0%, nitrobody 2.5%의 조성을 가지는 혼산을 사용하여 toluene으로부터 mono nitrotoluene을 제조하려고 한다. 이때 1700kg의 toluene을 12000kg의 혼산으로 니트로화했다면 DVS(dehydrating value of sulfuric acid)는?
- 1.87
- 2.21
- 3.04
- 3.52
76. 스타이렌-부타디엔-스타이렌 블록공중합체를 제조하는 방법은?
- 양이온 중합
- 리빙 음이온 중합
- 라디칼 중합
- 메탈로센 중합
77. 황산 공업의 원료가 될 수 없는 것은?
- 섬아연광
- 자류철광
- 황화철광
- 자철광
78. 중질유의 점도를 내릴 목적으로 중질유를 약 20기압과 약 500℃에서 열분해시키는 공정은?
- Coking process
- Hydroforming process
- Reforming process
- Visbreaking process
79. 질산의 직접 합성 반응이 다음과 같을 때 반응 후 응축하여 생성된 질산 용액의 농도는 얼마인가?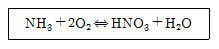
- 68%
- 78%
- 88%
- 98%
80. 장치재료의 선택에는 재료가 사용되는 환경에서의 안정성이 중요한 변수가 된다. 다음의 재료 변화에 대한 설명 중 반응기구가 다른 것은?
- PbS로부터 Pb의 석출
- Fe 표면위에 녹 [Fe(OH)3] 생성
- Al 표면위에 Al2O3 생성
- 산용액 내에서 Cu와 Zn금속이 접할 때 Zn의 용출
5과목: 반응공학
81. 그림과 같이 직렬로 연결된 혼합 흐름 반응기에서 액상 1차 반응이 진행될 때 입구의 농도가 C0이고 출구의 농도가 C2일 때 부피가 최소로 되기 위한 조건이 아닌 것은?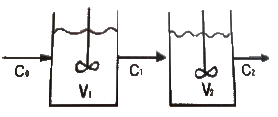
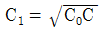
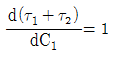
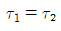
- V1=V2
82. 무차원 반응속도상수(dimensionless reaction rate group)에 대한 설명으로 옳은 것은?
- 전화율(conversion)에 대한 공간시간(space time)의 도표에서 매개변수 (parameter)로 중요하다.
- 1차 반응에서는 k 이다.
- 2차 반응에서는 kt이다.
- 3차 반응에서는 kCA0t이다.
83. CNBr(A)과 메틸아민(B)와의 액상반응은 2차 반응으로 알려져 있으며 10℃에서 k=2.22L/s*mol 이다. 플러그흐름 반응기에서 체류시간이 4초이고 CA0=CB0=0.1mol/L일 때 반응기를 나가는 반응생성물 중의 CNBr 농도 CA는 약 얼마인가?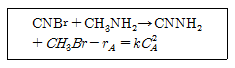
- 0.021
- 0.032
- 0.045
- 0.053
84. 단일 이상형 반응기(single ideal reactor)에 해당하지 않는 것은?
- 플러그흐름 반응기(plug flow reactor)
- 회분식 반응기(batch reactor)
- 매크로유체 반응기(macro fluid reactor)
- 혼합흐름 반응기(mixed flow reactor)
85. CSTR에 대한 설명으로 옳지 않은 것은?
- 비교적 온도 조절이 용이하다.
- 약한 교반이 요구될 때 사용된다.
- 높은 전화율을 얻기 위해서 큰 반응기가 필요하다.
- 반응기 부피당 반응물의 전화율은 흐름 반응기들 중에서 가장 작다.
86. 비가역 직렬반응 A → R →S에서 1단계는 2차반응, 2단계는 1차반응으로 진행되고 R이 원하는 제품일 경우 다음 설명 중 옳은 것은?
- A의 농도를 높게 유지할수록 좋다.
- 반응 온도를 높게 유지할수록 좋다.
- 혼합 반응기가 플러그 반응기보다 성능이 더 좋다.
- A의 농도는 R의 수율과 직접 관계가 없다.
87. 다음과 같은 액상 등온반응이 순수한 A로부터 출발하여 혼합반응기에서 전화율 XAf=0.90, R의 총괄수율 0.75로 진행된다면 반응기를 나오는의 농도는 몇 mol/L인가? (단, CA0=5.0mol/L이다.)
- 0.75
- 3.38
- 3.75
- 4.5
88. 균일상 1차 반응을 이용하여 그림과 같이 크기가 다른 두 개의 연속 혼합류 반응기에서 어떤 생성물을 얻고자 한다. 다음 중 1호 반응기의 공간시간 τ1을 가장 옳게 표현한 식은? (단, FA0은 반응물의 몰 공급속도, CA0는 반응물 중 A의 초기농도, V1은 반응기 부피이다.)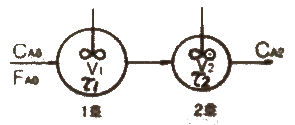
89. 다음 반응에서 -ln(CA/CA0)를 t로 plot하여 직선을 얻었다. 이 직선의 기울기는? (단, 두 반응 모두 1차 비가역반응이다.)
- k1
- k2
- k1/k2
- k1+k2
90. 플러그흐름반응기 또는 회분식 반응기에서 비가역 직렬 반응 A → R → S, k1=2min-1, k2=1min-1이 일어날 때 CR이 최대가 되는 시간은?
- 0.301
- 0.693
- 1.443
- 3.332
91. 유동층 반응기에 대한 설명 중 가장 거리가 먼 내용은?
- 유동층에서의 전화율은 고정층 반응기에 비하여 낮다.
- 유동화 물질은 대부분 고체이다.
- 석유나프타의 접촉분해 공정에 적합하다.
- 작은 부피의 유체를 처리하는데 적합하다.
92. 다음 그림에 해당하는 반응 형태는?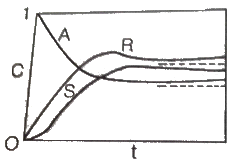
93. 다음 중 Damkohler가 화학반응속도론에 기여한 내용은?
- 전이상태(transition state)에 대한 양자 통계론적인 취급법이 화학반응 속도론에 적용된다는 사실을 지적하였다.
- Langmuir의 활성화 흡착설을 촉매반응 등의 불균일계 반응에 적용, 해석하였다.
- 유체역학적 인자들과 경계층 현상 등이 화학반응 속도에 영향을 미친다는 사실을 지적하였다.
- 연쇄반응(chain reaction)에 대한 이론을 확립하였다.
94. 1차 직렬반응 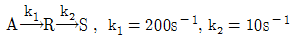 일 경우
일 경우  로 볼 수 있다. 이 때 k 값은?
로 볼 수 있다. 이 때 k 값은?
- 11.00S-1
- 9.52S-1
- 0.11S-1
- 0.09S-1
95. Arrhenius법칙에서 속도상수 k와 반응온도 T의 관계를 옳게 설명한 것은?
- k와 T는 직선관계가 있다.
- ln K와 1/T은 직선관계가 있다.
- ln K와 ln(1/T)은 직선관계가 있다.
- ln K와 T는 직선관계가 있다.
96. A →3R인 반응에서 A만으로 시작하여 완전히 전화되었을 때 계의 부피변화율은 얼마인가? (단, 기상반응이며, 반응압력은 일정하다.)
- 0.5
- 1.0
- 1.5
- 2.0
97. 다음은 단열 조작선의 그림이다. 그림의 기울기는 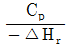 로 나타내는데 이 기울기가 큰 경우에는 어떤 형태의 반응기가 가장 좋겠는가? (단, Cp는 정압열용량, △Hr은 반응열이다.)
로 나타내는데 이 기울기가 큰 경우에는 어떤 형태의 반응기가 가장 좋겠는가? (단, Cp는 정압열용량, △Hr은 반응열이다.)
- 플러그흐름(plug flow)
- 혼합흐름(mixed flow)
- 교반형
- 순환형
98. 어떤 물질의 분해반응은 1차반응으로, 99%까지 분해하는데 6646초가 소요되었다고 한다면, 50%까지 분해하는데 몇 초가 걸리겠는가?
- 100초
- 500초
- 1000초
- 1500초
99. 방사성 물질의 감소는 1차반응 공정을 따른다. 방사성 Kr-89(반감기 = 76min)을 1일 동안 두면방사능은 처음 값의 약 몇 배가 되는가?
- 1×10-6
- 2×10-6
- 1×10-5
- 2×10-5
100. 균일계 액상 병렬반응이 다음과 같을 때 R의 순간 수율은?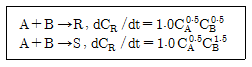
- 1/(1+CB)
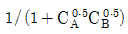
- 1/(1+CA)
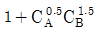






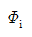 의 단위는 압력의 단위를 가진다."가 틀린 설명이다. 퓨개시티 계수는 단위가 없는 상수이며, 일반적으로 활동 계수와 같은 단위 없는 상수와 함께 사용된다. 따라서, 퓨개시티 계수의 단위는 압력의 단위가 아니다.
의 단위는 압력의 단위를 가진다."가 틀린 설명이다. 퓨개시티 계수는 단위가 없는 상수이며, 일반적으로 활동 계수와 같은 단위 없는 상수와 함께 사용된다. 따라서, 퓨개시티 계수의 단위는 압력의 단위가 아니다.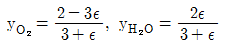
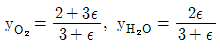
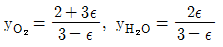
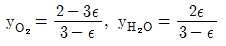
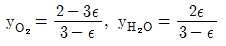 "이다.
"이다.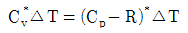 "이다.
"이다.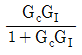
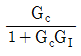
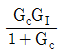
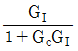
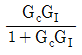 이다. 이유는 블록선도에서 입력신호인 각도(theta)가 출력신호인 위치(x)에 직접적인 영향을 주기 때문이다. 따라서 전달함수는 각도(theta)를 입력으로 받아 위치(x)를 출력으로 내보내는 형태가 되어야 한다. 이를 수식으로 나타내면 x = Kp * theta 가 된다. 이때 Kp는 위치와 각도의 비례상수이다.
이다. 이유는 블록선도에서 입력신호인 각도(theta)가 출력신호인 위치(x)에 직접적인 영향을 주기 때문이다. 따라서 전달함수는 각도(theta)를 입력으로 받아 위치(x)를 출력으로 내보내는 형태가 되어야 한다. 이를 수식으로 나타내면 x = Kp * theta 가 된다. 이때 Kp는 위치와 각도의 비례상수이다.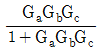
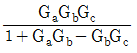
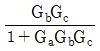
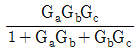
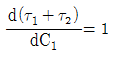 "입니다. "
"입니다. "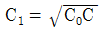 "은 입구에서의 농도를 나타내는 것이고, "
"은 입구에서의 농도를 나타내는 것이고, "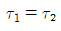 "은 부피가 같다는 조건을 나타내는 것입니다.
"은 부피가 같다는 조건을 나타내는 것입니다.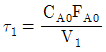
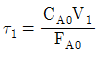
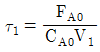

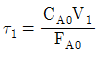 " 이다.
" 이다.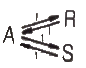
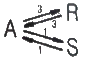
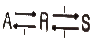
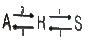
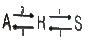 "가 정답인 이유는, 도형은 모두 동일하지만 색상이 다르기 때문에, 색상에 따라 다른 반응을 보이기 때문이다.
"가 정답인 이유는, 도형은 모두 동일하지만 색상이 다르기 때문에, 색상에 따라 다른 반응을 보이기 때문이다.
이유는 표준디젤사이클은 4단계로 이루어져 있으며, P-V선도에서는 각 단계의 압력과 부피 변화를 나타냅니다. "