1과목: 화공열역학
1. 한 물체의 가역적인 단열 변화에 대한 엔트로피(entropy)의 변화 △S는?
- △S = 0
- △S > 0
- △S < 0
- △S = ∞
2. 등온과정의 부피 V에 대한 엔트로피 S의 변화는 맥스웰(Maxwell)관계식에서 어떻게 나타나는가?
3. 20mol% A, 35mol% B, 45mol% C 를 포함하는 3성분 기체 혼합물이 있다. 60atm, 75℃ 에서 이 혼합물이 성분 A, B, C 의 퓨개시티 계수가 각각 0.7, 0.6, 0.9 일 때 이 혼합물의 퓨개시티는 얼마인가?
- 34.6atm
- 44.6atm
- 54.6atm
- 64.6atm
4. 혼합물에서 과잉물성(excess property)에 관한 설명으로 가장 옳은 것은?
- 실제용액의 물성값에 대한 이상용액의 물성값의 차이다.
- 실제용액의 물성값과 이상용액의 물성값의 합이다.
- 이상용액의 물성값에 대한 실제용액의 물성값의 비이다.
- 이상용액의 물성값과 실제용액의 물성값의 곱이다.
5. 퓨개시티(Fugacity) fi 및 퓨개시티 계수 φi 에 관한 설명으로 옳은 것은?(단, 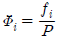 이다.)
이다.)
- 이상 기체에 대한
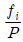 의 값은 무한대가 된다.
의 값은 무한대가 된다. - 잔류 깁스(Gibbs) 에너지
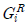 과 φi와의 관계는
과 φi와의 관계는 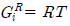 Inφi로 표시된다.
Inφi로 표시된다. - 퓨개시티 계수 φi의 단위는 압력의 단위를 가진다.
- 주어진 성분의 퓨개시티가 모든 상에서 서로 다른 값을 가지면 접촉하고 있는 상들은 평형에 도달할 수 있다.
6. 20℃ 에 있어서 아세톤의 대략적인 증발잠열을 클라우지우스-클레이페이론(Clausius-Clapeyron)식을 이용하여 구하면 약 몇 cal/mol 인가? (단, 20℃ 에 있어서의 아세톤의 증기압은 179.3mmHg 이고 표준 끓는점은 56.5℃ 이다.)
- 759
- 1000
- 7590
- 10000
7. 벤젠, 톨루엔, 크실렌의 3성분 용액이 기상과 액상으로 평형을 이루고 있을 때 이 계에 대한 자유도수는?
- 0
- 1
- 2
- 3
8. 세기성질(intensive property)에 해당하는 것은?
- 온도
- 부피
- 에너지
- 질량
9. 한 발명가가 300℃ 의 뜨거운 열저장고 사이에서 10kJ 의 열을 얻어서 4.2kJ 의 일을 생산하고 5.8kJ의 열을 30℃의 차가운 열저장고로 방출하는 사이클 엔진을 발명하였다면 열역학 법칙이 성립하는지를 옳게 설명한 것은?
- 열역학 제1법칙과 열역학 제2법칙 모두 성립한다.
- 열역학 제1법칙은 성립하고 열역학 제2법칙은 위배된다.
- 열역학 제1법칙은 위배되고 열역학 제2법칙은 성립한다.
- 열역학 제1법칙과 열역학 제2법칙 모두 위배된다.
10. 다음 중 액-액 상평형 계산에 적합하지 않은 모델은?
- NRTL 모델
- UNIQUAC 모델
- Wilson 모델
- UNIFAC 모델
11. 그림에 표시된 T-S 도표는 어떤 사이클을 나타내고 있는가?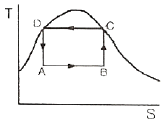
- 카르노(Carnot) 열기관 사이클
- 카르노(Carnot) 냉동 사이클
- 브레이턴(Brayton) 사이클
- 랭킨(Rankine) 사이클
12. 열역학 제2법칙의 수학적 표현에 해당하는 것은?
- △U + △KE + △PE = Q+W
- △Stotal ≥ 0
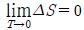
- dU = dQ + dW
13. 어떤 화학반응에서 평형상수 K의 온도에 대한 미분계수가 다음과 같이 표시된다. 이 반응에 대한 설명으로 옳은 것은?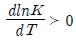
- 흡열반응이며, 온도상승에 따라 K의 값이 커진다.
- 흡열반응이며, 온도상승에 따라 K의 값이 작아진다.
- 발열반응이며, 온도상승에 따라 K의 값이 커진다.
- 발열반응이며, 온도상승에 따라 K의 값이 작아진다.
14. 다음 중 실제기체가 이상기체에 가장 가까울 때의 조건은?
- 저압저온
- 고압저온
- 저압고온
- 고압고온
15. 내연기관 중 자동차에 사용되고 있는 것으로 흡입 행정은 거의 정압에서 일어나며, 단열압축 과정 후 전기 점화에 의해 단열 팽창하는 사이클은?
- 오토(Otto)
- 디젤(Diesel)
- 카르노(Carnot)
- 랭킨(Rankin)
16. 이상기체로 가정한 2몰의 질소를 250℃ 에서 역학적으로 가역인 정압과정으로 430℃ 까지 가열 팽창시켰을 때 엔탈피변화량 △H 는 약 몇 kJ 인가? (단, 이 온도영역에서 일정압력 열용량의 값은 일정하며, 20.785J/mol K 이다.)
- 3.75
- 7.5
- 15.0
- 30.0
17. 평형에 대한 다음의 조건 중 틀린 것은?(단, φi 는 순수성분의 퓨개시티계수, 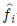 는 혼합물에서 성분 i 의 퓨개시티, ri 는 활동도계수,
는 혼합물에서 성분 i 의 퓨개시티, ri 는 활동도계수, 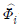 는 성분 i 의 퓨개시티계수이고, xi 는 액상에서 성분 i 의 조성이다. 상첨자 V 는 기상, L 은 액상, S 는 고상, Ⅰ과 Ⅱ 는 두 액상을 나타낸다.)
는 성분 i 의 퓨개시티계수이고, xi 는 액상에서 성분 i 의 조성이다. 상첨자 V 는 기상, L 은 액상, S 는 고상, Ⅰ과 Ⅱ 는 두 액상을 나타낸다.)
- 순수성분의 기-액 평행 :
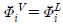
- 2성분 혼합물의 기-액 평행 :
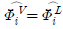
- 2성분 혼합물의 액-액 평형 :
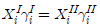
- 2성분 혼합물의 고체-기체 평형 :
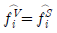
18. 다음 열역학적 성질에 관한 설명 중 틀린 것은?
- 일은 상태함수가 아니다.
- 이상기체에 있어서 Cp - Cv = R 의 식이 성립한다.
- 크기설질은 그 물질의 양과 관계가 있다.
- 변화하려는 경향이 최대일 때 그 계는 평형에 도달하게 된다.
19. 1atm 의 외압 조건에 있는 1mol 의 이상기체 온도를 7.5K 만큼 상승시켰다면 이상기체가 외계에 대하여 한 최대 일의 크기는 몇 cal 인가?
- 14.90
- 15.55
- 17.08
- 18.21
20. 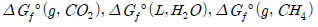 값이 각각 -94.3kcal/mol, -56.7kcal/mol, -12.14kcal/mol 일 때 298K 에서 다음 반응의 표준 깁스에너지 변화 값은 약 몇 kcal/mol 인가? (단, 는 298K 에서의 표준생성 에너지이다.)
값이 각각 -94.3kcal/mol, -56.7kcal/mol, -12.14kcal/mol 일 때 298K 에서 다음 반응의 표준 깁스에너지 변화 값은 약 몇 kcal/mol 인가? (단, 는 298K 에서의 표준생성 에너지이다.)
- -180.5
- -195.6
- -220.3
- -340.2
2과목: 화학공업양론
21. 1mol 의 NH3를 다음과 같은 반응에서 산화시킬 때 O2를 30% 과잉 사용하였다. 만일 반응의 완결도가 85% 라 하면 남아있는 산소는 몇 mol 인가?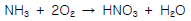
- 0.3
- 0.7
- 0.85
- 0.9
22. H2SO4 15% 인 폐산에 90% 농황산을 가하여 45% 의 산 1500kg 을 만들려고 한다. 폐산 몇 kg 에 농황산 몇 kg 을 혼합해야 하는가?
- 750kg 폐산, 750kg 농황산
- 850kg 폐산, 650kg 농황산
- 600kg 폐산, 900kg 농황산
- 900kg 폐산, 600kg 농황산
23. 101kpa 에서 물 1몰을 353K 에서 393K 까지 가열할 때 엔탈피 변화는 약 몇 J 인가? (단, 물의 비열은 75.0J/molㆍK, 물의 기화열은 47.3kJ/mol, 수증기의 비열은 35.4J/molㆍK 이다.)
- 3102
- 48008
- 49508
- 52080
24. NaOH 6g 을 물에 녹여 전체 용액 100mL 를 만들었다면 이 용액의 몰농도는?
- 1.5M
- 0.15M
- 6.0M
- 0.6M
25. 5atm 의 압력과 가장 가까운 값을 나타내는 것은?
- 516.6kgf/cm2
- 7.07psi
- 50.6mmHg
- 50.66N/cm2
26. 다음과 같은 베르누이 방정식이 적용되는 조건이 아닌 것은?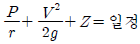
- 정상상태의 흐름
- 이상유체의 흐름
- 압축성유체의 흐름
- 동일 유선상의 유체
27. 탄소 3g을 산소 16g 중에서 완전연서 시켰을 때 연소 후 혼합기체의 부피는 표준상태에서 몇 L 인가?
- 5.6
- 11.2
- 19.8
- 22.4
28. 보일러에 Na2SO3 를 가하여 공급수 중의 산소를 제거한다. 보일러 공급수 100톤에 산소함량 4ppm 일때 이 산소를 제거하는데 필요한 Na2SO3 의 이론량은?
- 3.15kg
- 4.15kg
- 5.15kg
- 6.15kg
29. 단열 과정에서의 P, V, T 관계를 옳게 나타낸 것은? (단, 비열비 r 는 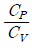 이다.)
이다.)
30. 질소와 수소 혼합가스가 1000 기압을 유지하고 있으며, 수소의 분압이 750 기압이라면 혼합가스의 평균 분자량은 얼마인가?
- 4.3
- 6.4
- 8.5
- 9.6
31. 물의 3중점에 대한 설명 중 옳은 것은?
- 3중점이 존재하는 상태를 규정하기 위한 변수의 수는 3개이다.
- 3중점이 존재하는 상태는 임의로 변화될 수 있다.
- 3중점에서 계의 자유도는 1로서 압력만이 독립변수이다.
- 기체-고체, 기체-액체, 고체-액체 선이 서로 교차하는 점이다.
32. 다음 식을 이용하여 100g 의 N2 를 100℃ 에서 200℃ 까지 가열하는데 필요한 열량을 구하면 약 몇 kcal 인가?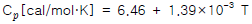
- 1.0
- 1.5
- 2.0
- 2.5
33. 시량변수와 시강변수에 대한 설명으로 옳은 것은?
- 시량변수에는 체적, 온도, 비체적이 있다.
- 시강변수에는 온도, 질량, 밀도가 있다.
- 계의 크기는 무관한 변수가 시강변수이다.
- 시강변수는 계의 상태를 규정할 수 없다.
34. 펄프를 건조기 속에 넣어 수분을 증발시키는 공정이 있다. 이 때 펄프가 70wt% 의 수분을 포함하고, 건조기에서 100kg 의 수분을 증발시켜 30wt% 펄프가 되었다면 원래의 펄프의 무게는 몇 kg 인가?
- 125
- 150
- 175
- 200
35. 다음 중 경로함수끼리 짝지어진 것은?
- 내부에너지 - 일
- 위치에너지 - 엔탈피
- 엔탈피 - 내부에너지
- 일 - 열
36. 양대수 좌표( log - log graph )에서 직선이 되는 식은?
- Y = bx2
- Y = beax
- Y = bx + a
- logY = logb + ax
37. 상대습도가 85% 이고 대기압이 750mmHg 이며 기온이 30℃ 일 때 절대습도는 얼마인가? (단, 30℃에서 수증기의 포화증기압은 31.8mmHg 이다.)
- 0.0116kg H2O/kg 건조공기
- 0.0157kg H2O/kg 건조공기
- 0.0204kg H2O/kg 건조공기
- 0.0232kg H2O/kg 건조공기
38. 20℃ 에서 순수한 MnSO4의 물에 대한 용해도는 62.9 이다. 20℃ 에서 포화용액을 만들기 위해서는 100g 의 물에 몇 g 의 MnSO4ㆍ5H2O 을 녹여야 하는 가? (단, Mn 의 원자량은 55 이다.)
- 120.6
- 140.6
- 160.6
- 180.6
39. 100℃, 765mmHg 에서 기체 혼합물의 분석값이 CO2 14vol%, O2 6Vol%, N2 80Vol% 이었다. 이 때 CO2 분압은 약 몇 mmHg 인가?
- 14
- 31
- 107
- 765
40. 메탄올 42몰%, 물 58몰% 의 혼합액 100몰을 증류하여 메탄올 96몰%의 유출액과 메탄올 6몰% 의 관출액으로 분리하였다. 유출액을 통한 메탄올의 회수율은?
- 0.615
- 0.713
- 0.864
- 0.914
3과목: 단위조작
41. 원 관내를 유체가 난류로 흐를 때 점성 전단(Viscous shear)은 거의 무시되고 에디 점성((Eddy viscosity)이 지배적인 부분은?
- 점성 하층(Viscous sublayer)
- 완충층(Buffer layer)
- 난류 중심(Turbulent core)
- 대수층(Logar layer)
42. 내경 10cm, 두께 4mm 의 외관에 내경 2cm, 두께 2mm 의 관이 들어있는 2중 열교환기의 두 동심관 사이의 환부로 20℃ 의 물이 10cm/s 의 속도로 흐를 때 레이놀드수를 구하면? (단, 20℃ 물의 점도는 1cP 이고 물의 밀도는 1g/cm3이다.)
- 7000
- 7600
- 8000
- 8400
43. 비중 0.8, 점도 5cP 인 유체를 10cm/s 의 평균속도로 안지름 10cm 의 원관을 사용하여 수송한다. Fanning 식의 마찰계수 값은 약 얼마인가?
- 0.1
- 0.01
- 0.001
- 0.0001
44. 80℃ 에서 메탄올의 증기압은 860mmHg, 에탄올 증기압은 540mmHg 이다. 이 두 물질을 혼합하여 80℃ 에서 전압이 1atm 이 되었을 때, 메탄올의 몰 분율은 얼마인가?(단, 혼합액은 이상용액으로 가정한다.)
- 0.45
- 0.54
- 0.69
- 0.91
45. 혼합에 영향을 주는 물리적 조건에 대한 설명으로 옳지 않은 것은?
- 섬유상의 형상을 가진 것은 혼합하기가 어렵다.
- 건조분말과 습한 것의 혼합은 한 쪽을 분할하여 혼합한다.
- 밀도차가 클 때는 밀도가 큰 것이 아래로 내려가므로 상하가 고르게 교환되도록 회전방법을 취한다.
- 액체와 고체의 혼합ㆍ반죽에서는 습윤성이 적은 것이 혼합하기 쉽다.
46. 관벽을 통해 일어나는 열전달에 있어 총괄열전달 계수에 영향을 미치지 않는 인자는?
- 관밖의 열전달 계수
- 관벽의 열전도도
- 관의 외경
- 온도차
47. 정류탑에서 증기유량 V, 탑상 제품 유량 D 및 환류액의 질량유량 L에서 환류비 R에 대한 식으로 틀린것은?
48. 두께 30cm 의 벽돌로 된 평판노벽을 두께 9cm 석면으로 보온하였다. 내면온도와 외면온도가 각각 1000℃ 와 40℃ 일 때 벽돌과 석면사이의 계면온도는 몇 ℃ 가 되는가? (단, 벽돌노벽과 석면의 열전도도는 각각 3.0, 0.1kcal/mㆍhㆍ℃ 이다.)
- 296℃
- 632℃
- 864℃
- 904℃
49. 복사에서 스테판-볼츠만(Stefan-Boltzamann)법칙에 대한 설명에 해당하는 것은?
- 온도평형에서 그 물체의 흡수율에 대한 총 복사력의 비는 그 물체의 온도에만 의존한다.
- 어떤 주어진 온도에서 최대 단색광 복사력은 절대 온도에 역비례한다.
- 큰 표면에 의해 차단되는 작은 표면으로부터 나오는 에너지는 오직 시간에만 의존한다.
- 흑체의 총 복사력은 절대온도의 4승에 비례한다.
50. 탑내에서 기체속도를 점차 증가시키면 탑내 액 정체량(hold up)이 아래로 이동하는 것을 방해할 때의 속도를 무엇이라고 하는가?
- 평균속도
- 부하속도
- 초기속도
- 왕일속도
51. 고-액 추출이나 액-액 추출에서 추제가 갖추어야 할 조건으로 옳지 않은 것은?
- 선택도가 커야 한다.
- 회수가 용이해야 한다.
- 응고점이 낮고 부식성이 적어야 한다.
- 추질과의 비중차가 작아야 한다.
52. 내경이 10cm 인 관에 비중이 0.9, 점도가 1.5cP인 액체가 흐르고 있다. 임계속도는 몇 m/s 인가? (단, 임계 레이놀드수는 2100 이다.)
- 0.035
- 3.5
- 0.562
- 5.62
53. 기체 흡수시 흡수량이나 흡수속도를 크게 하기 위한 조건이 아닌 것은?
- 접촉시간을 크게 한다.
- 흡수계수를 크게 한다.
- 농도와 분압차를 작게 한다.
- 기 - 액 접촉면을 크게 한다.
54. 건조 특성 곡선에서 항율건조 기간에서 강율건조기간으로 변하는 점을 무엇이라고 하는가?
- 자유(free) 함수율
- 평형(equilibrium) 함수율
- 수축(shrink) 함수율
- 한계(critical) 함수율
55. 가로 30cm, 세로 60cm 인 직사각형 단면을 갖는 도관에 세로 45cm 까지 액체가 차서 흐르고 있다. 상당직경(equivalent diameter)은 얼마인가?
- 60cm
- 45cm
- 30cm
- 15cm
56. 환류비에 대한 설명으로 옳지 않은 것은?
- 환류비가 커지면 이론단수는 감소한다.
- 환류비가 무한대일 때 나타나는 단수를 최소이론단 수라 한다.
- 환류비가 크면 클수록 실용적이다.
- 최적 환류비는 시설비와 운전비의 경제성 등을 고려해 구한다.
57. 다음 x(액상조성)-y(기상조성) 도표에서 원료가 비점이하로 공급될 때의 급액선(q-line)은?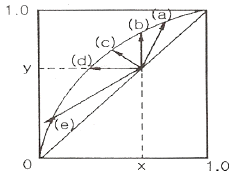
- (a)
- (b)
- (c)
- (d)
58. 증발관의 효율을 크게 하기 위한 방법으로 가장 거리가 먼 것은?
- 관석을 제거하거나 생성속도를 늦춘다.
- 감압하여 비점을 떨어뜨린다.
- 증발관을 열전도도가 큰 금속으로 만든다.
- 액측 경막열전달계수를 작게 한다.
59. 다음 방정식 중 원료공급선(feed line)은? (단, f 는 원료의 흐름 중 기화된 증기분율, y 는 기체분율, x는 액체분율 이다.)
60. 일정한 상대 휘발도를 갖는 A, B 2성분계 증류에서 탑상 및 탑저 제품의 A성분 몰분율이 각각 0.97, 0.06 이라면 최소단수는 얼마인가?(단, 순수한 액체 A와 B의 증기압은 각각 0.8, 0.4atm이다.)
- 6
- 7
- 8
- 9
4과목: 반응공학
61. 다음 그림에 대응하는 라플라스 함수는?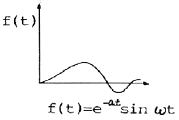
62. 최종값에 도달하는 제어시간은 오래 걸리나 offset을 제거할 수 있는 제어기는?
- 비례 제어기
- 비례-미분 제어기
- 비례-적분 제어기
- 미분 제어기
63. 공정의 정상상태 이득(k), ultimate gain(kcu) 그리고 ultimate period(Pu)를 실험으로 구하였다. k=1, Kcu=4, Pu =6.28일 때, 이와 같은 결과를 주는 일차시간지연 모델, 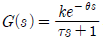 의 시간상수 τ를 구하면?
의 시간상수 τ를 구하면?
- 1.41
- 2.24
- 3.16
- 3.87
64. 다음의 그림과 같이 주어지는 계단함수 u(t)의Laplace변환이 올바른 것은?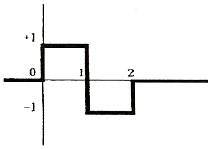
65. 제어기의 와인드업(windup) 현상에 대한 설명 중 잘못된 것은?
- 이 문제를 해소하기 위한 기능을 ant-windup 이라 부른다.
- Windup이 해소되기까지 제어기는 사실상 제어 불능 상태가 된다.
- 공정의 출력이 제어기에 바르게 전달되지 못할 때에 나타나는 현상이다.
- 제어기의 적분동작과 관련된 현상이다.
66. 전달함수에 대한 설명 중 잘못된 것은?
- 입출력 변수 사이의 관계를 나타낸 것이며 초기조건의 영향을 표현하지는 않는다.
- 공정의 동특성이 선형 미분방정석으로 표현된다는 가정하에 얻어진 것이다.
- 공정의 단위 계단응답의 Laplace 변환과 일치한다.
- 전달함수의 입출력 변수는 실제 변수와 정상상태 값과의 차이인 편차변수(deviation variable)이다.
67. 2차계의 과소감쇠(under damped) 단위계단응답에서 상승시간(궁극적인 값에 처음으로 도달하는데 걸리는 시간)을 계산하는 방법은? (단, 공정이득이 1 인 경우이다.)
- 단위계단응답이 0 이 되는 첫 번째 시간을 구한다.
- 단위계단응답이 1 이 되는 첫 번째 시간을 구한다.
- 단위계단응답의 미분값이 0 이 되는 첫 번째 시간을 구한다.
- 단위계단응답의 미분값이 1 이 되는 첫 번째 시간을 구한다.
68. 1차계의 단위계단응답에서 시상수를 실험을 통하여 구하는 방법은?
- 단위계단응답의 초기의 기울기의 0.632를 곱하여 구한다.
- 단위계단응답을 지켜본 후 응답이 더 이상 변하지 않는 시간으로 한다.
- 단위계단응답의 초기 미분 값으로 한다.
- 최종 단위계단 응답값의 63.2%에 도달한 시간을 구한다.
69. 어떤 이차계의 특성방정식의 두 근이 다음과 같다고 할 때 안정한 공정은?
- 1+3i, 1-3i
- -1, 2
- 2, 4
- -1+2i, -1-2i
70. 증류탑의 응축기와 재비기에 수은기둥 온도계를 설치하고 운전하면서 한 시간마다 온도를 읽어 다음 그림과 같은 데이터를 얻었다. 이 데이터와 수은기둥 온도 값 각각의 성지로 옳은 것은?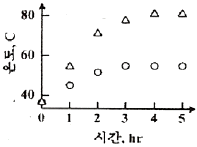
- 연속(continuous),아날로그
- 연속(continuous),디지털
- 이산시간(discrete-time),아날로그
- 이산시간(discrete-time),디지털
71. 피드포워드(feedforward) 제어에 대한 설명 중 옳지 않은 것은?
- 화학공정제어에서는 lead-lag 보상기로 피드포워드 제어기를 설계하는 일이 많다.
- 피드포워드 제어기는 폐루프 제어시스템의 안정도(stability)에 영향을 주지 않는다.
- 제어계 설계시 피드포워드 제어와 피드백 제어 중 하나를 선택하여야 한다.
- 피드포워드 제어기의 설계는 공저의 정적 모델, 혹은 동적 모델에 근거하여 설계될 수 있다.
72. Feedback 제어에 대한 설명 중 옳지 않은 것은?
- 중요변수(CV)를 측정하여 이를 설정값(SP)과 비교하여 제어동작을 계산한다.
- 외란(DV)을 측정할 수 없어도 feedback 제어를 할 수 있다.
- PID 제어기는 feedback 제어기의 일종이다.
- Feedback 제어는 Feedforward 제어에 비해 성능이 이론적으로 항상 우수하다.
73. 다음 그림의 블록선도에서 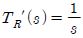 일 때, 서보(servo)문제의 정상상태 잔류편차(offset)는 얼마인가?
일 때, 서보(servo)문제의 정상상태 잔류편차(offset)는 얼마인가?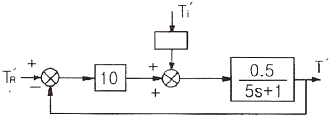
- 0.133
- 0.167
- 0.189
- 0.213
74. 전달함수가 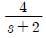 인 1차계의 응답에 관한 옳은 설명은?
인 1차계의 응답에 관한 옳은 설명은?
- 단위사인파 응답의 진폭은 항상 1보다 작다.
- 단위사인파 응답의 위상각은 0과 90°사이이다.
- 단위계단 응답의 최종치는 1이다.
- 단위충격(unit impulse)응답의 최종치는 0이다.
75. 연속 입출력 흐름과 내부 가열기가 있는 저장조의 온도를 어떤 값으로 유지하기 위해 들어오는 입력흐름의 온도와 유량을 조작하여 나가는 출력흐름의 온도와 유량을 제어하고자 하는 시스템을 분류한다면 어떠한 것에 해당하는가?
- 다중 입력-다중 출력 시스템
- 다중 입력-단일 출력 시스템
- 다중 입력-단일 출력 시스템
- 다중 입력-다중 출력 시스템
76. 다음 중 측정 가능한 외란 (measurable disturbance)을 효과적으로 제거하기 위한 제어기는?
- 앞먹임 제어기(Feedforward Controller)
- 되먹임 제어기(Feedback Controller)
- 스미스 예측기(Smith Predictor)
- 다단 제어기(Cascade Controller)
77. 현장에서 주로 쓰이는 대부분의 제어밸브가 등비(equalper centage)조절특성을 나타내는 가장 큰 이유는?
- 밸브의 열림 특석이 좋기 때문이다.
- 밸브의 무반응 영역이 존재하지 않기 때문이다.
- 밸브의 공동화(cavitation)현상이 없기 때문이다.
- 설치밸브특성(installed valve characteristics)이 선형성을 보이기 때문이다.
78. 다음 그림과 같은 제어계의 전달함수 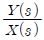 는?
는?
79. PID 제어기의 전달함수의 형태로 옳은 것은?(단, Kc는 비례이득, τI는 적분시간상수, τD는 미분시간상수를 나타낸다.)
80. 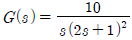 로 표현되는 공정의 제어계에 대한 설명 중 잘못된 것은?
로 표현되는 공정의 제어계에 대한 설명 중 잘못된 것은?
- P 제어기를 사용하면 설정값 계단 변화에 대해 잔류오차(offset)가 발생하지 않는다.
- P 제어기를 사용하면 입력측 외란(input disturbance)계간 변화에 대해 잔류오차(offset)가 발생하지 않는다.
- P 제어기를 사용하면 출력측 외란(output disturbance)계단 변화에 대해 잔류오차(offset)가 발생하지 않는다.
- P 제어기를 사용하는 경우 제한된 비례이득 범위에서만 제어계의 안정성이 보장된다.
5과목: 공정제어
81. 암모니아 합성을 위한 CO가스 전화공정에서 다음과 같은 조성의 A, B 두 가스를 사용할 때 A 가스 100 에 대하여 B 가스를 얼마의 비로 혼합하면 암모니아 합성원료로 적합할 수 있는가? (단, CO 전화 반응효율은 100%로 가정한다.)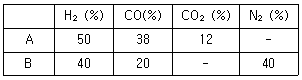
- 147
- 157
- 167
- 177
82. 다음 중 산성이 가장 강한 것은?
- C6H5SO3H
- C6H5OH
- C6H5COOH
- CH3CH2COOH
83. 물과 같은 연속상에 단량체를 액적으로 분산시킨 상태에서 중합하는 방법으로, 고순도의 폴리머가 직접 입상으로 얻어지며, 연속 교반이 필요하고 중합열의 제어가 용이한 중합방법은?
- 괴상 중합
- 용액 중합
- 현탁 중합
- 유화 중합
84. 접착속도가 매우 빨라서 순간접착제로 사용되는 성분은?
- 시아노아크릴레이트
- 아크릴에멀젼
- 에폭시레진
- 폴리이소부틸렌
85. 암모니아 합성용 수소가스의 기본적인 정제순서를 옳게 나타낸 것은?
- 워터가스전화-황화합물제거-CO2제거-CO제거-CH4제거
- CO2제거-황화합물제거-워터가스전화-CO제거-CH4제거
- 워터가스전화-CO2제거-황화합물제거-CO제거-CH4제거
- 황화합물제거-워터가스전화-CO2제거-CO제거-CH4제거
86. 다음 중 연실의 주요 기능은 무엇인가?
- 질소산화물의 회수
- 함질황산을 Glover 탑에 공급
- 함질황산의 탈질
- 기체의 혼합과 SO2를 산화시키는 공간 제공
87. 20℃에서 NaCl 포화용액을 이용하여 이온교환막법으로 NaOH제조시 Cl2 3.55g 를 함께 얻을 수 있었으며, 부반응은 일어나지 않았다. 10A의 일정한 전류로 전기분해를 하였을 경우 총 소요시간은? (단, 원자량은 Na 23, Cl 35.5 이다.)
- 64분 20초
- 32분 10초
- 16분 5초
- 8분 2.5초
88. 삼산화황과 디메틸에테르를 반응시킬 때 주생성물은?
- (CH3)3 SO3
- (CH3)2 SO4
- CH3-OSO3H
- CH3-SO2-CH3
89. 다음 중 칼륨비료의 원료가 아닌 것은?
- 해조
- 초목재
- 칠레초석
- 용광로 dust
90. 황산제조의 원료로 사용되는 것이 아닌 것은?
- 황철광
- 자류철광
- 자철광
- 황동광
91. Cyclone 의 주된 집진원리에 해당되는 것은?
- 여과
- 원심력
- 전하작용
- 작용ㆍ반작용
92. 도시가스 제조 프로세스 중 접촉분해 공정에 대한 설명으로 옳지 않은 것은?
- 일정온도, 압력 하에서 수증기 비를 증가시키면 CH4, CO2 의 생성이 많아진다.
- 반응압력을 올리면 CH4, CO2 의 생상이 많아진다.
- 반응온도를 상승시키면 CO, H2 가 많이 생성된다.
- 촉매를 사용하여 반응온도는 400~800℃ 이며 탄화수소와 수증기를 촉매 반응시키는 방법이다.
93. 다음 중 니트로벤젠을 환원시킬 때 첨가하여  을 가장 많이 생성하는 것은?
을 가장 많이 생성하는 것은?
- Zn+ acid
- Zn + water
- Cu +H2
- Fe + acid
94. 다음 중 암모니아 산화반응시 촉매로 주로 쓰이는 것은?
- Nd - Mo
- Ra
- Pt - Rh
- Al2O3
95. 일반적으로 화장품, 의약품, 정밀화학 제조 등의 화학공업에 주로 사용되는 반응 공정은 어떠한 형태인가?
- 회분식 반응 공정
- 연속식 반응 공정
- 유동층 반응 공정
- 관형 반응 공정
96. 부타디엔에 무수말레인산을 부가하여 환상화합물을 얻는 반응은?
- Diels-Alder 반응
- Wolff-Kishner 반응
- Gattermann-Koch 반응
- Fridel-Craft 반응
97. 황산제조방법 중 연실법에 있어서 장치의 능률을 높이고 경제적으로 조업하기 위하여 개량된 방법 및 설비가 아닌 것은?
- OPL 법
- Pertersen Tower 법
- Meyer 법
- Mosanto 법
98. 하루 117ton 의 NaCl 을 전해하는 NaOH 제조 공장에서 부생되는 H2 와 Cl2 를 합성하여 36.5% HCl을 제조할 경우 하루 약 몇 ton 의 HCl 이 생산되는 가? (단, NaCl 은 100%, H2 와 Cl2는 99% 반응하는 것으로 가정한다.)
- 200
- 185
- 56
- 100
99. 가성소다 제조시 수은법에서 해홍실에 넣어 단락 전지를 구성하는 물질은?
- 흑연
- 철
- 구리
- 니켈
100. 질소비료 중 암모니아를 원료를 하지 않는 비료는?
- 황산암모늄
- 요소
- 질산암모늄
- 석회질소
6과목: 화학공업개론
101. 균일계 1차 액상 반응이 이상 관형 반응기(ideal tubular reactor)에서 전화율 50% 로 진행된다. 다른 조건은 동일하고 반응기의 크기만 2배로 늘린다면 전화율은?
- 67%
- 75%
- 90%
- 100%
102. 부피가 5L 인 회분식반응기에 어떤 출발원료 200kg 을 넣고 일정한 시간동안 반응시켰더니 5kg 이 남아 있었다. 반응식이 2A + B → P 일 때 반응물질 A(출발원료)의 전환율은 몇 % 인가? (단, A 와 B 의 초기 몰 비는 2:1 이다.)
- 92%
- 96.5%
- 97.5%
- 98.5%
103. 어떤 반응의 온도를 24℃ 에서 34℃ 로 증가시켰더니 반응 속도가 2.5배로 빨라졌다면, 이 때의 활성화 에너지는 몇 kcal 인가?
- 10.8
- 12.8
- 16.6
- 18.6
104. A → P 1차 액상반응이 부피가 같은 N 개의 직렬 연결된 완전혼합 흐름반응기에서 진행될 때 생성물의 농도변화를 옳게 설명한 것은?
- N 이 증가하면 생성물의 농도가 점진적으로 감소하다 다시 증가한다.
- N 이 작으면 체적 합과 같은 관형반응기 출구의 생성물 농도에 접근한다.
- N 은 체적 합과 같은 관형반응기 출구의 생성물 농도에 무관하다.
- N 이 크면 체적 합과 같은 관형반응기 출구의 생성물 농도에 접근한다.
105. 혼합 흐름 반응기에서 반응 속도식이 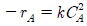 인 반응에 대해 50% 전화율을 얻었다. 모든 조건을 동일하게 하고 반응기의 부피만 5배로 했을 경우 전화율은?
인 반응에 대해 50% 전화율을 얻었다. 모든 조건을 동일하게 하고 반응기의 부피만 5배로 했을 경우 전화율은?
- 0.6
- 0.73
- 0.8
- 0.93
106. 반응기에 유입되는 물질량의 체류시간에 대한 설명으로 옳지 않은 것은?
- 반응물의 부피가 변하면 체류시간이 변한다.
- 반응물이 실제의 부피 유량으로 흘러 들어가면 체류시간이 달라진다.
- 액상반응이면 공간시간과 체류시간이 같다.
- 기상반응이면 공간시간과 체류시간이 같다.
107. 반응차수 1차인 반응의 반응물 A 를 공간시간(space time)이 같은 다음의 반응기에서 반응을 진행시킬 때 가장 유리한 반응기는?
- 이상 혼합 반응기
- 이상 관형 반응기
- 이상 관형 반응기와 이상 혼합 반응기의 직렬 연결
- 전화율에 따라 다르다.
108. A + B → R 인 2차 반응에서 CAO 와 CBO 의 값이 서로 다를 때 반응속도 상수 k 를 얻기 위한 방법은?
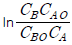 와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다.
와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다.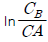 와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다.
와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다.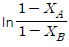 와 t 를 도시(plot)하여 절편이
와 t 를 도시(plot)하여 절편이 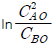 인 직선을 얻는다.
인 직선을 얻는다.- 기울기가 1 +(CAO - CBO)2k 직선을 얻는다.
109. 일반적으로 암모니아(ammonia)의 상업적 합성반응은 다음 중 어느 화학반응에 속하는가?
- 균일(homogeneous) 비촉매 반응
- 불균일(heterogeneous) 비촉매 반응
- 균일촉매(homogeneous catalytic) 반응
- 불균일촉매(heterogeneous catalytic) 반응
110. 양론식 A + 3B → 2R + S 가 2차반응 -rA = k1CACB 일 때 rA, rB 와 rR 의 관계식으로 옳은 것은?
- rA = rB = rR
- -rA = -rB = rR
- -rA = -(1/3)rB =(1/2)rR
- -rA = -3rB = 2rR
111. 가장 일반적으로 사용되는 반응 속도식은?
112. A → R 인 비가역 1차 반응에서 다른 조건이 모두 같을 때 초기농도 CA0 를 증가시키면 전화율은?
- 증가한다.
- 감소한다.
- 일정하다.
- 처음에는 증가하다가 점차 감소한다.
113. 1atm, 610K 에서 다음과 같은 가역 기초반응이 진행될 때 평형상수 Kp 와 정반응 속도식 kp1PA2 의 속도상수 kp1이 각각 0.5atm-1 과 10mol/Lㆍatm2ㆍh 일 때 농도항으로 표시되는 역반응 속도 상수는? (단, 이상기체로 가정한다.)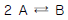
- 1000 h-1
- 100 h-1
- 10 h-1
- 0.1 h-1
114. 유동층 반응기에 대한 설명 중 가장 거리가 먼 내용은?
- 유동층에서의 전화율은 고정층 반응기에 비하여 낮다.
- 유동화 물질은 대부분 고체이다.
- 석유나프타의 접촉분해 공정에 적합하다.
- 작은 부피의 유체를 처리하는데 적합하다.
115. 그림과 같이 3개의 플러그 흐름 반응기를 2개는 직렬로 연결한 뒤 다시 나머지 하나와 병렬로 연결된 반응조가 있다. 이 때 반응물 A 를 FA0[mol/min] 으로 F 지점에 공급했을 때 D 와 E 로 보내지는 반응물의 몰 유량 FA0.D와 FA0.E 를 옳게 나타낸 것은?(단, 반응이 완결된 뒤인 G 지점에서의 전화율은 동일하다.)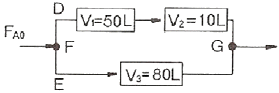
116. 균일 반응 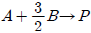 에서 반응속도가 옳게 표현된 것은?
에서 반응속도가 옳게 표현된 것은?
117. A → B 1차 액상 등온반응이 진행될 때 반응속도, 전화율, 반응물 농도와의 관계를 옳게 설명한 것은?
- 반응물 농도가 크면 반응 속도는 커진다.
- 전화율이 1 이면 반응 속도는 최대이다.
- 반응물 농도가 0 이면 반응 속도는 커진다.
- 전화율이 0 이면 반응 속도는 최소이다.
118. A → P의 비가역 1차 반응에서 A 의 전화율 관련식을 옳게 나타낸 것은?(단, NA0는 초기의 몰수이고 NA는 시간 t 에서 존재하는 몰수이다.)
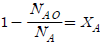
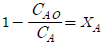
- NA = NAO(1 - XA)
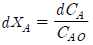
119. 기상 1차 반응에 관한 속도식을 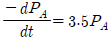 , 단위를 [atm/h] 로 표시할 때 반응 속도상수 3.5 의 단위로 옳은 것은?
, 단위를 [atm/h] 로 표시할 때 반응 속도상수 3.5 의 단위로 옳은 것은?
- h-1
- atmㆍh
- atm-1ㆍh-1
- atmㆍh-1
120. A → 2R 인 기체상 반응은 기초 반응(elementary Teaction)이다. 이 반응이 순수한 A 로 채워진 부피가 일정한 회분식(batch) 반응기에서 일어날 때 10분 반응후 전화율이 80% 이었다. 이 반응을 순수한 A 를 사용하며, 공간시간(space time)이 10분인 mixed flow 반응기에서 일으킬 경우 A 의 전화율은 약 얼마인가?
- 91.5%
- 80.5%
- 65.5%
- 51.5%






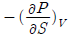
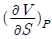
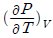
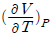
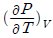
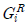 과 φi와의 관계는
과 φi와의 관계는 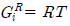 Inφi로 표시된다." 이다.
Inφi로 표시된다." 이다.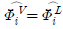 " 이 조건은 틀린 것이다. 이유는 이 식에서는 φ1과 φ2가 같다고 가정하고 있지만, 혼합물에서는 이러한 가정이 성립하지 않기 때문이다. 따라서, 2성분 혼합물의 기-액 평행은 일반적으로 성립하지 않는다.
" 이 조건은 틀린 것이다. 이유는 이 식에서는 φ1과 φ2가 같다고 가정하고 있지만, 혼합물에서는 이러한 가정이 성립하지 않기 때문이다. 따라서, 2성분 혼합물의 기-액 평행은 일반적으로 성립하지 않는다.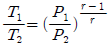
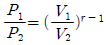
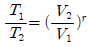
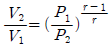
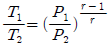 "
"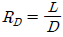
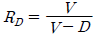
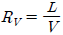
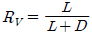
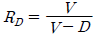 " 이다.
" 이다. 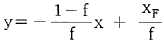
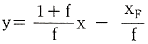
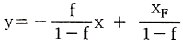
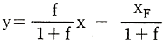
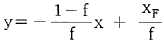 " 이다. 이유는 원료공급선은 액체와 기체의 혼합물의 조성이 변하지 않는 선이기 때문이다. 따라서, 액체분율 x와 기체분율 y의 합이 일정한 "
" 이다. 이유는 원료공급선은 액체와 기체의 혼합물의 조성이 변하지 않는 선이기 때문이다. 따라서, 액체분율 x와 기체분율 y의 합이 일정한 "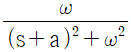
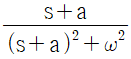
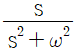
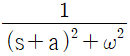
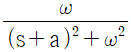 " 이다.
" 이다.
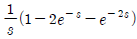
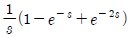
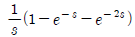
 " 이다.
" 이다.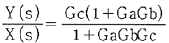
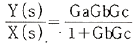
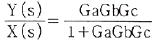
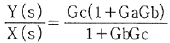
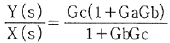 " 이다.
" 이다.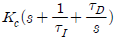
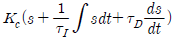
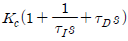
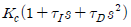
 을 환원시키기 때문입니다. 반면에 "Zn + acid"는 산과 반응하여 수소를 방출하고 이때 생성되는 수소가
을 환원시키기 때문입니다. 반면에 "Zn + acid"는 산과 반응하여 수소를 방출하고 이때 생성되는 수소가 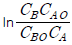 와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다."는 위에서 설명한 것처럼, ln(CA/CA0)와 ln(CB/CB0)를 그래프로 나타내어 두 개의 직선을 얻는 것을 의미한다.
와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다."는 위에서 설명한 것처럼, ln(CA/CA0)와 ln(CB/CB0)를 그래프로 나타내어 두 개의 직선을 얻는 것을 의미한다.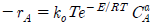
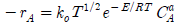
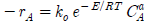
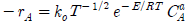
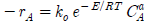 " 이다. 이유는 이 식이 가장 간단하면서도 대부분의 반응에서 적용 가능하기 때문이다. 이 식은 반응 속도가 반응물 농도의 몇 제곱에 비례하는지를 나타내는데, 이는 대부분의 반응에서 적용 가능하다. 또한, 이 식은 반응 속도 상수인 k를 구하기 쉽기 때문에 많이 사용된다.
" 이다. 이유는 이 식이 가장 간단하면서도 대부분의 반응에서 적용 가능하기 때문이다. 이 식은 반응 속도가 반응물 농도의 몇 제곱에 비례하는지를 나타내는데, 이는 대부분의 반응에서 적용 가능하다. 또한, 이 식은 반응 속도 상수인 k를 구하기 쉽기 때문에 많이 사용된다.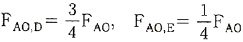
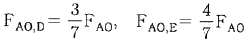
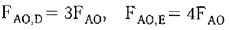
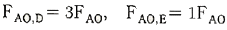
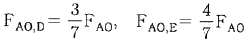 " 이다.
" 이다.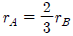
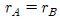
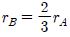
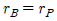
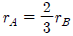 " 이다. 이유는 반응속도는 농도 변화율에 비례하기 때문이다. "
" 이다. 이유는 반응속도는 농도 변화율에 비례하기 때문이다. "