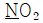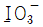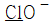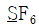1과목: 화학개론
1. 1nm와 같은 길이는?
- 1×10-12 mm
- 1×102 pm
- 1×10 Å
- 1×10-2 μm
2. 원소 13C의 중성자수는?
- 1
- 3
- 6
- 7
3. 수산화 나트륨(NaOH) 용액 300mL에 NaOH 120g이 녹아 있을 때, 이 용액의 몰농도[M]는? (단, NaOH의 화학식량은 40 이다.)
- 10
- 40
- 160
- 300
4. 원자가 껍질 전자쌍 반발(valence shell electron pair repulsion) 이론에 기초하여 예측한 포름알데히드(HCHO)의 분자 모양은?
- 선형
- 정사면체형
- 삼각쌍뿔형
- 평면삼각형
5. 밑줄 친 원소 중 가장 큰 산화수를 갖는 것은?
6. 음이온의 화학식과 이름이 옳지 않은 것은?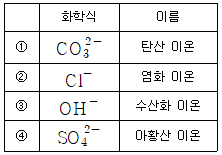
- ①
- ②
- ③
- ④
7. 분자 오비탈에 대한 설명으로 옳지 않은 것은?
- 결합 차수가 커지면 결합 길이도 길어진다.
- 분자 오비탈 이론으로 산소 분자의 상자기성을 설명할 수 있다.
- 개의 원자 오비탈이 겹쳐지면 개의 분자 오비탈이 생긴다.
- 반결합성 분자 오비탈의 에너지는 분자를 형성하는 원자 오비탈의 에너지보다 높다.
8. 용액의 농도를 나타내는 방법 중 온도에 따라 변할 수 있는 것은? (단, 용액은 증발하지 않는다고 가정한다.)
- 몰농도
- 몰분율
- 몰랄 농도
- 질량 백분율
9. 990g의 미지 시료를 분석했을 때 558g의 인(P)과 432g의 산소(O)가 들어 있고, 다른 원소는 검출되지 않았다. 이 시료의 실험식은? (단, P와 O의 원자량은 각각 31과 16이다.)
- PO3
- P2O3
- P2O5
- P3O5
10. 염색공장에서 발생한 6M의 황산(H2SO4) 용액 2m3를 4M의 수산화 나트륨(NaOH) 용액으로 중화하는 데 필요한 NaOH 용액의 양[m3]은?
- 2
- 3
- 6
- 12
11. 다음은 0℃, 1atm 에서 프로페인(C3H8)의 연소 반응식이다. 프로페인 2L가 완전 연소할 때 생성되는 이산화 탄소(CO2)의 부피[L]는? (단, 기체는 이상 기체이다.)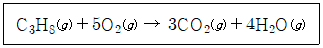
- 2
- 3
- 5
- 6
12. 4V의 배터리로 30분 동안 2A의 일정한 전류를 보낼 때, 배터리가 행한 전기적 일[kg]은?
- 3.6
- 14.4
- 3,600
- 14,400
13. 300K에서 다음 반응의 △G°[kJ/mol]는? 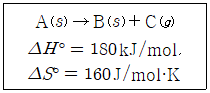
(단, G°는 표준 깁스 자유 에너지(standard Gibbs free energy), H°는 표준 엔탈피(standard enthalpy), S°는 표준 엔트로피(standard entropy)이다.)
- -180
- -48
- 132
- 180
14. 주양자수(n)가 4일 때, 오비탈과 양자수에 대한 설명으로 옳지 않은 것은?
- 각운동량 양자수(l)는 0, 1, 2, 3 이다.
- 껍질 내의 전체 오비탈 수는 16개이다.
- 부껍질에는 4s, 4p, 4d, 4f가 포함된다.
- 자기 양자수(ml)는 0을 포함한 -4에서 4까지의 정숫값을 갖는다.
15. 다음은 T℃에서 A(g)와 B(g)가 반응하여 C(g)가 생성되는 반응이다. 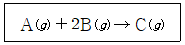
표가 A와 B의 초기 몰농도에 따른 반응 속도를 나타낼 때, 반응 속도 법칙은? (단, k는 속도 상수이고, [A]와 [B]는 각각 A와 B의 몰농도이다.)
- 속도 = k[A]2
- 속도 = k[A][B]2
- 속도 = k[A]3
- 속도 = k[A]3[B]
16. (가)와 (나)는 두 완충 용액의 해리 평형식이다. 완충 용액의 pH가 각각 6.4일 때, 각 완충 용액의 산과 염기의 상대적인 농도를 비교한 것으로 옳은 것은? (단, Ka는 산 해리 상수이다.)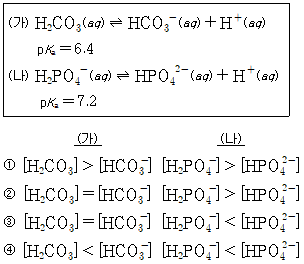
- ①
- ②
- ③
- ④
17. 국제 단위계(SI unit) 기본 단위의 물리량과 단위 기호로 옳은 것은?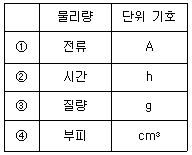
- ①
- ②
- ③
- ④
18. 다음 화학 반응식의 계수를 바르게 나열한 것은?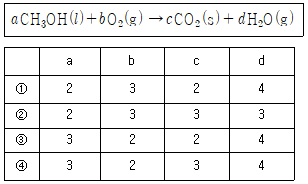
- ①
- ②
- ③
- ④
19. ZN2+ + 2e- → Zn의 환원 반응을 통해 금속 물체에 아연을 도금한다. 이때 충분한 양의 아연 이온이 수용액 속에 녹아 있다면, 0.0005mol 의 아연을 금속 물체에 도금하기 위해서 0.1A의 전류를 몇 초간 흘려줘야 하는가? (단, 패러데이 상수는 96,000 C/mol이고, 모든 전류는 아연 이온의 환원 반응에만 사용된다.)
- 960초
- 1,920초
- 9,600초
- 19,200초
20. HClO3에서 염소(Cl)의 산화수는?
- 3
- 4
- 5
- 7
21. 염화 소듐(NaCl)의 단위 세포를 그림과 같이 나타낼 때, 이에 대한 설명으로 옳지 않은 것은? (단, r+와 r-는 각각 양이온과 음이온의 이온 반지름이다.)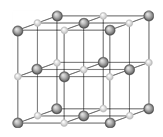
- r+/r-는 CsCl보다 크다.
- MgO보다 녹는점이 낮다.
- Cl-이온은 면심 입방 구조를 이룬다.
- 양이온과 음이온의 배위수는 각각 6 이다.
22. 바닥 상태의 전자 배치로 옳은 것은?
- Al : 1s22s22p63s23p2
- P : 1s22s22p63s23p3
- S2- : 1s22s22p63s23p5
- Ca2+ : 1s22s22p63s23p64s1
23. 질량이 200g이고, 온도가 80℃인 고체 X를 20℃의 물 500g이 담긴 스티로폼 컵에 넣었다. 이 계가 열 평형 온도 30℃에 도달했을 때, 물체 X의 비열[J/g·K]은? (단, 물의 비열은 4J/g·K이고, 컵의 비열은 무시한다.)
- 1
- 2
- 4
- 10
24. 원자가 결합 이론(valence bond theory)에 따라 원자 오비탈이 혼성 오비탈을 형성할 때, 에틸렌(C2H4)에서 탄소 원자의 혼성 오비탈은?
- sp
- sp2
- sp3
- dsp
25. 화학 반응 (가)~(다)에서 환원제로 작용하는 물질은?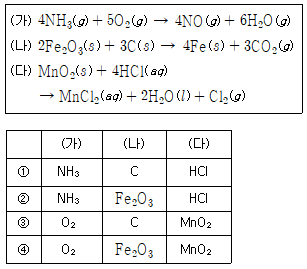
- ①
- ②
- ③
- ④
26. 화학 평형(chemical equilibrium)에 대한 설명으로 옳지 않은 것은?
- 평형식은 반응 메커니즘에 따라 달라진다.
- 화학 평형에서 정반응과 역반응의 속도는 같다.
- 정반응의 평형식은 역반응의 평형식의 역수이다.
- 평형에 있는 어떤 계에 변화가 가해지면, 그 변화를 감소시키려는 방향으로 평형의 위치는 이동한다.
27. (가)~(다)는 25℃에서의 열화학 반응을 나타낸 것이다. 반응 ClF(g) + F2(g) → ClF3(g)의 △H[kJ/mol]는?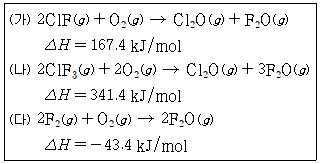
- -217.4
- -130.2
- -108.7
- 217.4
28. 산과 염기에 대한 설명으로 옳지 않은 것은?
- 황산(H2SO4)은 이양성자산이다.
- 루이스 염기는 전자쌍 받개이다.
- 브뢴스테드-로리 산은 양성자를 주는 물질이다.
- 아레니우스 산-염기 개념은 수용액에만 적용된다.
29. 기체 분자 운동론(kinetic molecular theory of gas)에 대한 설명으로 옳지 않은 것은?
- 입자의 크기는 무시할 수 있을 정도로 작다.
- 입자의 평균 운동 에너지는 절대 온도에 반비례한다.
- 한 입자와 다른 입자(또는 벽)의 충돌은 완전 탄성 충돌이다.
- 입자 사이의 인력과 반발력은 무시할 수 있을 정도로 작다.
30. 아세틸렌(C2H2) 을 완전 연소시킬 때 필요한 산소(O2)의 질량[g]과 이때 생성되는 물(H2O)의 질량[g]은? (단, C, H, O의 원자량은 각각 12, 1, 6이다.)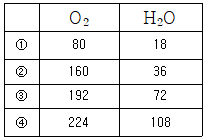
- ①
- ②
- ③
- ④
31. 온도 T℃에서 산소(O2) 기체 분자의 분출(effusion) 속도가 500m/s일 때, 같은 온도에서 수소(H2) 기체 분자의 분출 속도[m/s]는? (단, 기체는 그레이엄의 분출 법칙(Graham's law of effusion)을 따르고, O2와 H2의 화학식량은 각각 32와 2이다.)
- 500
- 1,000
- 1,500
- 2,000
32. 화학 반응 (가)와 (나)의 평형 상수 K1과 K2를 이용하여 2Cu(s) + O2(g) ⇌ 2CuO(s)의 평형 상수를 표현한 것으로 옳은 것은?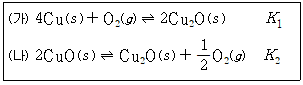
- (K1)(K2)
- (K1)(K2)0.5
- (K1)0.5/(K2)
- (K1)/(K2)2
33. 25℃물에서 HCN의 산 해리 상수는 6.2×10-10이고, HF의 산 해리 상수는 6.6×10-4이며, HPO42-의 산 해리 상수는 2.2×10-13일 때, 이온의 염기 세기를 순서대로 옳게 나열한 것은?
- F- > PO43- > CN-
- F- > CN- > PO43-
- PO43- > CN- > F-
- CN- > F- > PO43-
34. 일정 온도에서 5L, 600mmHg의 뷰테인(C4H10(g))이 2L로 변화했을 때의 압력[mmHg]은? (단, 기체는 이상 기체이다.)
- 600
- 900
- 1,200
- 1,500
35. 산소(O2) 16.0g과 메테인(CH4) 8.0g의 기체 혼합물을 0℃에서 22.4L 용기에 채웠다. 이 기체 혼합물이 들어 있는 용기의 전체 압력[atm]은? (단, 모든 기체는 이상 기체이고, 기체 상수는 0.08206 L·atm/mol·K 이다. C, H, O의 원자량은 각각 12, 1, 16이다.)
- 0.5
- 1.0
- 1.5
- 2.0
36. 다음 침전 반응에 포함된 구경꾼 이온만으로 짝 지어진 것은?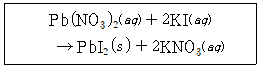
- Pb2+, I-
- Pb2+, NO3-
- K+, I-
- K+, NO3-
37. 초기 온도가 95℃인 물 0.05kg에서 1,200J의 열이 방출되었을 때, 물의 최종 온도[℃]는? (단, 물의 비열은 4J/g·K 이다.)
- 6
- 35
- 60
- 89
38. 주양자수(n)가 3이고 각운동량 양자수(l)가 2인 오비탈에 들어갈 수 있는 최대 전자수는?
- 2
- 6
- 10
- 14
39. 격자 에너지는 고체 이온 결합 화합물 1몰의 모든 이온을 기체 상태의 이온으로 완전히 분리하는 데 필요한 에너지이다. 다음 자료를 본-하버 순환(Born-Haber cycle)에 적용하여 계산한 RbCl의 격자 에너지[kJ/ol]는? (단, I1은 1차 이온화 에너지, EA는 전자 친화도이다.)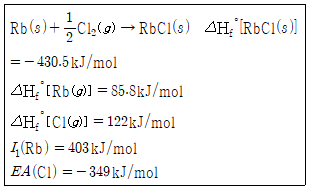
- -46.7
- -168.7
- 692.3
- 861.0
40. 다음은 오존(O3)의 분해 반응 2O3(g) ⇌ 3O2(g)에 대한 반응 메커니즘이다. 2단계가 속도 결정 단계이고, 1단계 평형은 2단계에 비해 훨씬 빠르다고 가정할 때, O3 분해 반응의 속도식은? (단, k는 속도 상수이다.)
- 속도 = k[O3]
- 속도 = k[O3]2
- 속도 = k[O3]2[O2]
- 속도 = k[O3]2[O2]-1