1과목: 일반화학
1. 다음 각 쌍의 2개 물질 중에서 물에 더욱 잘 녹을 것이라고 예상되는 물질을 1개씩 옳게 선택한 것은?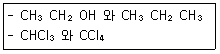
- CH3CH2OH, CHCl3
- CH3CH2OH, CCl4
- CH3CH2CH3, CHCl3
- CH3CH2CH3, CCl4
2. 고리구조를 갖지 않는 어떤 화합물의 화학식이 C4H8 일 경우 이 물질이 갖는 이성질체수는 모두 몇 개인가?
- 1개
- 2개
- 3개
- 4개
3. 원자번호가 11 이고 , 질량수가 23 인 나트륨 원자핵에서 중성자수는 얼마인가?
- 11
- 12
- 13
- 23
4. 수소이온의 농도가 1.0 × 10-7M 인 용액의 pH 는?
- 6.00
- 7.00
- 8.00
- 9.00
5. 다음의 산화환원반응식에 대한 설명 중 틀린 것은?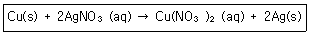
- 산화수 0 의 구리(Cu) 는 반응 후에 +2 로 산화수가 증가하였다.
- 구리(Cu)는 전자 2개를 얻어 산화된다.
- 은이온(Ag+)은 산화수가 +1에서 반응 후에는 0의 산화수를 갖는다.
- 2개의 은이온(Ag+)은 각각 1개씩의 전자를 얻어 환원 된다.
6. 20wt% NaOH 용액으로 1M NaOH 용액 100mL 를 만들려고 할 때 다음 중 가장 옳은 방법은?
- 20% 용액 20g 에 60g 의 물을 가한다.
- 20% 용액 20mL 에 물을 가해 100mL 로 만든다.
- 20% 용액 20g 에 물을 가해 100mL 로 만든다.
- 20% 용액 20mL 에 80mL 의 물을 가한다.
7. 다음 물질의 극성에 관한 설명 중 틀린 것은?
- 물은 극성 물질이다.
- 영화수소는 극성 물질이다.
- 암모니아는 비극성 물질이다.
- 이산화탄소는 비극성 물질이다.
8. 다음 중 실험식이 다른 것은 어는 것인가?
- CH2O
- C2H6O2
- C6H12O6
- C3H6O3
9. 비중이 1.8 이고, 순도가 96% 인 황산 용액의 몰농도를 구하면 약 몇 M 인가?
- 5.4
- 17.6
- 18.4
- 35.2
10. 40.9% C, 4.6% H, 54.5% 0 의 질량백분율 조성을 가지는 화합물의 실험식에 가장 가까운 것은?
- CH2O
- C3H4O3
- C6H5O6
- C3H6O3
11. 0℃, 1atm에서 0.495g 의 알루미늄이 모두 반응할 때 발생되는 수소 기체의 부피는 약 몇 L 인가?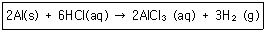
- 0.033
- 0.308
- 0.424
- 0.616
12. 다음 산화환원반응식의 계수 (a), (d), (c) 를 옳게 나타낸 것은? (단, n은 점수이다.)
- (a):2, (b):2, (c):2
- (a):2, (b):2, (c):3
- (a):2, (b):1, (c):2
- (a):4, (b):2, (c):2
13. 이소프로필알코올(isopryl alxohol)음 다음 중 어느 구조인가?
- CH3-CH2-CH
- CH3-CH(OH)-CH3
- CH3-CH(OH)-CH2-CH3
- CH3-CH2-CH2-OH
14. Rutherford 의 알파입자 산란실험을 통하여 알게된 것은 다음 중 무엇인가?
- 전자
- 양성자
- 원자핵
- 전하
15. 납축전지의 전체 반응식은 다음과 같다. 산화-환원식을 이용하여 계수를 맞추고 반응식을 완결하면 PbSO4(s) 의 계수는 얼마인가?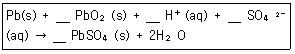
- 1
- 2
- 3
- 4
16. 525℃ 에서 다음 반응에 대한 평형상수 K 값은 3.35×10-3 mol/L 이다. 이 때 평형에서 이산화탄소 농도를 구하면 얼마인가?
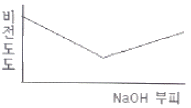
- 0.84×10-3mol/L
- 1.68×10-3mol/L
- 3.35×10-3mol/L
- 6.77×10-3mol/L
17. 다음 산의 명명법으로 옳은 것은?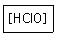
- 염소산
- 아염소산
- 과염소산
- 하이포아염소산
18. O2- ,F, F- 를 지름이 작은 것부터 큰 순서로 나열한 것은?
- O2-<F<F-
- F<F-<O2-
- F<O2-<F-
- F-<O2-<F
19. 질소분자 1.07 × 1023 개는 몇 몰(mol)에 해당하는가?
- 6.85 × 1024
- 1.67 × 1021
- 11.4
- 0.178
20. 수용액의 산성도를 나타내는 pH 에 대한 설명 중 옳지 않은 것은?
- pH 값은 pH = -log10[H3O+] 로부터 구할 수 있다.
- pH 가 7 보다 작은 경우를 산성용액이라 한다.
- 중성용액의 pH는 14 이다.
- pH meter 를 이용하여 측정할 수 있다.
2과목: 분석화학
21. 활동도(activity)가 0.24M 인 0.30M 용액의 활동도계수(activity coefficient)는?
- 0.24
- 0.3
- 0.8
- 1.25
22. 다음 적정에 관한 용어의 설명의 설명 중 틀린 것은?
- 종말점(end point)은 분석물질과 적정액이 정확하게 화학 양론적으로 가해진 점이다.
- 당량점(equivalent point)은 종말점의 차이를 적정오차(titration error)라고 한다.
- 적정은 분석물과 시약 사이의 반응이 완전하게 완결되었다고 판단될 때 가지 표준시약을 가하는 과정이다.
- 역적정은 분석물질에 농도를 알고 있는 첫 번째 표준시약을 과량 가해 반응시키고, 두 번째 표준시약을 가하여 첫 번째 표준시약의 과량을 적정하는 방법이다.
23. EDTA 적정에 사용되는 xylenol orange와 같은 금속이온 지시약의 설명 중 틀린 것은?
- 금속이온 지시약은 PH에 따라 색이 변한다.
- 산화-환원제로서 전위(potential)에 따라 색이 다르다.
- 지시약은 EDTA 보다 약하게 금속과 결합해야만 한다.
- 금속이온과 결합하면 색깔이 변해야 한다.
24. 0.1M의 Fe2+ 50ml를 0.1M의 TI3+로 적정한다. 반응식과 각각의 표준환원전위가 다음과 같을 때 당량점에서 전위(V)는 얼마인가?
- 0.94
- 1.02
- 1.11
- 1.20
25. 다음 산화환원 반응에 대한 설명 중 틀린 것은?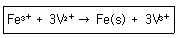
- Fe3+의 전자수가 증가 되었다.
- Fe3+가 환원되었다.
- Fe3+는 산화제이다.
- Fe(s)의 산화수는 3이다.
26. 다음 중 압력의 크기가 작은 값부터 큰 순서대로 옳게 표시된 것은?
- 1atm<1Pa<1mmHg<1bar
- 1Pa<1mmHg<1bar<1tam
- 1mmHg<1bar<1atm<1Pa
- 1Pa<1atm<1mmHg<1bar
27. 옥살산(H2C2O4)은 뜨거운 산성용애에서 과망강산 이온(MnO4-)과 다음과 같이 반응한다. 이 반응에서 지시약 역할을 하는 것은?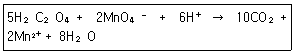
- H2C2O4
- MnO4-
- CO2
- H2O
28. 다음 반응에서 염기-짝산과 산-짝염기 쌈을 각각 옳게 나타낸 것은?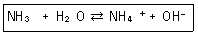
- NH3-OH-, H2O-NH4+
- NH3-NH4+, H2O-OH-
- H2O-NH3, NH4+-OH-
- H2O-NH4+, NH3-OH-
29. 다음 반응에서 평형상수 K는 1.6×1037일 때 이 반응의 표준전극전위 E0는 몇 V인가?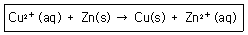
- 0.10
- 1.10
- 0.70
- 1.70
30. 산화ㆍ환원 적정에서 널리 쓰이는 MnO4- 용액에 대한 설명 중 틀린 것은?
- 어두운 속에 보관해야 한다.
- 모든 산 용액에서 안정하다.
- 용액 내에서 고체가 보이면 거르기와 재표준화를 하여야 한다.
- MnO4 용액은 끓여서는 안된다.
31. 0.122M 인 약산(HA, pKa=9.747)59.6ml 용액에 0.0431M의 NaOH 몇 mL를 첨가하면 pH 8.00용액을 만들 수 있는가?
- 29.7
- 2.97
- 0.297
- 0.0297
32. EDTA는 양이온과 다음 중 무엇을 형성하기 위하여 결합하는가?
- 킬레이트
- 고분자
- 이온교환수지
- 이온결합화합물
33. 산화-환원적정에서 과망간산칼륨은 산성 수용액에서 많이 사용되는 산화제이다. 산성용액에서 과망간산이온이 환원되어 시료를 산회시킨다면 과망간산이온의 환원반응식은 다음 중 어느 것인가?
- MnO4-+6H++3e-→MnO(s)+3H2O
- MnO4-+8H++5e-→Mn2++4H2O
- MnO4-+6H++5e-→MnO(s)+3H2O
- MnO4-+8H++3e-→Mn4++4H2O
34. 다음 용액 중 이온세기를 잘못 나타낸 것은?
- 0.10M NaNO3의 이온세기는 0.10M 이다.
- 0.10M Na2SO4의 이온세기는 0.20M 이다.
- 0.020M KBr의 이온세기는 0.020M 이다.
- 0.030M ZnSO4의 이온세기는 0.12M 이다.
35. 다음 요오드화 반응에 대한 설명 중 틀린 것은?
- 요오드를 적정액으로 사용한다는 것은 I2에 과량의 I-가 첨가된 용약을 사용함을 의미한다.
- 요오드화 적정의 지시약으로 녹말지시약을 사용할 수 있다.
- 간접요오드 적정법에서는 환원성 분석물질을 미량의 I-에 가하여 요오드를 생성시킨 다음 이것을 적정한다.
- 환원성 분석물질이 요오드로 직접 측정되었을 때, 이 방법을 직접 요오드적정법이라 한다.
36. 주석이온(Sn2+) 0.1M과 주석이온(Sn4+) 0.01M의 혼합용액에서 백금전극에 의하여 측정되는 전위(E)를 구하는 식으로 옳은 것은? (단, E°는 Sn4++2e-→Sn2+에서의 표준환원 전위이다.)
- E=E°
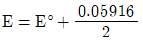
- E=E°+0.05916
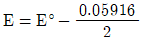
37. 다음 산화-환원 지시약에 대한 설명 중 틀린 것은?
- 산화-환원 지시약인 페로인(ferroin)의 환원형은 붉은색을 띤다.
- 에틸렌블루는 산-염기 지시약으로도 사용되며, 환원형은 푸른색을 띤다.
- 디페닐아민 술폰산의 산화형은 붉은 보라색이며, 환원형은 무색이다.
- 산화-환원 지시약인 페로인(ferroin)의 변색은 표준 수소전극에 대해 대략 1.1-1.2V범위에서 일어난다.
38. 다음 전기화학에 관한 설명으로 옳은 것은?
- 전자를 잃었을 때 산화되었다고 하며, 산화제는 전자를 잃고 자신이 산화된다.
- 전자를 얻게 되었을 때 산화되었다고 하며, 환원제는 전자를 얻고 자신이 산화된다.
- 볼트(V)의 크기는 쿨롱(C)당 주울(J)의 양이다.
- 갈바니 전지(galvenic cell)는 자발적인 화학반응으로부터 전기를 발생기키는 영구기관이다.
39. 염화나트륨 5.8g을 매스플라스크에 넣은 후 물을 넣어 녹인 후 100ml 까지 물을 채웠다. 염화나트륨의 물농도는 몇 M인가?
- 0.10M
- 1.0M
- 3.0M
- 10.0M
40. 침저과정에서 결정선장에 대한 설명 중 틀린 것은?
- 침전물의 밀자크리를 중가기키기 위하여 침전물이 생성되는 동안에 상대 과포화도를 최소화하여야 한다.
- 핵심생성(nucleation)이 지배적이라면 침전물은 매우 작은 입자로 구성된다.
- 입자성장(particle growth)이 지배적이면 침전물은 큰 밉자들로 구성한다.
- 핵김생성(nucleation) 속도는 상대 과포화도가 감소함에 따라 직선적으로 증가한다.
3과목: 기기분석I
41. 여러 파장을 동시에 측정하는 다색화장치(polychromator)로 사용할 수 없는 것은?
- 전하쌍기기(CCD)
- 전하주입기기(CID)
- 에셀레(Echelle)장치
- Slew scan spectrometer
42. 원자 분광법의 원리에 대한 설명 중 틀린 것은?
- 원자 흡수 분광법은 중성 원자가 빛에너지를 흡수하는데 기초를 둔 원자 분광법의 하나이다.
- 원자 방출 분광법은 시료에 에너지를 가하여 들뜨게 한 후 방출된 스펙트럼을 분광하여 분석하는 방법이다.
- 원자 형광 분광법은 중성 원자에 빛에너지를 가하여 들뜨게 함으로써 발생되는 형광을 분광하여 분석하는 방법이다.
- 자외선-가시선 영역의 원자 분광법은 원자 내의 최내각 전자와 전자파 간의 거동을 이용하여 분석하는 방법이다.
43. 불꽃 원자 흡수 분광법(FAAS)의 감도는 전열 원자 흡수분광법(ETAAS)에 비하여 좋지 않다. 그 이유로서 가장 적절한 것은?
- FAAS의 원자화 온도가 ETAAS보다 낮기 때문이다.
- FAAS에 의해 원자화시킬 때 ETAAS에서의 중성 원자 수보다 들뜬 원자수가 많기 때문이다.
- FAAS에서는 시료가 연소 기체에 의해 수 만배 희석되지만 ETAAS에서는 극소량의 시료라 해도 대부분 원자화되기 때문이다.
- FAAS는 불꽃으로 가열하기 때문에 신호/잡음 비가 크지만, ETAAS는 전기로 가열하여 신호/잡음 비가 작기 때문이다.
44. 염소(Cl)를 포함한 수용성유기화합물 중의 카드뮴(Cd)을 유도결합플라스마방출분광법(ICP-AES)으로 정량할 때 올바른 조작은?
- 물에 용해하므로 일정량을 용해 후 직접 정량한다.
- 유기물을 700℃에서 연소시킨 후 질산 처리하여 Cd를 정량한다.
- 질산과 황산으로 유기물을 분해시키고 황산을 제거한 후 Cd를 정량한다.
- 물에 용해시킨 후 질산을 100mL당 2mL의 비율로 가하여 산농도를 조절하고 Cd를 정량한다.
45. 원자화 방법 중 불꽃 원자화 광원과 비교한 플라스마 원자화 광원의 장점에 대한 설명으로 가장 옳은 것은?
- 원자 및 분자 밀도가 높다.
- 원자화 온도가 높아 원자화 효율이 좋다.
- 전자 밀도가 낮다.
- 시료 원자가 플라스마 관찰 영역에 도달할 때 체류시간이 짧다.
46. X-선 분광법에 대한 설명 중 틀린 것은?
- 방사성 광원은 X-선 분광법의 광원으로 사용될 수 있다.
- X-선 광원은 연속 스펙트럼과 선스펙트럼을 발생시킨다.
- X-선의 선스펙트럼은 최내각 원자 궤도함수와 관련된 전자 전이로부터 얻어진다.
- X-선의 선스펙트럼은 최외각 원자 궤도 함수와 관련된 전자 전이로부터 얻어진다.
47. X-선 형광법(XRF)은 시료 중의 금속 성분을 정성ㆍ정량 분석할 수 있다. 이에 대한 설명 중 틀린 것은?
- XRF는 수소와 불활성 기체를 제외한 모든 성분을 분석할 수 있다.
- XRF는 AAS나 lCP-AES와 같은 시료 전처리를 필요로 하지 않는다.
- XRF로 분석시 높은 정확도를 얻기 위해서는 시료의 매트릭스와 유사한 표준물질로 분석해야만 한다.
- XRF는 비파괴시험의 대표적인 예로서 시료 중의 대략적인 조성을 확인하고 screening 하는데 사용된다.
48. Zeeman 효과에 의한 바탕보정시 필요하지 않은 장치는?
- 자석
- 회전편광판
- 크세논아크등
- 속빈음극등
49. 2×10-5M KMnO4 용액을 1.5cm의 셀에 넣고 520nm에서 투광도를 측정하였더니 0.60를 보였다. 이 때 KMnO4의 물 흡광계수는 약 몇 L/cmㆍmol인가?
- 1.35×10-4
- 5.0×10-4
- 7395
- 20000
50. 다음 중 Beer 법칙의 적용 한계가 아닌 것은?
- 겉보기 이완편차
- 겉보기 화학편차
- 다색 복사선의 기기편차
- 미광복사선이 존재할 때의 기기편차
51. 다음 형광에 대한 설명 중 틀린 것은?
- 광원 깜빡이잡음이 관찰된다.
- 전자스핀이 변하지 않으면서 전자에너지 전이가 일어난다.
- 발광은 거의 순간적으로(10-5초) 없어진다.
- 붉은 원자증기에서 관찰된다.
52. 분광신호와 이를 사용하는 분석법간에 연결이 잘못된 것은?
- 복사선방출-X선 형광법
- 복사선흡수-분광광도법
- 복사선산란-핵자기공명법
- 전기전위-전위차법
53. 원자분광법에서 측정 시 다양한 방해가 발생하게 된다. 다음 방해 종류에 따른 해결방법을 연결한 것 중 틀린 것은?
- 스펙트럼 방해-Zeeman 바탕보정 혹은 다른 파장 선택
- 화학적 방해-해방제(Releasing agent) 사용
- 이온화방해-이온화 증기제 사용
- 시료조성방해-표준물 첨가법 사용
54. 다음 광학기기 및 장치 등과 관련된 용어에 대한 설명으로 옳은 것은?
- 광도계(photometer)는 한가지 또는 그 이상의 색비교 표준물을 사용하여 육안을 검출기로 사용하는 흡수측정기기이다.
- 분광기(spectroscope)는 파장이나 진동수의 함수로서 복사선의 세기에 대한 정보를 제공해주는 기기이다.
- 다중공용형(multiplex) 기기는 원하는 파장을 얻기 위하여 복사선을 거르거나 분산시키지 않고서 스펙트럼의 정보를 얻는 기기이다.
- 분광계(spectrometer)는 원자 방출선을 육안으로 확인하는 데 사용되는 기기이다.
55. 빛을 어떤 시료에 통과시켜 99%가 흡수되었다면 흡광도는 얼마인가?
- -1
- 0.99
- 1
- 2
56. 1몰(mol)의 분자가 파장이 600nm인 가시광선을 흡수했을 때 증가하는 에너지의 양은 약 몇 J/mol인가? (단, 빛의 속도는 2.998×108m/s, 플랑크상수는 6.626×10-34 Jㆍs로 한다.)
- 1.19×105
- 1.99×105
- 3.31×105
- 5.52×105
57. 원자분광법에서 선 넓힘의 원인이 아닌 것은?
- 불확정성 효과
- Doppler 효과
- 용매 효과
- 압력 효과
58. 암모니아(NH3) 분자는 적외선 스펙트럼에서 몇 가지의 기준진동 방식이 가능한가?
- 3
- 4
- 5
- 6
59. 다음 중 단색화 장치의 구성으로서 가장 거리가 먼 것은?
- 간섬쐐기
- 회절발
- 입구슬럿
- 출구슬럿
60. 적외선 분광법에 사용하기 가장 적절한 시료 용기의 재질은?
- 결정성 NaCl
- 석영
- 규산염 유리
- 용융 실리카
4과목: 기기분석II
61. 시간주사열량법을 사용하여 산소분위기에서 고분자물질을 분석하여 그림과 같은 결과를 얻었다. 실험결과를 설면한 내용 중 옳지 않은 것은?
- T1은 고분자물질의 유리전이 온도이다.
- T2는 고분자의 결정화 과정에서 나타나는 발열과정이다.
- T3은 결정화된 고분자의 녹는 과정을 나타내는 흡열과정이다.
- T4는 고분자물질이 고온에서 분해되어 다양한 생성물을 생성하는 발열과정이다.
62. 다음 이온선택성 전극의 장점에 대한 설명 중 틀린 것은?
- 직선적 감응의 넓은 범위
- 파괴성
- 짧은 감응시간
- 색깔이나 혼탁도에 영향을 비교적 받지 않음
63. 선택계수(selectivity coefficient, α)는 다음 중 무엇을 나타내는가?
- 두 분석 물질 간의 상대적인 이동 속도
- 분석 물질의 띠넓어짐의 정도
- 이동상의 이동 속도
- 분석 가능한 물질의 최대수
64. 다음 전기분석화학에 대한 설명 중 틀린 것은?
- 물질의 환원 반응은 양극에서 일어난다.
- 농도분극은 전극표면의 시료물질 농도와 용액농도의 차이에 기인하여 발생한다.
- 과접압은 전류가 흐르는 반응용기의 용액이 갖는 저항을 극복하기 위하여 필요한 전압이다.
- 작업전극에서 시료물질의 산화반응이 일어날 때, 기준 전극에서는 시료물질의 환원반응이 수반된다.
65. 전자충격 이온화 방법과 화학적 이온화 방법에 대한 설명 중 틀린 것은?
- 화학적 이온화 방법으로 더 많은 시료토막이 만들어진다.
- 전자충격 이온화 방법은 시료가 열분해하는 단점을 갖고 있다.
- 화학적 이온화 방법에서도 전자충격 이온화 과정이 있다.
- 전자충격 이온화 방법은 넓은 범위의 토악화로 시료확인 가능성을 높이는 장점이 갖고 있다.
66. 다음 중 질량분석법에서 m/z 비에 따라 질량을 분리하는 장치가 아닌 것은? (단, m은 질량, z는 전하이다.)
- 사중극자(quadrupole)
- 이중 집중(double focusing)
- 전자 증배관(electron multiplier)
- 자기장 분석관(magnetic sector analyzer)
67. 다음 보기 중 녹음(melting), 결정화(crystallization), 분해(decomposition) 등과 같은 열전이(thermal transition)의 자료를 제공하는 방법을 모두 고른 것은?
- TG, DTA, DSC
- DTA, DSC
- DSC, TG
- DSC
68. n-hexane, n-hexanol, benzene이 역상 HPLG에서 분리될 경우 용리 순서를 빨리 나오는 것부터 옳게 예측된 것은?
- n-hexane>n-hexanol>benzene
- n-hexanol>n-hexane>benzene
- benzene>n-hexanol>n-hexane
- n-hexanol>benzene>n-hexane
69. "화학 7(Chem 7)" 시험은 임상병리실에서 수행되는 시험의 70% 정도를 차지한다. 이들 중에서 이온선택전극을 사용하여 측정할 수 없는 화학종은?
- 글루코스
- 염소 이온
- 칼륨 이온
- 총 이산화탄소
70. 다음 설명에 해당하는 질량분석법의 이온화 방법은?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- CI(chemical ionization)
- EI(electeron impact ionization)
- FI(field ionization)
- MALDI(matrix-assisted laser desorption/ionization)
71. 질량분석기를 검정하는데 주로 사용되는 표준물질은?
- FAPP
- MTBSTFA
- PFTBA
- TBSI
72. 질량분석계를 이용하여 질량이 50.00과 50.01인 1가 이온을 분리하려면 최소한의 분해능(resolution)은 얼마인가?
- 2000
- 3000
- 4000
- 5000
73. 유리전극을 사용하여 용액의 pH를 측정할 때 오차에 영향을 미치지 않는 것은?
- 접촉전위
- 나트륨 오차
- 표준 완충요액
- 선택계수의 실험적 보정
74. 미지시료 산의 전기량법 적정(coulometric titration)에 그림에 있는 장치가 사용된다. 이 실험과 관련된 다음 설명 중 옳지 않은 것은?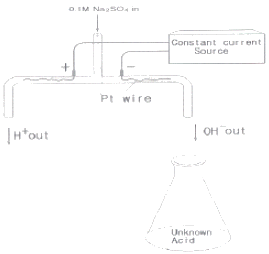
- 음극에서 수소 기체가 발생한다.
- 적정반응은 "H++OH-⇄H2O“이다.
- 황산나트륨은 산화환원반응에 참여한다.
- 종말점을 찾기 위해 pH 전극이나 지시약을 사용할 수 있다.
75. 그림은 어떤 시료의 얇은층크로마토그램이다. 이 시료의 지연인자(retaedation factor) Rf값은?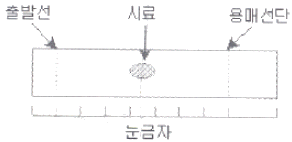
- 0.10
- 0.20
- 0.30
- 0.50
76. 액간접촉전위(liquid junction potential)에 대한 설명 중 틀린 것은?
- 양이온과 음이온의 확산속도가 다르기 때문에 발생한다.
- 조성이 다른 전해질 용액에 접촉할 때, 경계면에서 발생한다.
- 전극에 전기 이중층(electric double layer)이 생기는 이유이다.
- 두 용액 사이에 진한 전해질 용액을 포함한 염다리(salt bridge)를 사용하여 줄일 수 있다.
77. 0.001M HCI을 0.1M NaOH를 사용하여 적정할 때 용액의 비전도도 변화를 가장 잘 나타낸 모식도는?
78. 다음 중 열법무게측정(TG)에 대한 설명 중 틀린 것은?
- 시료의 무게를 시간 또는 온도의 함수로 연속적으로 기록한다.
- 시간의 함수로 무게 또는 무게 백분율을 도시한 것을 열분석도라 한다.
- 열무게 측정에 사용되는 대부분의 전기로의 온도 범위는 1000~1200℃ 정도이다.
- 비활성 환경기류를 만들기 위한 기체 주입장치가 필요하다.
79. 연산 증폭기(poerational amplifier) 회로를 사용하여 작업전극에 흐르는 전류(current)신호를 전압(voltage)신호로 변환시켜서 측정하고자 한다. 가장 적절한 회로는?
80. 할로겐화합물, 과산화물, 퀴논 및 니트로기와 같은 전기음성도가 큰 작용기를 포함하는 분자에 특히 예민하게 반응하는 가스크로마토그래피 검출기는?
- ECD
- FID
- AED
- TCD






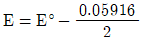 "가 정답이다.
"가 정답이다.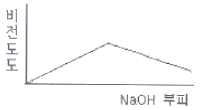
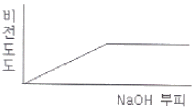

 "이다.
"이다.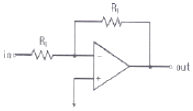
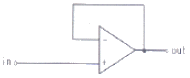
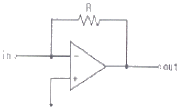
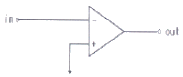
 "이다. 이유는 연산 증폭기 회로는 입력 전압의 차이를 증폭시켜 출력 전압으로 변환해주는 역할을 하기 때문이다. 작업전극에 흐르는 전류 신호를 전압 신호로 변환시키기 위해서는 작업전극과 접지 사이에 저항을 연결하여 전류 신호를 전압 신호로 변환시켜야 한다. 이때, "
"이다. 이유는 연산 증폭기 회로는 입력 전압의 차이를 증폭시켜 출력 전압으로 변환해주는 역할을 하기 때문이다. 작업전극에 흐르는 전류 신호를 전압 신호로 변환시키기 위해서는 작업전극과 접지 사이에 저항을 연결하여 전류 신호를 전압 신호로 변환시켜야 한다. 이때, "