1과목: 일반화학
1. 다음 물질 중 승화와 관계가 없는 것은?
- 드라이아이스
- 나프탈렌
- 알코올
- 요오드
- 승화란 고체나 액체가 기체로 변하는 것을 말합니다. 따라서 알코올은 액체 상태에서 승화가 가능합니다. 하지만 드라이아이스는 고체 이산화탄소로 승화가 가능하며, 나프탈렌은 고체 상태에서 승화가 가능하며, 요오드는 고체 상태에서 승화가 가능합니다. 따라서 알코올은 승화와 관계가 없는 물질입니다.
2. 다음 물질 중 물에 가장 잘 녹는 기체는?
- NO
- C2H2
- NH3
- CH4
- NH3은 수소결합을 이루는 분자로, 물 분자와 수소결합을 형성할 수 있습니다. 이러한 수소결합은 물 분자와 NH3 분자 간의 인력을 강화시키며, 물 분자와 NH3 분자 간의 상호작용을 증가시킵니다. 따라서 NH3은 물에 가장 잘 녹는 기체 중 하나입니다.
3. 다음 중 주기율표상 V족 원소에 해당되지 않는 것은?
- P
- As
- Si
- Bi
- 정답은 "Si"입니다.
V족 원소는 5개의 전자껍질을 가지고 있으며, 5개의 전자를 가진 d껍질과 1개의 전자를 가진 s껍질을 가지고 있습니다. 따라서 V족 원소는 5개의 전자를 가진 원소들로 이루어져 있습니다.
하지만 Si는 3개의 전자를 가진 원소로서 V족 원소에 해당되지 않습니다. Si는 2개의 전자를 가진 p껍질과 1개의 전자를 가진 s껍질을 가지고 있습니다. 따라서 Si는 3개의 전자를 가진 원소로서 V족 원소에 해당되지 않습니다.
4. 금속결합의 특징에 대한 설명으로 틀린 것은?
- 양이온과 자유전자 사이의 결합이다.
- 열과 전기의 부도체이다.
- 연성과 전성이 크다.
- 광택을 가진다.
- 정답은 "열과 전기의 부도체이다."입니다.
금속결합은 양이온과 자유전자 사이의 결합으로 이루어지며, 이는 열과 전기를 잘 전도하는 특징을 가지고 있습니다. 또한 연성과 전성이 크며 광택을 가지는 것도 특징 중 하나입니다. 따라서 "열과 전기의 부도체이다."는 틀린 설명입니다.
5. 0℃, 2atm에서 산소분자수가 2.15×1021 개다. 이 때 부피는 약 몇 mL 가 되겠는가?
- 40 mL
- 80 mL
- 100 mL
- 120 mL
- 이 문제에서 이용되는 이상기체법칙은 PV=nRT이다. 여기서 P는 압력, V는 부피, n은 몰수, R은 기체상수, T는 절대온도를 나타낸다.
먼저, 이 문제에서는 온도가 주어지지 않았으므로, 상수인 R과 온도 T를 이용하여 PV/n 값이 같다는 것을 이용할 것이다.
따라서, 0℃, 2atm에서의 PV/n 값은 다음과 같다.
PV/n = (2 atm) x V / (2 분자/몰 x 8.31 J/K/mol x 273 K)
= 0.000097 V
여기서 n은 산소분자수인 2.15×10^21 분자이다.
따라서, V는 다음과 같이 구할 수 있다.
V = n x (RT/P) = (2.15×10^21 분자) x (8.31 J/K/mol x 273 K / 2 atm) / 1000 mL
= 39.9 mL
따라서, 정답은 "40 mL"이 된다.
6. 0.001M의 HCl 용액의 pH는 얼마인가?
- 2
- 3
- 4
- 5
- 0.001M의 HCl 용액은 강산성 용액이며, pH는 -log[H+]로 계산됩니다. HCl은 완전이온화되므로 [H+]는 0.001M입니다. 따라서 pH는 -log(0.001) = 3입니다. 따라서 정답은 "3"입니다.
7. 원자번호 7번인 질소(N)은 2p 궤도에 몇 개의 전자를 갖는가?
- 3
- 5
- 7
- 14
- 질소(N)의 전자 구성은 1s² 2s² 2p³ 이다. 따라서 2p 궤도에는 3개의 전자가 존재한다. 이는 2p 궤도가 최대 6개의 전자를 수용할 수 있기 때문이다.
8. HClO4에서 할로겐원소가 갖는 산화수는?
- +1
- +3
- +5
- +7
- HClO4은 염소원소가 함유된 화합물로, 염소의 산화수를 구해보면 H(+1), Cl(x), O(-2)로 이루어진 분자이므로 다음과 같은 식을 세울 수 있습니다.
(+1) + x + 4(-2) = 0
이를 정리하면,
x = +7
따라서, HClO4에서 할로겐원소인 염소의 산화수는 "+7"입니다.
9. 황산(H2SO4) 용액 100 mL에 황산이 4.9g 용해되어 있다. 이 황산용액의 노르말 농도는?
- 0.5N
- 1N
- 4.9N
- 9.8N
- 본 해설은 비추 누적갯수 초과로 자동 블라인드 되었습니다.(AI해설 오류가 많아 비추 2개 이상시 자동 블라인드 됩니다.)해설을 보시기 원하시면 클릭해 주세요노르말 농도(Normality)는 몰 농도(Molarity)와 반응 계수(reaction factor)를 곱한 값입니다. 황산(H2SO4)의 반응 계수는 2이므로, 몰 농도는 다음과 같이 계산할 수 있습니다.
몰 농도 = 질량 ÷ 분자량 ÷ 부피 = 4.9 ÷ (98 + 32 + 64) ÷ 0.1 = 4.9 ÷ 194 ÷ 0.1 ≈ 0.252 M
노르말 농도는 몰 농도에 반응 계수를 곱한 값이므로, 다음과 같이 계산할 수 있습니다.
노르말 농도 = 몰 농도 × 반응 계수 = 0.252 × 2 = 0.504 N
따라서, 이 황산용액의 노르말 농도는 "0.5N"이 됩니다.
10. 다음 중 포화탄화수소 화합물은?
- 요오드 값이 큰 것
- 건성유
- 시클로헥산
- 생선기름
- 포화탄화수소 화합물은 탄소와 수소 원자로만 이루어져 있으며, 결합이 완전히 채워져 있어 더 이상 수소를 추가할 수 없는 화합물을 말합니다. 이 중에서 시클로헥산은 6개의 탄소 원자가 고리 모양으로 결합되어 있으며, 모든 결합이 포화되어 있어 포화탄화수소 화합물입니다. 따라서 시클로헥산이 포화탄화수소 화합물에 해당됩니다.
11. 다음 중 식물 세포벽의 기본구조 성분은?
- 셀룰로오스
- 나프탈렌
- 아닐린
- 에틸에티르
- 식물 세포벽의 기본구조 성분은 셀룰로오스입니다. 이는 식물 세포벽을 구성하는 주요 성분으로, 단당류인 글루코스 분자가 β-1,4-결합으로 이어져서 형성됩니다. 이러한 셀룰로오스는 강한 기계적 강도와 내구성을 제공하며, 식물의 성장과 발달에 중요한 역할을 합니다.
12. 펜탄의 구조이성질체는 몇 개 인가?
- 2
- 3
- 4
- 5
- 펜탄은 분자식이 C5H12인 구조이성질체의 집합체입니다. 이 때, C5H12 분자식을 가지는 구조이성질체는 다음과 같이 3개가 있습니다.
1. n-펜탄 (연쇄 구조이성질체)
2. 2-메틸부탄 (교체 구조이성질체)
3. 2,2-디메틸프로판 (분기 구조이성질체)
따라서, 펜탄의 구조이성질체는 3개입니다.
13. 열의 일당량의 값으로 옳은 것은?
- 427 kgf·m/kcal
- 539 kgf·m/kcal
- 632 kgf·m/kcal
- 778 kgf·m/kcal
- 열의 일당량은 단위 열량당 일을 일으키는 데 필요한 일의 양을 말합니다. 따라서 열의 일당량 값이 클수록 더 많은 일을 할 수 있습니다.
열의 일당량은 다음과 같이 계산됩니다.
열의 일당량 = 일을 일으키는 데 필요한 에너지 / 공급된 열량
여기서 일을 일으키는 데 필요한 에너지는 kgf·m(킬로그램-힘 미터)이며, 공급된 열량은 kcal(칼로리)입니다.
따라서, 열의 일당량 값은 kgf·m/kcal로 표시됩니다.
427 kgf·m/kcal이 정답인 이유는, 이 값이 일을 일으키는 데 필요한 에너지를 공급된 열량으로 나눈 값으로, 열의 일당량을 나타내기 때문입니다. 다른 보기들은 이 값과 다른 값으로 계산되었기 때문에 정답이 아닙니다.
14. 다음 중 명명법이 잘못된 것은?
- NaClO3 : 아염소산나트륨
- Na2SO3 : 아황산나트륨
- (NH4)2SO4 : 황산암모늄
- SiCl4 : 사염화규소
- "NaClO3 : 아염소산나트륨"이 잘못된 명명법입니다. NaClO3은 염소산나트륨이 맞는데, "아염소산"은 존재하지 않는 화합물이기 때문입니다.
15. 다음 중 요오드포름 반응도 일어나고 은거울 반응도 일어나는 물질은?
- CH3CHO
- CH3CH2OH
- HCHO
- CH3COCH3
- 요오드포름 반응은 알데하이드나 케톤에 대해 일어나는 반응으로, 이 반응에서 알데하이드나 케톤은 요오드와 포름알데하이드의 혼합물과 반응하여 황갈색의 카르보닐 화합물을 생성합니다.
은거울 반응은 알데하이드나 케톤에 대해 일어나는 반응으로, 이 반응에서 알데하이드나 케톤은 은이온과 반응하여 은거울을 생성합니다.
따라서, CH3CHO는 알데하이드이며, 요오드포름 반응과 은거울 반응 모두에서 양성반응을 보이므로 정답입니다.
16. 에탄올에 진한 황산을 촉매로 사용하여 160~170℃의 온도를 가해 반응시켰을 때 만들어지는 물질은?
- 에틸렌
- 메탄
- 황산
- 아세트산
- 에탄올과 황산이 반응하여 에틸렌과 물이 생성됩니다. 이는 에탄올의 탈수반응으로, 황산이 촉매 역할을 하여 반응이 촉진됩니다. 따라서 정답은 "에틸렌"입니다.
17. 원자의 K 껍질에 들어있는 오비탈은?
- s
- p
- d
- f
18. 다음 착이온 Fe(CN)64- 의 중심 금속이온의 전하수는?
- +2
- -2
- +3
- -3
- Fe(CN)64- 의 전하는 -4 이므로, 이 전하를 중심 금속이온 Fe가 모두 중화시켜야 합니다. 이때, 시안 이온(CN-) 의 전하는 -1 이므로, 6개의 시안 이온이 존재하면 -6 의 전하를 가집니다. 따라서, 중심 금속이온 Fe는 +2 의 전하를 가지게 됩니다.
19. 결정의 구성단위가 양이온과 전자로 이루어진 결정형태는?
- 금속결정
- 이온결정
- 분자결정
- 공유결합결정
- 금속결정은 양이온과 전자로 이루어져 있습니다. 금속 원자는 전자를 자유롭게 이동시킬 수 있는 전자 해방성을 가지고 있으며, 이로 인해 금속 결정은 전자 기체와 유사한 특성을 가지게 됩니다. 따라서 금속결정은 양이온과 전자로 이루어진 결정형태입니다.
20. 비활성기체에 대한 설명으로 틀린 것은?
- 다른 원소와 화합하지 않고 전자배열이 안정하다.
- 가볍고 불연소성이므로 기구, 비행기 타이어 등에 사용된다.
- 방전할 때 특유한 색상을 나타내므로 야간광고용으로 사용된다.
- 특유의 색깔, 맛, 냄새가 있다.
- 비활성기체는 다른 원소와 화합하지 않고 전자배열이 안정한 원소들을 말한다. 따라서 비활성기체는 화학적으로 매우 안정하며, 화학반응에 참여하지 않는다. 이에 따라 특유의 색깔, 맛, 냄새가 없다. 따라서 "특유의 색깔, 맛, 냄새가 있다."는 설명이 틀린 것이다.
2과목: 분석화학
21. 다음 중 비전해질은 어느 것인가?
- NaOH
- HNO3
- CH3COOH
- C2H5OH
- 비전해질은 양극에서 일어나는 화학 반응으로, 양극에서 전자를 받아 양이온으로 전해지는 화합물입니다. 따라서 이 중에서 양극에서 전자를 받아 양이온으로 전해지는 화합물인 C2H5OH가 비전해질이 됩니다. 다른 화합물들은 양극에서 전자를 받지 않거나, 전해질이 되지 않는 경우가 있습니다.
22. 다이아몬드, 흑연은 같은 원소로 되어 있다. 이러한 단체를 무엇이라 하는가?
- 동소체
- 전이체
- 혼합물
- 동위화합물
- 다이아몬드와 흑연은 같은 원소인 탄소로 이루어져 있지만, 그 구조와 물리적 성질이 다릅니다. 이처럼 원소의 원자들이 서로 다른 구조를 가지면서도 같은 원소로 존재하는 것을 동소체라고 합니다. 따라서 정답은 "동소체"입니다.
23. 이소프렌, 부타디엔, 클로로프렌은 다음 중 무엇을 제조할 때 사용되는가?
- 합성섬유
- 합성고무
- 합성수지
- 세라믹
- 이소프렌, 부타디엔, 클로로프렌은 모두 고무의 원료로 사용됩니다. 이들을 중합하여 합성고무를 만들 수 있습니다. 따라서 이소프렌, 부타디엔, 클로로프렌은 합성고무를 제조할 때 사용됩니다.
24. 이산화탄소가 쌍극자모멘트를 가지지 않는 주된 이유는?
- C=O 결합이 무극성이기 때문
- C=O 결합이 공유 결합이기 때문
- 분자가 선형이고 대칭이기 때문
- C와 O의 전기음성도가 비슷하기 때문
- 이산화탄소 분자는 선형이고 대칭인 구조를 가지고 있습니다. 이러한 구조는 분자의 중심에서 전자밀도가 균일하게 분포되어 있어서 쌍극자모멘트를 가지지 않게 됩니다. 따라서 이산화탄소는 무극성 분자이며, 이러한 이유로 인해 다른 분자와 상호작용하는 데 있어서 특별한 특성을 가지게 됩니다.
25. 용액의 끓는점 오름은 어느 농도에 비례하는가?
- 백분율 농도
- 몰 농도
- 몰랄 농도
- 노르말 농도
- 용액의 끓는점 오름은 용질의 분자 수에 비례합니다. 따라서 용액 내 용질의 분자 수가 많을수록 끓는점이 높아지게 됩니다. 이 때, 용액 내 용질의 분자 수는 몰 농도와 관련이 있습니다. 몰 농도는 용액 내 용질의 몰 수를 용액의 부피로 나눈 값으로, 용액 내 용질의 분자 수를 나타내는 지표입니다. 따라서 용액의 끓는점 오름은 몰 농도에 비례하게 됩니다. 따라서 정답은 "몰랄 농도"입니다.
26. KMnO4 는 어디에 보관하는 것이 가장 적당한가?
- 에보나이트병
- 폴리에틸렌병
- 갈색 유리병
- 투명 유리병
- KMnO4은 빛에 노출되면 분해되어 색이 바래고 효능이 감소하므로, 보관 시 빛을 차단할 수 있는 갈색 유리병이 가장 적당합니다.
27. 화학반응에서 촉매의 작용에 대한 설명으로 틀린 것은?
- 평형이동에는 무관하다.
- 물리적 변화를 일으킬 수 있다.
- 어떠한 물질이라도 반응이 일어나게 한다.
- 반응 속도에는 소량을 가하더라도 영향이 미친다.
- "어떠한 물질이라도 반응이 일어나게 한다."는 틀린 설명입니다. 촉매는 반응속도를 증가시키는 역할을 하지만, 모든 반응에 대해 촉매가 작용하는 것은 아닙니다. 촉매는 특정한 반응에서만 작용하며, 그 반응에 대한 활성화 에너지를 낮춰주어 반응이 일어나기 쉽게 만들어줍니다. 따라서 "어떠한 물질이라도 반응이 일어나게 한다."는 틀린 설명입니다.
28. Hg2Cl2는 물 1L에 3.8×10-4g 이 녹는다. Hg2Cl2의 용해도곱은 얼마인가? (단, Hg2Cl2의 분자량은 472 이다.)
- 8.05 × 10-7
- 80.5 × 10-8
- 6.48 × 10-13
- 5.21 × 10-19
- 용해도곱은 용질이 포화상태일 때 용액 중에 있는 용질의 몰농도를 의미한다. 따라서, Hg2Cl2의 용해도곱은 다음과 같이 구할 수 있다.
1. Hg2Cl2의 녹는 양을 구한다.
녹는 양 = 1L × 3.8×10-4g/L = 3.8×10-4g
2. Hg2Cl2의 몰질량을 구한다.
몰질량 = 분자량 × 몰의 개수 = 472g/mol × 1/2 mol = 236g/mol
3. 용해도를 구한다.
용해도 = 녹는 양 ÷ 몰질량 = 3.8×10-4g ÷ 236g/mol = 1.61×10-6mol/L
4. 용해도곱을 구한다.
용해도곱 = [Hg2Cl2] × [Cl-]2 = (1.61×10-6mol/L) × (2×1.61×10-6mol/L)2 = 5.21 × 10-19
따라서, 정답은 "5.21 × 10-19" 이다.
29. 다음 염소산 화합물의 세기순서가 옳게 나열된 것은?
- HOCl > HClO2 > HClO3 > HClO4
- HClO4 > HOCl > HClO3 > HClO2
- HClO4 > HClO3 > HClO2 > HOCl
- HOCl > HClO3 > HClO2 > HClO4
- 정답은 "HClO4 > HClO3 > HClO2 > HOCl"입니다.
이유는 염소산 화합물의 세기는 산의 산성도와 관련이 있습니다. 산성도는 산의 수소 이온(H+)을 얼마나 쉽게 방출하는지에 따라 결정됩니다. 이에 따라 산의 세기는 수소 이온의 결합력과 산의 안정성에 영향을 받습니다.
따라서, 염소산 화합물의 세기는 산의 산성도와 관련이 있으며, 산성도는 수소 이온의 결합력과 산의 안정성에 영향을 받습니다. 이를 고려하면, HClO4이 가장 강한 산이며, HOCl이 가장 약한 산입니다. 따라서, 세기순서는 "HClO4 > HClO3 > HClO2 > HOCl"이 됩니다.
30. 양이온계통 분석에서 가장 먼저 검출되어야 하는 이온은?
- Ag+
- Cu2+
- Mg2+
- NH4+
- 양이온계통 분석에서는 우선 Ag+ 이온을 검출해야 합니다. 이는 Ag+ 이온이 다른 이온들과 구분하기 쉽기 때문입니다. Ag+ 이온은 크기가 작고 전하가 크기 때문에 다른 이온들과 구분하기 쉽습니다. 또한 Ag+ 이온은 Cl- 이온과 결합하여 AgCl 침전물을 생성하기 때문에 이를 이용하여 검출할 수 있습니다.
31. 다음 반응에서 침전물의 색깔은?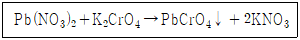
- 검은색
- 빨간색
- 흰색
- 노란색
- 침전물의 색깔은 노란색입니다. 이유는 보기 중에서 노란색을 제외한 검은색, 빨간색, 흰색은 모두 침전물의 색깔이 될 수 없는 색상이기 때문입니다. 검은색은 침전물이 없는 경우, 빨간색은 산성 용액에서 생기는 색깔이며, 흰색은 물에 녹아있는 물질이 침전되어 생기는 색깔입니다. 따라서, 침전물의 색깔은 노란색이 됩니다.
32. 황산(H2SO4 = 98) 1.5노르말 용액 3L을 1노르말용액으로 만들고자 한다. 물은 몇 L 가 필요한가?
- 1.5 L
- 2.5 L
- 3.5 L
- 4.5 L
- 황산의 몰농도는 1.5N 이므로, 1L의 용액에 황산 1.5mol이 포함되어 있다는 뜻입니다. 따라서, 3L의 용액에는 황산 4.5mol이 포함되어 있습니다.
1노르말 용액은 1L의 용액에 화학물질 1몰이 포함되어 있으므로, 4.5mol의 황산을 포함하는 용액을 만들기 위해서는 4.5L의 용액이 필요합니다.
따라서, 3L의 황산 용액에 1.5L의 물을 더해서 4.5L의 용액을 만들면 1노르말 용액이 됩니다. 따라서 정답은 "1.5 L" 입니다.
33. 페놀류의 정색반응에 사용되는 약품은?
- CS2
- KI
- FeCl3
- (NH4)2Ce(NO3)6
- 페놀류의 정색반응은 페놀류와 FeCl3가 반응하여 형성되는 적갈색의 착물을 이용하는 반응입니다. 따라서 FeCl3이 페놀류의 정색반응에 사용되는 약품으로 선택됩니다.
34. 미지 농도의 염산용액 100mL를 중화하는데 0.2N NaOH 용액 250mL가 소모되었다. 염산 용액의 농도는?
- 0.05N
- 0.1N
- 0.2N
- 0.5N
- NaOH 용액의 농도는 0.2N 이므로 1L의 NaOH 용액에 NaOH가 0.2mol 존재한다는 것을 의미합니다. 따라서 250mL의 NaOH 용액에는 NaOH가 0.05mol 존재합니다.
중화 반응에서는 산과 염기의 몰수가 같아지게 됩니다. 따라서 NaOH 용액에 존재하는 NaOH의 몰수와 염산 용액에 존재하는 HCl의 몰수는 같아지게 됩니다.
따라서, NaOH 용액에 존재하는 NaOH의 몰수는 0.05mol 이므로, 염산 용액에 존재하는 HCl의 몰수도 0.05mol 입니다.
염산 용액의 부피는 100mL 이므로, 농도는 0.05mol / 0.1L = 0.5N 입니다.
따라서, 정답은 "0.5N" 입니다.
35. 다음 중 제3족 양이온으로 분류하는 이온은?
- Al3+
- Mg2+
- Ca2+
- As3+
- 알루미늄(Al)의 전자 구성은 1s22s22p63s23p1이며, 3개의 전자를 잃어버리면 양이온으로서의 전하를 가지게 됩니다. 따라서 Al3+은 제3족 양이온으로 분류됩니다. Mg2+, Ca2+, As3+은 각각 2개, 2개, 3개의 전자를 잃어버리므로 제2족, 제2족, 제5족 양이온으로 분류됩니다.
36. 기체의 용해도에 대한 설명으로 옳은 것은?
- 질소는 물에 잘 녹는다.
- 무극성인 기체는 물에 잘 녹는다.
- 기체는 온도가 올라가면 물에 녹기 쉽다.
- 기체의 용해도는 압력에 비례한다.
- 기체의 용해도는 압력에 비례한다는 것은 기체 분자들이 용액 분자들과 상호작용하여 용해되는 과정에서 기체 분자들의 수가 증가하면 용해도도 증가한다는 것을 의미합니다. 이는 기체 분자들이 용액 분자들과 충돌할 확률이 높아지기 때문입니다. 따라서 압력이 증가하면 기체의 용해도도 증가하게 됩니다.
37. 메탄올(CH3OH, 밀도 0.8 g/mL) 25mL를 클로로포름에 녹여 500mL를 만들었다. 용액 중의 메탄올의 몰농도(M)는 얼마인가?
- 0.16
- 1.6
- 0.13
- 1.25
- 메탄올의 몰질량은 32 g/mol이다. 따라서 25 mL의 메탄올은 0.8 g/mL x 25 mL = 20 g이다. 이를 몰질량으로 환산하면 20 g / 32 g/mol = 0.625 mol이다.
클로로포름 용액의 총 부피는 500 mL 이므로, 이 용액 속에는 0.625 mol의 메탄올이 들어있다. 따라서 몰농도(M)는 0.625 mol / 0.5 L = 1.25 M이다.
따라서 정답은 "1.25"이다.
38. 다음 반응식에서 브뢴스테드-로우리가 정의한 산으로만 짝지어진 것은?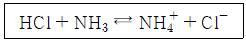
- HCl, NH4+
- HCl, Cl-
- NH3, NH4+
- NH3, Cl-
- 산은 양이온을 만들어내는 화학물질이고, 염은 양이온과 음이온이 결합한 화학물질입니다. 따라서, HCl은 양이온 H+와 음이온 Cl-로 이루어진 염이며, NH4+은 양이온 NH4+와 음이온 없이 단독으로 존재하는 화학물질입니다. 따라서, "HCl, NH4+"이 정답입니다.
39. 제4족 양이온 분족시 최종 확인 시약으로 디메틸글리옥심을 사용하는 것은?
- 아연
- 철
- 니켈
- 코발트
- 디메틸글리옥심은 니켈과 반응하여 붉은색 착물을 생성하기 때문입니다. 따라서, 디메틸글리옥심을 사용하여 제4족 양이온 분족시 최종 확인 시약으로 니켈을 확인할 수 있습니다.
40. 침전적정법 중에서 모르(Mohr)법에 사용하는 지시약은?
- 질산은
- 플루오르세인
- NH4SCN
- K2CrO4
- 모르법은 침전적정법 중 하나로, 불용성 침전물질을 이용하여 측정하는 방법입니다. 이때 사용하는 지시약은 침전물질과 반응하여 침전물질의 색이 변화하도록 하는 역할을 합니다.
따라서, 보기 중에서 침전물질과 반응하여 색이 변화하는 지시약은 "플루오르세인"과 "K2CrO4"입니다. 그러나, 플루오르세인은 독성이 있어 사용이 제한되고 있습니다. 따라서, 현재는 대부분의 모르법에서 K2CrO4가 사용되고 있습니다.
3과목: 기기분석
41. 유리 기구의 취급 방법에 대한 설명으로 틀린 것은?
- 유리 기구를 세척할 때에는 중크롬산칼륨과 황산의 혼합용액을 사용한다.
- 유리 기구와 철제, 스테인리스강 등 금속으로 만들어진 실험 실습 기구는 같이 보관한다.
- 메스플라스크, 뷰렛, 메스실린더, 피펫 등 눈금이 표시된 유리 기구는 가열하지 않는다.
- 깨끗이 세척된 유리 기구는 유리 기구의 벽에 물방울이 없으며, 깨끗이 세척되지 않은 유리 기구의 벽은 물방울이 남아 있다.
- 정답은 "유리 기구와 철제, 스테인리스강 등 금속으로 만들어진 실험 실습 기구는 같이 보관한다."입니다. 이는 틀린 설명입니다. 유리 기구와 금속 기구는 서로 다른 소재이기 때문에 보관 시에는 따로 보관해야 합니다. 유리 기구는 금속 기구와 달리 부드러운 소재이기 때문에 금속 기구와 함께 보관하면 서로 부딪히거나 긁히는 등의 손상이 발생할 수 있습니다. 따라서 유리 기구와 금속 기구는 따로 보관하는 것이 좋습니다.
42. 비색계의 원리와 관계가 없는 것은?
- 두 용액의 물질의 조성이 같고 용액의 깊이가 같을 때 두 용액의 색깔의 짙기는 같다.
- 용액 층의 깊이가 같을 때 색깔의 짙기는 용액의 농도에 반비례한다.
- 농도가 같은 용액에서는 그 색깔의 짙기는 용액 층의 깊이에 비례한다.
- 두 용액의 색깔이 같고 색깔의 짙기가 같을 때라도 같은 물질이 아닐 수 있다.
- 정답은 "두 용액의 물질의 조성이 같고 용액의 깊이가 같을 때 두 용액의 색깔의 짙기는 같다."입니다.
비색계는 빛의 흡수와 반사를 이용하여 물질의 농도나 농도 변화를 측정하는데 사용됩니다. 빛은 물질에 흡수되거나 반사됩니다. 물질의 농도가 높을수록 빛이 많이 흡수되므로 색깔이 짙어집니다. 따라서 용액의 농도가 높을수록 색깔이 짙어지고, 용액 층의 깊이가 같을 때는 농도에 반비례합니다. 이는 물질의 특성과는 관계가 없는 원리입니다.
43. pH4인 용액 농도는 pH6인 용액 농도의 몇 배인가?
- 1/2
- 1/200
- 2배
- 100배
- pH는 수소 이온 농도를 나타내는 지표이므로, pH가 2단계 차이나면 수소 이온 농도는 10의 2승, 즉 100배 차이가 납니다. 따라서 pH4인 용액은 pH6인 용액보다 100배 더 산성입니다.
44. 가스크로마토그래피(GC)에서 운반가스로 주로 사용되는 것은?
- O2, H2
- O2, N2
- He, Ar
- CO2, CO
- 가스크로마토그래피에서는 샘플을 분리하기 위해 캐리어 가스를 사용합니다. 이때 캐리어 가스는 분리된 샘플을 운반하면서 컬럼 내에서의 이동을 도와줍니다. He와 Ar은 비활성 기체로서, 반응성이 낮아서 컬럼 내에서의 반응을 방지하고, 또한 분자량이 작아서 샘플을 빠르게 운반할 수 있어서 가장 많이 사용됩니다. 따라서 정답은 "He, Ar"입니다.
45. 전위차법에서 사용되는 기준전극의 구비조건이 아닌 것은?
- 반전지 전위값이 알려져 있어야 한다.
- 비가역적이고 편극전극으로 작동하여야 한다.
- 일정한 전위를 유지하여야 한다.
- 온도변화에 히스테리시스 현상이 없어야 한다.
- 전위차법에서는 기준전극과 측정전극 사이의 전위차를 측정하여 분석합니다. 이 때 기준전극은 비가역적이고 편극전극으로 작동해야 합니다. 비가역적인 이유는 기준전극의 전위가 변화하지 않기 때문에 측정결과에 영향을 미치지 않기 때문입니다. 또한 편극전극으로 작동해야 하는 이유는 기준전극과 측정전극 사이의 전위차가 일정하게 유지되어야 하기 때문입니다. 따라서 비가역적이고 편극전극으로 작동하는 기준전극이 필요합니다.
46. 다음 ( )에 들어갈 용어는?
- 밀도
- 부피
- 압력
- 온도
- 이미지에서는 동일한 부피 내에 물질이 더 많이 존재하는 것을 보여주고 있습니다. 이를 통해 밀도는 단위 부피당 물질의 양을 나타내는 것으로 정의됩니다. 따라서 정답은 "밀도"입니다.
47. 원자를 증기화하여 생긴 기저상태의 원자가 그 원자층을 투과하는 특유파장의 빛을 흡수하는 성질을 이용한 것으로 극소량의 금속성분의 분석에 많이 사용되는 분석법은?
- 가시·자외선 흡수분광법
- 원자 흡수분광법
- 적외선 흡수분광법
- 기체크로마토그래피법
- 원자 흡수분광법은 원자를 증기화하여 생긴 기저상태의 원자가 그 원자층을 투과하는 특유파장의 빛을 흡수하는 성질을 이용하여 분석하는 방법입니다. 이 방법은 극소량의 금속성분을 빠르고 정확하게 분석할 수 있어서 많이 사용됩니다. 따라서 정답은 "원자 흡수분광법"입니다.
48. 적외선 흡수분광법에서 액체시료는 어떤 시료판에 떨어뜨리던지 발라서 측정하는가?
- K2CrO4
- KBr
- CrO3
- KMnO4
- 적외선 흡수분광법에서는 액체시료를 KBr 시료판에 혼합하여 압축하여 만든 투과판을 사용하여 측정합니다. 이는 KBr이 적외선 영역에서 투과율이 높기 때문입니다. 따라서 KBr 시료판을 사용하면 측정 결과에 영향을 미치지 않고 정확한 분석이 가능합니다.
49. 적외선흡수 스펙트럼에서 1700cm-1 부근에서 강한 신축진동(stretching vibration) 피크를 나타내는 물질은?
- 아세틸렌
- 아세톤
- 메탄
- 에탄올
- 1700cm-1 부근에서 강한 신축진동 피크를 나타내는 것은 카르복실 기능기(-C=O)입니다. 아세톤은 카르복실 기능기를 가지고 있으며, 따라서 적외선 스펙트럼에서 1700cm-1 부근에서 강한 신축진동 피크를 나타냅니다. 따라서 정답은 "아세톤"입니다.
50. 이상적인 pH 전극에서 pH가 1 단위 변할 때, pH 전극의 전압은 약 얼마나 변하는가?
- 96.5 mV
- 59.2 mV
- 96.5 V
- 59.2 V
- pH 전극은 수소 이온 농도(pH)에 따라 전압이 변화하는 전극이다. pH가 1 단위 변할 때, 수소 이온 농도는 10배 변화하므로, pH 전극의 전압도 59.2 mV(= 0.0592 V)만큼 변화한다. 이는 Nernst 방정식에 의해 계산된 값이다.
51. 고성능 액체크로마토그래피는 고정상의 종류에 의해 4가지로 분류된다. 다음 중 해당되지 않는 것은?
- 분배
- 흡수
- 흡착
- 이온교환
- 본 해설은 비추 누적갯수 초과로 자동 블라인드 되었습니다.(AI해설 오류가 많아 비추 2개 이상시 자동 블라인드 됩니다.)해설을 보시기 원하시면 클릭해 주세요정답: "이온교환"
고성능 액체크로마토그래피에서 고정상은 분배, 흡수, 흡착, 이온교환 중 하나로 분류된다. 이 중 "흡수"는 샘플과 고정상 간에 발생하는 화학적 상호작용에 의해 샘플 성분이 분리되는 방법이다. 즉, 고정상이 특정 성분을 흡수하고 분리하는 원리를 이용하는 것이다.
52. 강산이나 강알칼리등과 같은 유독한 액체를 취할 때 실험자가 입으로 빨아 올리지 않기 위하여 사용하는 기구는?
- 피펫필러
- 자동뷰렛
- 홀피펫
- 스포이드
- 피펫필러는 액체를 빨아 올리는 기능을 가진 피펫의 끝 부분에 부착되어, 실험자가 입으로 빨아 올리지 않고도 안전하게 액체를 빨아 올릴 수 있도록 도와주는 기구입니다. 따라서 강산이나 강알칼리 등과 같은 유독한 액체를 다룰 때에도 안전하게 실험을 진행할 수 있습니다.
53. 분광광도계의 광원 중 중수소 램프는 어느 범위에서 사용하는 광원인가?
- 자외선
- 가시광선
- 적외선
- 감마선
- 분광광도계의 광원 중 중수소 램프는 자외선 범위에서 사용하는 광원입니다. 이는 중수소 램프가 자외선을 방출하기 때문입니다. 자외선은 분자의 구조나 화학적 성질을 파악하는 데 유용하게 사용됩니다.
54. 가스크로마토그래피에 검출기에서 황, 인을 포함한 화합물을 선택적으로 검출하는 것은?
- 열전도도 검출기(TCD)
- 불꽃광도 검출기(FPD)
- 열이온화 검출기(TID)
- 전자포획형 검출기(ECD)
- 불꽃광도 검출기(FPD)는 황, 인 등의 원소가 포함된 화합물을 선택적으로 검출할 수 있습니다. 이는 FPD가 화합물이 불꽃을 발생시키면서 발생하는 UV, 빛, 열 등의 방사선을 감지하여 검출하기 때문입니다. 따라서 FPD는 화합물의 특정 원소를 검출하는 데에 효과적인 검출기입니다.
55. 옷, 종이, 고무, 플라스틱 등의 화재로 소화 방법으로는 주로 물을 뿌리는 방법이 많이 이용되는 화재는?
- A급 화재
- B급 화재
- C급 화재
- D급 화재
- A급 화재는 일반적인 물 소화기로도 소화가 가능한 화재로, 옷, 종이, 고무, 플라스틱 등의 가연성 물질이 대표적입니다. 이러한 물질들은 물을 뿌리면 물의 열 흡수와 증기화로 인해 불꽃이 꺼지기 때문에 물 소화기로 소화가 가능합니다. 따라서 A급 화재는 물 소화기를 이용한 소화가 가장 효과적입니다.
56. 어떤 시료를 분광광도계를 이용하여 측정하였더니 투과도가 10%T 이었다. 이 때 흡광도는 얼마인가?
- 0.1
- 0.8
- 1
- 1.6
- 투과도와 흡광도는 다음과 같은 관계가 있습니다.
투과도 = 10%T = 0.1
흡광도 = log(1/투과도) = log(1/0.1) = 1
따라서 정답은 "1" 입니다.
57. 가스크로마토그래피의 주요부가 아닌 것은?
- 시료 주입부
- 운반 기체부
- 시료 원자화부
- 데이터 처리장치
- 가스크로마토그래피에서 시료 원자화는 주로 질량분석기와 연계하여 사용되는 기술로, 가스크로마토그래피의 주요부는 아닙니다. 따라서 시료 원자화부가 정답입니다. 시료 주입부는 시료를 적절한 양과 속도로 주입하는 역할을 하며, 운반 기체부는 시료를 운반하여 분리기에 공급하는 역할을 합니다. 데이터 처리장치는 분석 결과를 수집하고 처리하여 보고서를 작성하는 역할을 합니다.
58. 불꽃이온화 검출기의 특징에 대한 설명으로 옳은 것은?
- 유기 및 무기화합물을 모두 검출할 수 있다.
- 검출 후에도 시료를 회수할 수 있다.
- 감도가 비교적 낮다.
- 시료를 파괴한다.
- 불꽃이온화 검출기는 시료를 불꽃으로 가열하여 이온화시키고, 이온화된 원자나 이온들이 방출하는 빛을 측정하여 원자나 이온의 존재를 검출하는 기기입니다. 이 과정에서 시료는 불꽃으로 가열되어 파괴되기 때문에 시료를 회수할 수 없습니다. 따라서 "시료를 파괴한다."가 옳은 설명입니다. 또한, 불꽃이온화 검출기는 유기 및 무기화합물을 모두 검출할 수 있지만 감도가 비교적 낮은 편입니다.
59. 분석하려는 시료용액에 음극과 양극을 담근 후, 음극의 금속을 전기화학적으로 도금하여 전해 전후의 음극무게 차이로부터 시료에 있는 금속의 양을 계산하는 분석법은?
- 전위차법(potentiometry)
- 전해무게분석법(electrogravimetry)
- 전기량법(coylometry)
- 전압전류법(voltammetry)
- 전해무게분석법은 시료용액에 음극과 양극을 담근 후, 음극의 금속을 전기화학적으로 도금하여 전해 전후의 음극무게 차이로부터 시료에 있는 금속의 양을 계산하는 분석법입니다. 따라서 정답은 전해무게분석법입니다.
60. 중크롬산칼륨 표준용액 1000ppm 으로 10ppm 의 시료용액 100mL를 제조하고자 한다. 필요한 표준용액의 양은 몇 mL 인가?
- 1
- 10
- 100
- 1000
- 1000ppm의 표준용액 1mL에는 중크롬산칼륨이 1000/1000000g = 0.001g 존재한다. 따라서 10ppm의 시료용액 100mL에는 중크롬산칼륨이 0.001g/L x 10/1000000 x 100mL = 0.00001g = 0.01mg 존재한다. 이를 만들기 위해서는 0.01mg/0.001g/mL = 0.01mL의 표준용액이 필요하다. 따라서 정답은 "1"이다.





