1과목: 과목구분없음
1. 다음은 생활에서 이용되는 화학 에너지에 관한 설명이다. 
㉠~㉤ 중 화합물의 수는?
- 1
- 2
- 3
- 4
- 5
2. 다음은 인류 문명의 발전에 기여한 몇 가지 산화 환원 반응이다. 
(가)~(다)에 가장 적절한 것은? (순서대로 가, 나, 다)
- 산화, 산화, 산화
- 산화, 환원, 산화
- 산화, 환원, 환원
- 환원, 산화, 산화
- 환원, 환원, 환원
3. 다음은 글라이신과 염산(HCl(aq))의 화학 반응식이다. 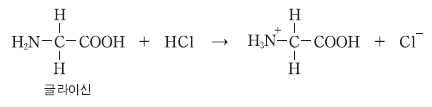
이 반응에서 글라이신에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
4. 그림 (가)와 (나)는 다이아몬드(C)와 풀러렌(C60)을 모형으로 나타낸 것이다. 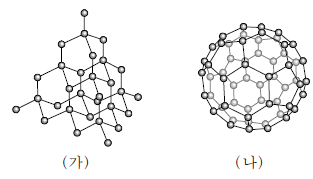
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄱ, ㄴ, ㄷ
5. 다음은 물질의 극성과 용해도의 관계를 알아보기 위하여 민수가 세운 가설과 이를 검증하기 위한 실험이다. 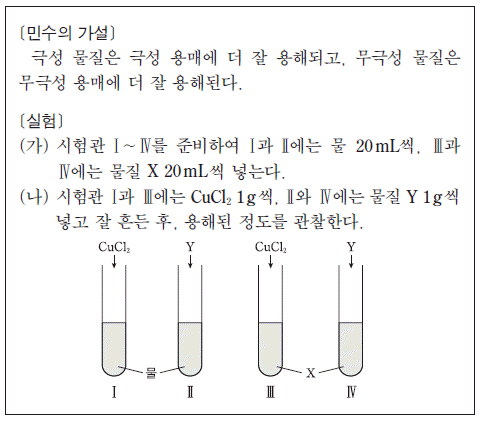
민수가 세운 가설을 검증하기 위하여 실험에서 사용할 X와 Y로 가장 적절한 것은? (순서대로 X, Y) [3점]
- 사염화 탄소(CCl4) 아이오딘(I2)
- 사염화 탄소(CCl4) 염화 나트륨(NaCl)
- 메탄올(CH3OH) 염화 나트륨(NaCl)
- 메탄올(CH3OH) 아이오딘(I2)
- 클로로폼(CHCl3) 아이오딘(I2)
6. 다음은 탄소 화합물(CxHyOz)의 원소 분석 실험과 이 실험에 대한 학생들의 대화이다. 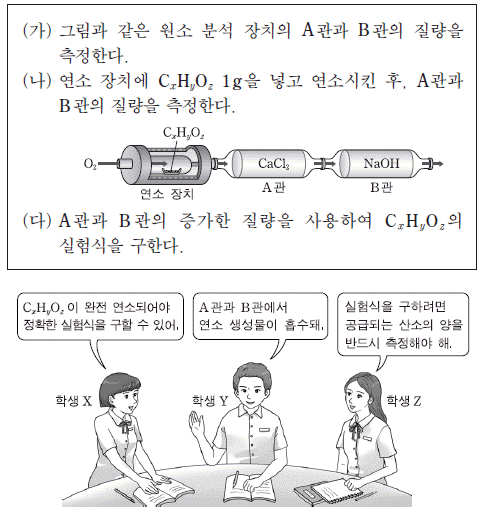
제시한 의견이 옳은 학생만을 있는 대로 고른 것은? [3점]
- X
- Y
- Z
- X, Y
- X, Z
7. 그림은 2주기 원소의 수소 화합물 (가)~(라)에 있는 전자쌍 수를 나타낸 것이다.  와
와  는 각각 공유 전자쌍과 비공유 전자쌍 중 하나이다.
는 각각 공유 전자쌍과 비공유 전자쌍 중 하나이다. 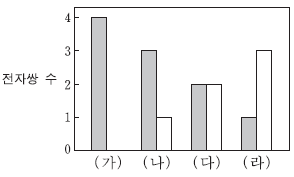
(가)~(라)에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, (가)~(라)에서 2 주기 원소는 모두 옥텟 규칙을 만족한다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
8. 그림은 뉴클레오타이드의 구조를 나타낸 것이다. 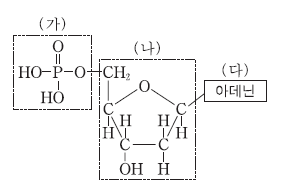
이에 대한 설명으로 옳지 않은 것은?
- DNA가 음전하를 띠는 것은 (가)와 관련이 있다.
- (가)에서 P`원자는 확장된 옥텟 규칙을 만족한다.
- (나)에는 2 개의 비공유 전자쌍이 있다.
- (나)에서 모든 C와 O`원자는 옥텟 규칙을 만족한다.
- (다)는 DNA 이중 나선 구조에서 티민과 수소 결합을 한다.
9. 다음은 마그네슘(Mg)과 염산(HCl(aq))의 화학 반응식이다. 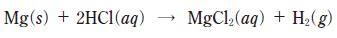
그림은 HCl(aq) 0.1 L 에 Mg을 질량을 달리하여 넣었을 때, Mg의 질량에 따른 생성물 H2 의 부피를 나타낸 것이다. 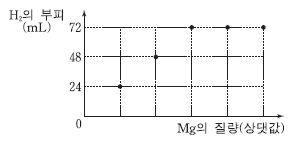
Mg을 넣기 전 HCl(aq) 0.1 L에 들어 있는 Cl-의 양(몰)은? (단, H2 1 몰의 부피는 24 L 이다.) [3점]
- 0.003
- 0.006
- 0.012
- 0.018
- 0.024
10. 표는 X이온과 Y이온을 구성하는 입자 a~c 의 수를 나타낸 것이다. 입자 a 와 b 는 원자핵을 구성한다. 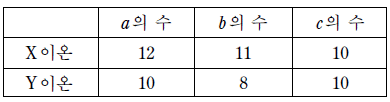
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, X와 Y는 임의의 원소 기호이다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
11. 그림은 이산화 질소(NO2)와 관련된 반응 (가)~(다)를 나타낸 것이다. 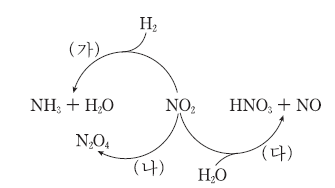
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
12. 그림은 학생들이 그린 전자 배치를 나타낸 것이다. (가)~(다)는 산소(O), (라)는 O+의 전자 배치이다. 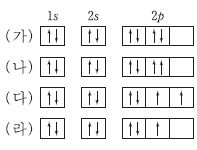
(가)~(라)에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
13. 그림은 원자 a~i의 제1 이온화 에너지를 나타낸 것이다. a~i 는 각각 원자 번호 2~10 의 원소 중 하나이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, a~i 는 임의의 원소 기호이다.) [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
14. 그림은 2 주기 원소 A~E의 전기 음성도와 바닥 상태 원자의 홀전자 수를 나타낸 것이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, A~E는 임의의 원소 기호이다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
15. 그림은 수소 원자의 선 스펙트럼과 선의 색깔을 나타낸 것이다. 그림에서 빨강은 발머 계열 중 가장 긴 파장에 해당한다. 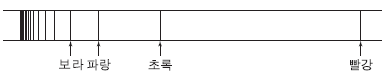
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 수소 원자의 에너지 준위 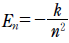 이고, n은 주양자수, k 는 상수이다.)
이고, n은 주양자수, k 는 상수이다.)
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
16. 다음은 고리 모양의 서로 다른 탄화수소 (가)~(다)의 분자식 또는 구조식을 나타낸 것이다. 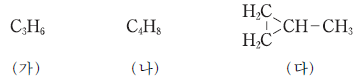
(가)~(다)의 공통점으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, H, C, O의 원자량은 각각 1, 12, 16 이다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
17. 표는 원자량을 정하는 기준과 이와 관련된 자료이다. 현재 사용되는 원소의 원자량은 기준 Ⅰ에 따른 것으로 12C에 대한 상대적 질량이다. 기준 Ⅱ는 영희가 12C 대신 15O를 사용하여 새롭게 제안한 것이다. 
기준 Ⅰ을 적용한 탄소 1 몰과 기준 Ⅱ를 적용한 탄소 1 몰을 각각 완전 연소시켰다. 기준 Ⅰ보다 기준 Ⅱ에서 큰 값만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
18. 다음은 X2 와 Y2 가 반응하여 A를 생성하는 화학 반응식이다. a 는 반응식의 계수이다. 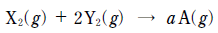
표는 반응 전과 후의 기체에 대한 자료이다. 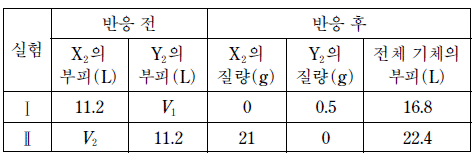
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, X, Y는 임의의 원소 기호이고, 온도와 압력은 일정하며, 기체 1 몰의 부피는 22.4 L 이다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
19. 표는 염산(HCl(aq))에 수산화 나트륨(NaOH(aq))의 부피를 달리하여 혼합한 용액 (가)와 (나)에 대한 자료이다. y 는 x보다 크다. 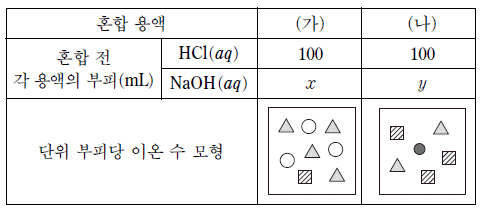
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 중화 반응에 의한 물의 부피 변화는 무시한다.)
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
20. 표는 원소 A~D로 구성된 안정한 화합물 (가)~(라)에 대한 자료이다. A~D는 각각 O, F, Na, Mg 중 하나이다. 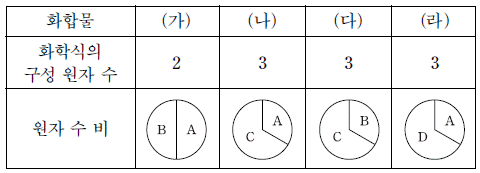
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ





