1과목: 과목구분없음
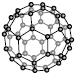
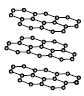
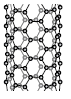
1. 다음은 물질 X에 대한 설명이다. 
X의 구조로 가장 적절한 것은?
2. 다음은 4 가지 질소 화합물이다. 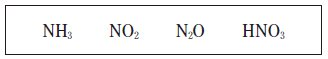
이 화합물에 있는 질소(N)의 산화수 중 가장 큰 값은?
- 1
- 3
- 4
- 5
- 7
3. 다음은 현대 원자 모형에서 바닥 상태 전자 배치에 이용되는 원리 및 규칙이다. 
이에 따른 8O+의 바닥 상태 전자 배치로 옳은 것은?
4. 다음은 포도당 연소 반응의 화학 반응식과 이 반응의 물질을 화합물과 분자로 분류하는 벤 다이어그램이다. 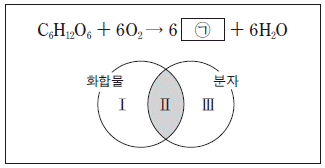
이 반응의 물질에 대한 설명으로 옳지 않은 것은?
- ㉠은 CO2 이다.
- C6H12O6을 구성하는 원소는 3 가지이다.
- Ⅰ영역에 속하는 것은 1 가지이다.
- H2O은 Ⅱ영역에 속한다.
- O2 는 Ⅲ영역에 속한다.
5. 다음은 산 염기 반응의 화학 반응식이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
6. 다음은 2 가지 탄화수소의 화학식이다. 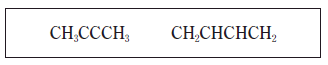
이 탄화수소의 공통점으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?[ 3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
7. 그림은 빅뱅 이후 우주에서 양성자(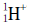 )와 중성자(
)와 중성자( )로부터 헬륨 원자핵이 생성되는 과정을 나타낸 것이다.
)로부터 헬륨 원자핵이 생성되는 과정을 나타낸 것이다. 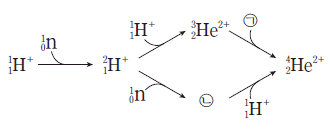
이 과정의 입자에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
8. 표는 4 가지 분자 HCN, CO2, OF2, CH4 을 3 가지 기준에 따라 각각 분류한 결과를 나타낸 것이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
9. 다음은 과망가니즈산 칼륨(KMnO4)과 진한 염산(HCl(aq))이 반응하는 산화 환원 반응의 화학 반응식이다. 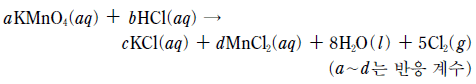
이 반응에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄷ
- ㄴ, ㄷ
10. 그림은 각각 구아닌과 사이토신을 갖는 뉴클레오타이드의 결합 과정을 모식적으로 나타낸 것이다. 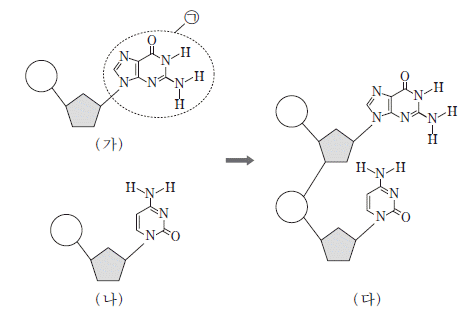
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
11. 다음은 원소 X, Y로 이루어진 순물질 (가)~(다)에 대한 자료이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, X, Y는 임의의 원소 기호이다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
12. 다음은 알루미늄(Al)과 염산(HCl(aq))이 반응할 때의 화학 반응식이다. 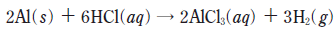
학생 A는 부피가 1.0 cm3 인 Al(s)이 충분한 양의 HCl(aq)과 반응할 때 생성되는 H2(g)의 질량을 <보기>에 있는 자료를 이용하여 이론적으로 구하려고 한다. 학생 A가 반드시 이용해야 할 자료만을 <보기>에서 있는 대로 고른 것은? (단, 온도와 압력은 25℃, 1 기압이다.) [3점]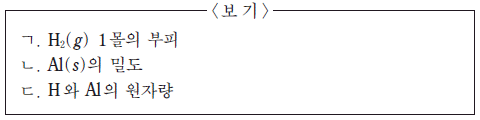
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
13. 그림은 주기율표의 일부를, 표는 안정한 화합물 (가)~(라)의 화학식을 나타낸 것이다. 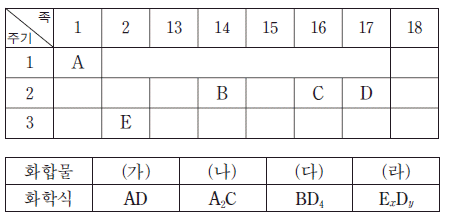
(가)~(라)에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, A~E는 임의의 원소 기호이다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
14. 표는 바닥 상태인 원자 A~D의 원자가 전자 수(a)와 홀전자 수(b)의 차(a-b)를 나타낸 것이다. A~D는 각각 N, F, Na, S 중 하나이다. 
A~D에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
15. 그림은 원자 번호가 연속인 2, 3 주기 원자의 제 1~ 제 3 이온화 에너지를 나타낸 것이다. A~D는 임의의 원소 기호이며, 원자 번호 순서가 아니다. 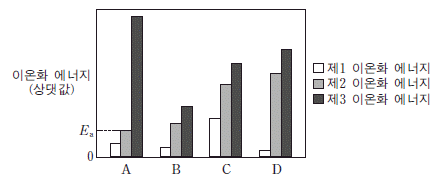
A~D에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
16. 다음은 탄화수소의 실험식을 구하는 실험이다. 
Y의 실험식은? (단, H, C, O의 원자량은 각각 1, 12, 16 이다.) [3점]
- CH
- CH2
- CH3
- C2H3
- C3H4
17. 그림은 수소 원자의 선 스펙트럼에서 가시광선 영역을 나타낸 것이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 수소 원자의 에너지 준위  이고, n은 주양자수, k 는 상수이다.) [3점]
이고, n은 주양자수, k 는 상수이다.) [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
18. 다음은 기체 A와 B의 반응에 대한 자료와 실험이다. 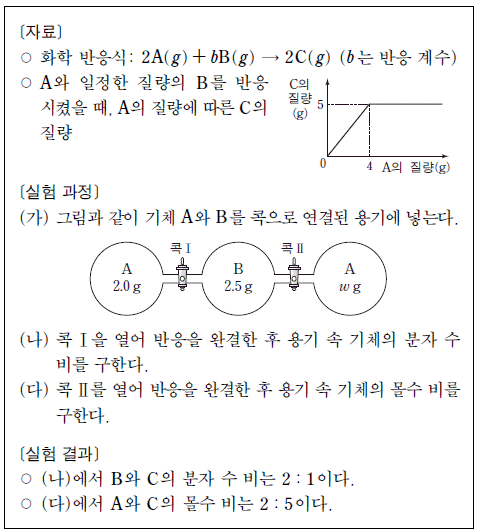
반응 계수(b)와 (가)의 w를 곱한 값(b×w)은?
- 11.2
- 12.0
- 22.4
- 33.6
- 36.0
19. 다음은 2 주기 원소 X~Z 에 대한 자료이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, X~Z는 임의의 원소 기호이고, 모든 원자는 바닥 상태이다.) [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄷ
- ㄴ, ㄷ
20. 표는 염산(HCl(aq))과 수산화 나트륨 수용액(NaOH(aq))을 혼합한 용액 (가)와 (나)에 대한 자료이다. 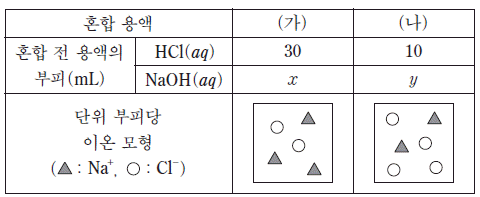
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 혼합 용액의 부피는 혼합 전 각 용액의 부피의 합과 같다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ





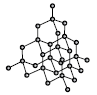
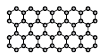

 "이다.
"이다.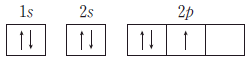
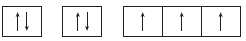
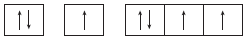

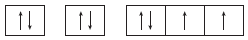
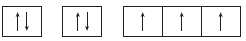 " 이다.
" 이다.