1과목: 과목구분없음
1. 다음은 붕소(B) 원자를 표시한 것이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?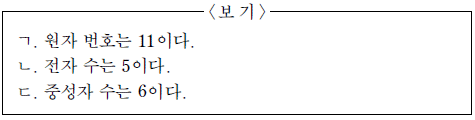
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
2. 그림은 3 가지 고체 (가)~(다)의 결정 구조를 모형으로 나타낸 것이다. 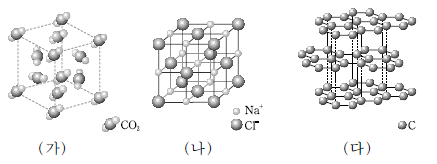
(가)~(다)에 대한 설명으로 옳지 않은 것은?
- (가)는 분자 결정이다.
- (나)는 충격을 가하면 쉽게 부서진다.
- (다)는 흑연이다.
- 화학 결합의 종류는 (가)와 (나)가 같다.
- 전기 전도성은 (다)가 (나)보다 크다.
3. 그림은 같은 온도에서 3 가지 기체 A~C의 분자 운동 속력에 따른 분자 수를 각각 나타낸 것이다. 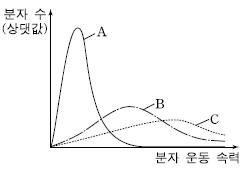
A~C에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
4. 영희는 20℃에서 서로 다른 농도의 HCl(aq)을 이용하여 다음과 같은 실험을 하였다. 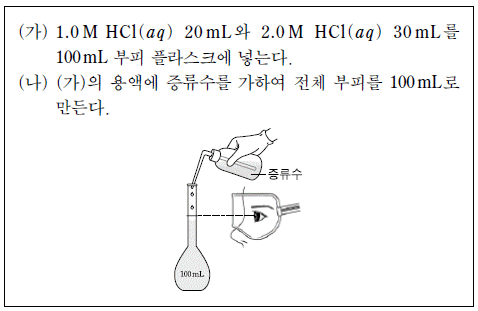
(나)에서 만든 HCl(aq)의 몰 농도(M)로 옳은 것은?
- 0.5
- 0.6
- 0.7
- 0.8
- 0.9
5. 다음은 촉매를 사용한 과산화수소의 분해 반응에서 반응의 진행에 따른 에너지 변화와 반응 메커니즘을 나타낸 것이다. 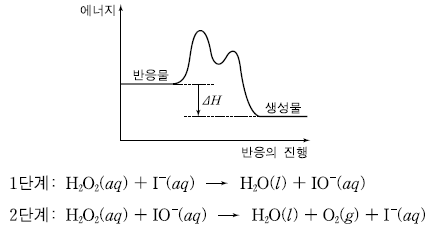
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
6. 그림은 고체 A의 물에 대한 용해도 곡선이고, 표는 A 수용액에 대한 자료이다. 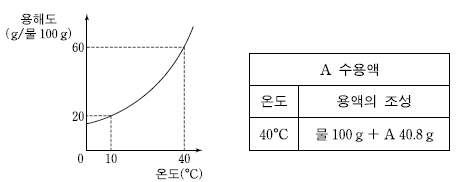
A 수용액에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, A의 화학식량은 102 이다.)
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
7. 그림 (가)는 온도 T1 에서 고체인 어떤 물질 일정량에 대한 압력 P1 , P2 에서의 가열 곡선이고, (나)는 이 물질의 상평형 그림을 나타낸 것이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 가열 중 압력은 일정하다.)
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
8. 그림은 탄소 원자의 몇 가지 가능한 전자 배치를 나타낸 것이다. 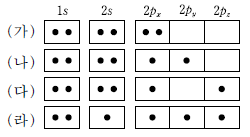
이에 대한 설명으로 옳은 것만을 <보기>에서 있는대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
9. 그림은 2가지 수소 화합물 X2H4와 Y2H4의 구조식이다. X와 Y는 각각 탄소(C)와 질소(N) 중 하나이며, 옥텟 규칙을 만족한다. 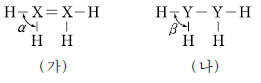
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
10. 그림은 2, 3 주기에 속하는 원소 A~D의 원자가 전자 수에 따른 제1 이온화 에너지를 나타낸 것이다. 
이에 대한 설명으로 옳지 않은 것은? (단, A~D는 임의의 원소 기호이다.) [3점]
- A는 2 주기 원소이다.
- 공유 전자쌍은 A2 가 B2 보다 많다.
- 전기 음성도는 C가 B보다 크다.
- 원자 반지름은 C가 D보다 크다.
- 수소 화합물의 끓는점은 H2B가 H2D보다 높다.
11. 그림은 같은 질량의 3 가지 기체 A~C의 상태를 나타낸 것이다. 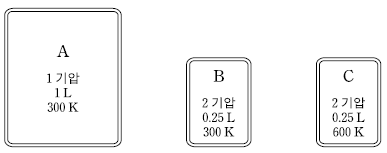
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
12. 표는 C(s, 흑연), CO(g), CO2(g)의 반응열을 나타낸 것이다. 
△H1~△H5 사이의 관계로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]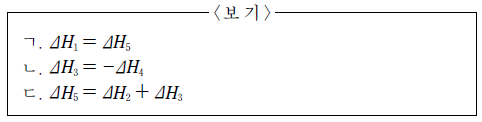
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
13. 다음은 아세트산(CH3COOH) 수용액의 이온화 반응식을 나타낸 것이다. 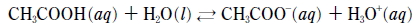
1.0M CH3COOH(aq)가 평형에 도달한 후, 용액에 가해준 변화에 따른 결과로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 온도 변화는 없다.) [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
14. 그림은 질산은(AgNO3) 수용액과 황산구리(CuSO4) 수용액을 각각 전기 분해할 때, 가해준 전하량에 따른 석출된 금속의 질량을 나타낸 것이다. (가)와 (나)는 각각 두 수용액 중 하나이다. 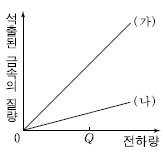
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, Ag와 Cu의 원자량은 각각 108 과 64 이고, (+)극에서 발생되는 기체는 산소(O2)이다.)
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
15. 다음은 약산 HA 수용액의 이온화 반응식과 이온화 상수(Ka)를, 그림 (가)와 (나)는 같은 온도에서 농도와 부피가 다른 HA 수용액을 나타낸 것이다. 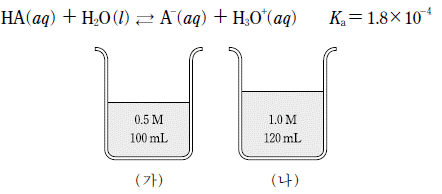
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄷ
- ㄴ, ㄷ
16. 다음은 기체 A 와 B 가 반응하여 기체 C 를 생성하는 화학 반응식과 평형 상수(K)이다. 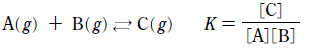
그림 (가)는 칸막이로 분리된 강철 용기에 A( g)와 B( g)를 각각 넣은 초기 상태를, (나)는 칸막이를 제거한 후 평형에 도달한 상태를 나타낸 것이다. 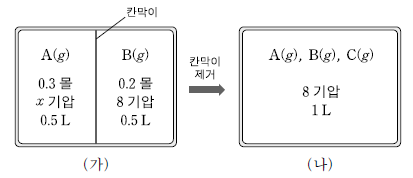
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 반응 전과 후의 온도는 같다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
17. 그림 (가)는 액체 A와 B의 증기압 곡선을, (나)는 100 g 의 A 와 B 각각에 같은 질량의 용질 C를 녹인 용액 X와 Y를 가열할 때 시간에 따른 온도를 나타낸 것이다. 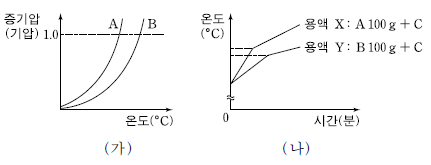
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, C 는 비휘발성이고 비전해질이다. 용액은 라울의 법칙을 따르고, 끓기 전 증발된 용매의 양은 무시한다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
18. 그림 (가)와 (나)는 수용액 100mL에 들어 있는 이온의 종류와 농도를, (다)는 (가)와 (나)를 섞어 반응시켰을 때 수용액에 존재하는 이온의 종류를 나타낸 것이다. 
위 반응의 산화·환원 반응식은 다음과 같다. 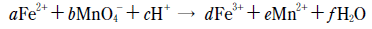
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 그림에서 구경꾼 이온은 제외하였고, (다)에서 생성되는 물의 부피는 무시하였다.) [3점]
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄱ, ㄴ, ㄷ
19. 그림은 25℃ 에서 약산 HA(aq)와 HB(aq)를 0.2M NaOH(aq)로 각각 적정한 중화 적정 곡선이다. 점 a 에서 [HA]=[A-]이고 점 b 에서 [HB]=[B-]이다. 
적정 전 HA(aq)와 HB(aq)에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 약산의 이온화 상수 Ka=Ca2으로 가정하고 C는 약산의 초기 농도, a는 이온화도이다.)
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
20. 다음은 비가역적으로 일어나는 기체 A와 B의 반응에 대한 화학 반응식과 반응 속도식을 나타낸 것이다. k는 속도 상수이고, m과 n 은 반응 차수이다. 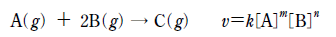
표는 일정 온도의 강철 용기에서 A( g)와 B( g)를 반응시켰을 때, 반응 전 기체의 몰수와 반응 시간이 t 초일 때 전체 몰수를 나타낸 것이다. 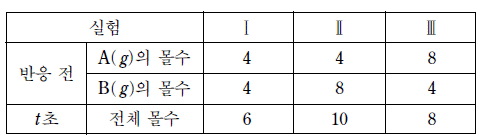
실험Ⅱ에서 반응 시간이 2t 초일 때 C( g)의 몰수는? (단, 반응이 진행되는 동안 온도 변화는 없다.) [3점]
- 5/4
- 3/2
- 7/4
- 2
- 9/4





