1과목: 과목구분없음
1. 다음은 물의 비열에 대한 설명이다. 
다음 중 (가)에 가장 적절한 것은?
- 용해성
- 전기 전도성
- 공유 결합
- 이온 결합
- 수소 결합
2. 그림과 같이 물에 수산화나트륨(NaOH)을 넣었더니 온도가 올라 갔다. 
이 반응에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
3. 표는 물질 (가)~(다)의 화학식과 기준 끓는점을 나타낸 것이다. 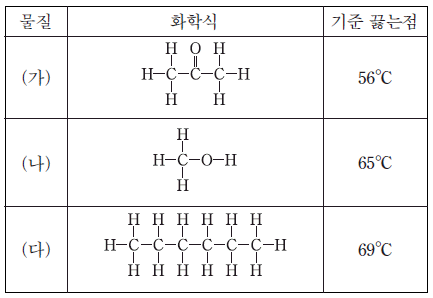
(가)~(다)에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
4. 그림 (가)는 10℃에서 물 50g에 염화 칼륨(KCl) 35g을 넣어 만든 포화 용액을 (나)는 온도에 따른 KCl의 용해도를 나타낸 것이다. 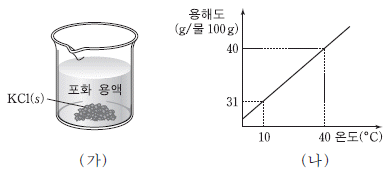
(가)에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 물의 증발은 무시한다.)
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
5. 다음은 얼음의 융해에 대한 반응식이고, △G는 정반응의 자유에너지 변화이다. 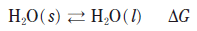
그림은 0℃, 1기압에서 H2O의 두 상의 평형 상태와 온도를 변화시켰을 때 H2O의 상변화를 나타낸 것이다. 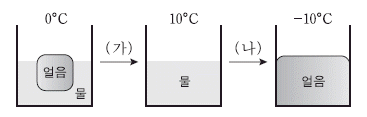
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
6. 다음은 A와 B가 반응하여 C가 생성되는 화학 반응식이다. 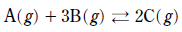
1L 강철 용기에 A(g) 0.02몰과 B(g) 0.04몰을 넣고 반응시켜 평형에 도달하였을 때 A(g)는 0.01몰이었다. 이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 온도는 일정하다.) [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄷ
- ㄴ, ㄷ
7. 다음은 반응 (가)~(다)의 화학 반응식이다. 
표는 반응 엔탈피(△H)와 반응 엔트로피(△S)의 부호를 나타낸 것이다. 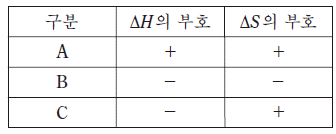
(가)~(다)를 A~C 중 하나에 옳게 연결한 것은? (순서대로 가, 나, 다)
- A, B, C
- B, A, B
- B, C, B
- C, B, A
- C, C, A
8. 그림은 고체 (가)~(다)의 결정 구조를 모형으로 나타낸 것이다. 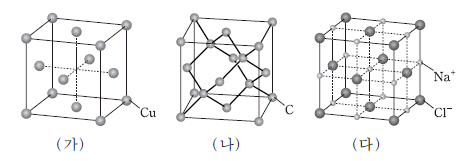
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
9. 그림은 25℃, 1기압에서 몇 가지 반응의 엔탈피(H) 변화를 나타낸 것이다. 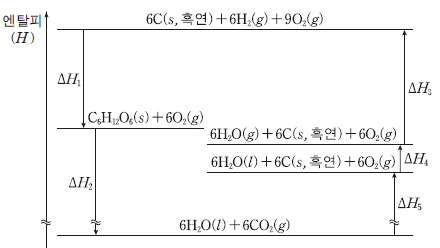
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
10. 다음은 고체 시료가 담긴 용기 내에서 시료 입자가 차지하지 않은 공간의 부피(V)를 구하기 위한 실험이다. 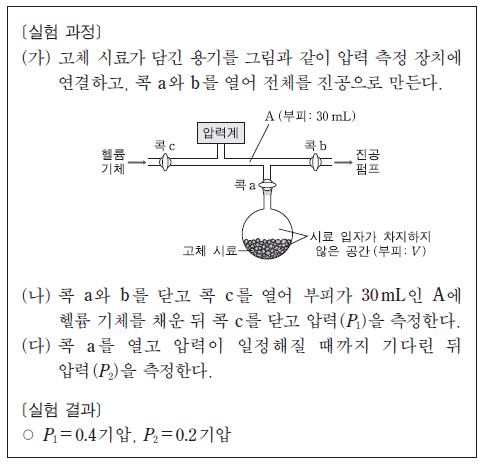
이 실험 결과로부터 구한 V는?(단, 온도는 일정하며, 콕의 부피와 고체 시료의 증기 압력은 무시한다.)
- 30mL
- 40mL
- 50mL
- 60mL
- 70mL
11. 다음은 A2와 B2가 반응하여 AB2가 생성되는 화학 반응식이다. 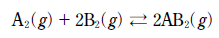
그림 (가)는 1L 용기내에서의 반응 전 모습을, (나)는 반응 후의 평형 상태를 분자 모형으로 나타낸 것이다. 분자 모형 1개는 기체 분자 1몰에 해당한다. 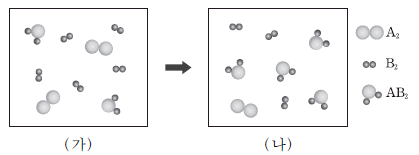
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, A와 B는 임의의 원소 기호이며 온도는 일정하다.)
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
12. 그림은 어떤 반응의 온도 (T)에 따른 반응 엔탈피(△H)와 T△S를 나타낸 것이다. △S는 반응 엔트로피이다. 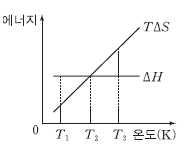
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
13. 표는 수용액 (가)와 (나)에 대한 자료이다. 
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 에탄올과 요소의 분자량은 각각 46, 60이다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
14. 300K, 1기압에서 금속 아연(Zn)을 0.2M 염산(HCl) 0.2L에 넣었더니 Zn이 모두 반응하여 기체 0.24L가 발생하였다. 반응 후 남은 용액 0.2L에서 수소 이온 (H+)의 몰농도는? (단, HCl은 용액에서 모두 이온화하며 온도는 일정하고 기체 상수(R)는 0.08기압·L/몰·K이며, 물의 증발은 무시한다.)
- 0.03M
- 0.05M
- 0.07M
- 0.1M
- 0.15M
15. 그림 (가)는 t℃에서 농도가 다른 설탕물 A, B와 물이 서로 다른 플라스크에 들어 있는 모습을, (나)는 온도에 따른 A와 B의 증기 압력을 나타낸 것이다. 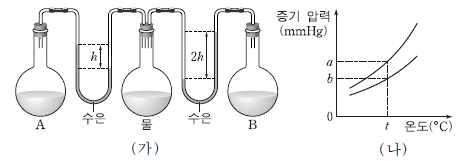
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 설탕물은 라울 법칙을 따른다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
16. 다음은 기체 X와 Y의 열화학 반응식이다. 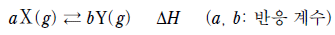
그림은 일정한 부피의 용기에서 X와 Y 혼합 기체의 총몰수를 시간에 따라 나타낸 것이다. 
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 평형Ⅰ과 Ⅱ에서 온도는 같다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
17. 그림 (가)와 (나)는 동일한 질량의 이산화 탄소(CO2)가 부피가 같은 밀폐된 두 용기에서 각각 평형을 이루고 있는 것을 나타낸 것이고, (다)는 CO2의 상평형 그림이다. 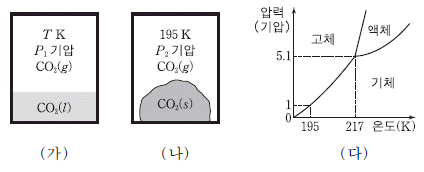
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
18. 다음은 X와 Y가 반응하여 Z가 생성되는 화학 반응식이다. 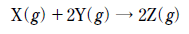
그림은 X와 Y가 각각 들어있는 두 용기를 진공인 용기에 연결한 상태를 나타낸 것이다. 콕 a와 b를 열어 반응이 완결된 후, 콕 c를 열어 바늘구멍을 통해 빠져나오는 두 종류 기체의 분출 속도의 비는 2 : 3이었다. 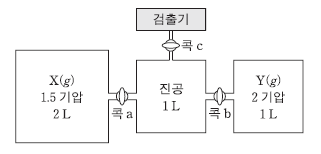
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 온도는 300K로 일정하며 기체 상수(R)는 0.08기압·L/몰·K이고, 콕과 연결관의 부피는 무시한다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
19. 그림은 실린더에 H2O과 He이 들어있는 상태(평형Ⅰ)를 나타낸 것으로, 실린더 내의 기체의 부피와 압력은 1L, 0.5기압이다. 평형 Ⅰ에서 피스톤의 고정 장치를 풀어 평형 Ⅱ에 도달하였고, 이때 대기압은 1기압이다. 
평형 Ⅰ과 Ⅱ에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 온도는 일정하며, He의 용해와 피스톤의 질량과 마찰은 무시한다.)
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
20. 다음은 A와 B가 반응하여 C가 생성되는 화학 반응식과 평형 상수(K)를 나타낸 것이다. 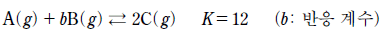
그림 (가)는 피스톤으로 분리된 실린더 양쪽에 A~C가 각각 평형을 이루고 있는 상태를 (나)는 고정 장치 제거 후 피스톤이 이동한 평형 상태를 나타낸 것이다. 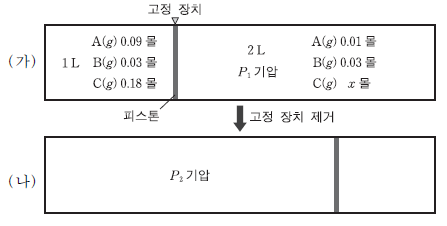
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (온도는 일정하고 피스톤의 마찰은 무시한다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ






물 분자는 극성을 가지고 있어서 수소와 산소 사이에 부분적인 양성과 음성이 생기게 됩니다. 이러한 극성으로 인해 물 분자들은 서로 수소 결합을 형성하게 되는데, 이는 분자 간의 인력으로 작용합니다. 이 수소 결합은 물 분자들을 서로 결합시켜서 물의 높은 비열을 유발하는 중요한 역할을 합니다.