1과목: 과목구분없음
1. 다음은 어떤 에너지에 대한 설명이다. 
이 에너지로 가장 적절한 것은?
- 수소 에너지
- 조력 에너지
- 지열 에너지
- 풍력 에너지
- 수력 에너지
2. 그림은 기체 A와 B가 반응하여 기체 C가 생성되는 반응에서, 촉매를 사용하지 않은 반응 경로 (가)와 촉매를 사용한 반응 경로 (나)의 에너지 변화를 나타낸 것이다. 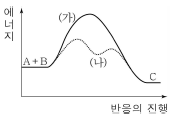
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은?
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
3. 그림은 25℃, 1기압에서 몇 가지 반응의 엔탈피(H) 변화를 나타낸 것이다. 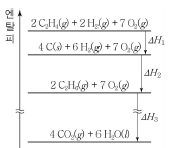
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
4. 그림은 16족 원소 A ~ D의 수소 화합물의 끓는점을 주기에 따라 나타낸 것이다. 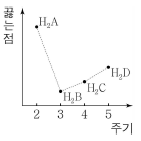
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, A ~ D는 임의의 원소 기호이다.)
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄱ, ㄴ, ㄷ
5. 그림은 고체 (가)~(다)의 결정 구조를 모형으로 나타낸 것이다. 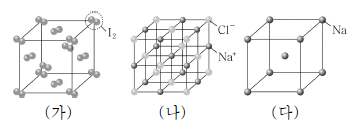
(가)~(다)에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
6. 그림 (가)와 (나)는 25 ℃에서 같은 양의 물이 들어 있는 실린더에 질소(N2) 기체를 넣은 후 평형에 도달한 상태를 나타낸 것이다. 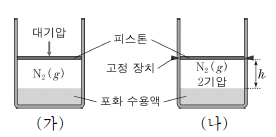
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, 대기압은 1기압이고, 물의 증기압 및 피스톤의 질량과 마찰은 무시한다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
7. 다음은 300 K에서 물질 X의 분자량을 측정하기 위한 실험이다. 
실험 결과로 구한 X의 분자량은? (단, 기체 상수 R = k 기압·L/몰·K이고, X는 비휘발성, 비전해질이다.)
8. 표는 수용액 (가)~(라)의 끓는점 오름(⊿Tb)을 나타낸 것이다. 
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, A ~ C는 비휘발성, 비전해질이고 서로 반응하지 않는다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
9. 그림은 25 ℃에서 어떤 반응 (가)~(다)의 ⊿H와 ⊿G를 나타낸 것이다. 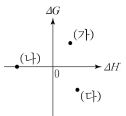
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
10. 그림은 일정한 온도에서 콕이 닫힌 진공 상태의 용기 A, B에 물 90 g과 20 % X 수용액 90 g을 순서 없이 넣고 충분한 시간이 지난 후의 상태를 나타낸 것이다. 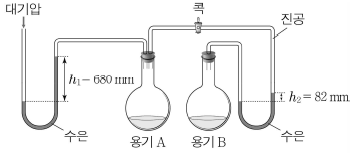
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, X는 비휘발성, 비전해질이고, 대기압은 760 mmHg이며, 물의 분자량은 18이다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
11. 그림은 0.1 M HA(aq) 100 mL에 0.1 M NaOH(aq) x mL를 섞어 혼합 용액을 만드는 과정을 나타낸 것이다. 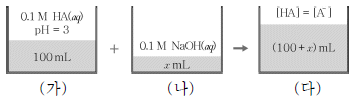
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, 수용액의 온도는 25 ℃로 일정하다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
12. 다음은 온도 T에서 기체 X가 반응하여 기체 Y와 Z가 생성되는 반응의 열화학 반응식이다. 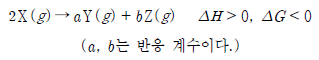
이 반응에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
13. 다음은 수산화 바륨과 염화 암모늄의 반응에 대한 실험이다. 
이 반응에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
14. 다음은 기체 A와 B가 반응하여 기체 C가 생성되는 반응의 화학 반응식과 반응 속도식을 나타낸 것이다. 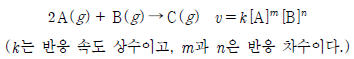
표는 강철 용기에서 A와 B를 반응시켰을 때, 반응 전 기체의 부분 압력과 반응 시간이 t초일 때 기체의 전체 압력을 나타낸 것이다. 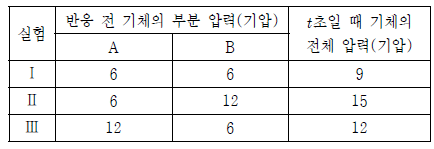
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, 실험 Ⅰ~ Ⅲ에서 온도는 같다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
15. 다음은 기체 A와 B가 반응하여 기체 C가 생성되는 반응의 열화학 반응식이다. 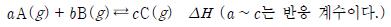
표는 반응 조건을 달리하여 A(g)와 B(g)를 각각 1몰씩 반응 용기에 넣고 반응시켜 평형에 도달하였을 때, C(g)의 몰수를 나타낸 것이다. 온도T2는 T1보다 높다. 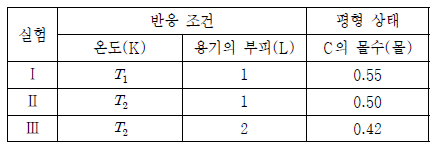
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
16. 그림은 금속 A와 B를 전극으로 하는 화학 전지 (가)와, 금속 B와 C를 전극으로 하는 화학 전지 (나)를 서로 연결한 것을 나타낸 것이다. 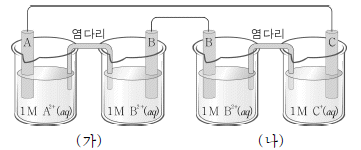
자료는 이와 관련된 반응에 대한 25 ℃에서의 표준 환원 전위(E°)이다. 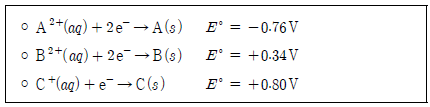
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
17. 다음은 기체 A가 반응하여 기체 B가 생성되는 열화학 반응식이다. 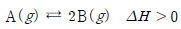
그림 (가)는 온도 T에서 이 반응이 일어날 때 B(g)의 몰 분율에 따른 자유 에너지(G)를, (나)는 부피가 1 L인 강철 용기에 A(g) 1몰을 넣은 초기 상태를 나타낸 것이다. 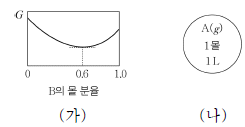
(나)에서 A(g)가 반응하여 평형에 도달하였을 때에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, (나)에서 온도는 T로 일정하다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
18. 다음은 일정한 온도에서 어떤 기체 반응에 대한 실험이다. 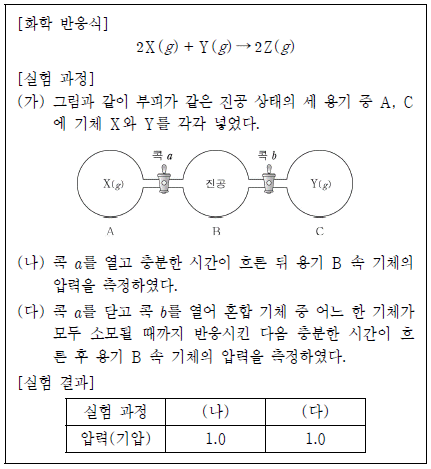
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
19. 그림 (가)는 0 ℃에서 콕이 닫힌 진공 상태의 용기 A와 B에 액체 X와 Y를 각각 넣은 것을, (나)는 (가)에서 시간에 따른 용기 속 기체 X와 Y의 압력을 나타낸 것이다. 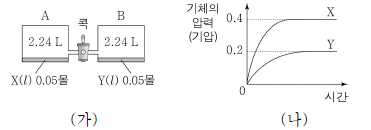
(가)에서 콕을 열고 충분한 시간이 지났을 때에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, X와 Y는 반응하지 않으며, 액체와 연결관의 부피는 무시한다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
20. 다음은 정반응과 역반응의 반응 차수가 모두 1차인 화학 반응식이다. 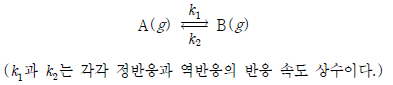
표는 온도 T1과 T2에서 이 반응의 정반응의 반응 속도 상수(k1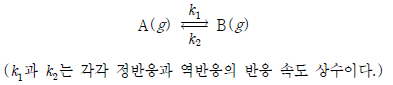
)와 평형 상수(K)를 나타낸 것이다. 
이 반응에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ






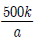
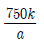
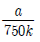
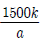
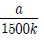
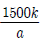 " 이다. 이유는 가스의 상태방정식인 PV=nRT에서 P, V, T는 실험에서 측정 가능하므로 n을 구할 수 있다. 따라서 몰 질량을 구할 수 있고, 이를 분자량으로 나누면 X의 분자량을 구할 수 있다.
" 이다. 이유는 가스의 상태방정식인 PV=nRT에서 P, V, T는 실험에서 측정 가능하므로 n을 구할 수 있다. 따라서 몰 질량을 구할 수 있고, 이를 분자량으로 나누면 X의 분자량을 구할 수 있다.