1과목: 과목구분없음
1. 다음은 수소 연료 전지에 대한 설명이다. 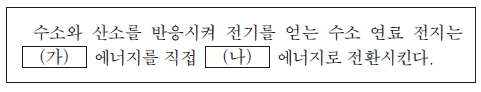
(가)와 (나)에 가장 적절한 것은? (순서대로 가, 나)
- 화학, 전기
- 화학, 원자력
- 화학, 태양
- 태양, 전기
- 태양, 원자력
2. 그림은 N2(g)와 H2(g)가 고체 X 표면에 흡착하여 NH3(g)의 생성이 촉진되는 과정을 모형으로 나타낸 것이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
3. 다음은 3 가지 액체 상태의 물질이다. 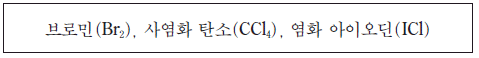
이 물질 중 분자 사이에 분산력이 작용하는 것만을 있는 대로 고른 것은?
- Br2
- ICl
- Br2, CCl4
- CCl4, ICl
- Br2, CCl4, ICl
4. 그림은 어떤 이온 화합물 결정의 단위 세포를 나타낸 것이다. 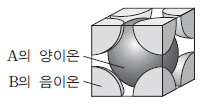
이 화합물의 화학식으로 옳은 것은? (단, A와 B는 임의의 원소 기호이다.)
- AB
- AB2
- AB3
- A2B
- A2B3
5. 표는 고체 A와 B를 각각 녹인 2 가지 수용액에 대한 자료이다. 
 은? (단, A와 B는 비휘발성, 비전해질이다.) [3점]
은? (단, A와 B는 비휘발성, 비전해질이다.) [3점]
- 1.9
- 2.5
- 3.0
- 3.8
- 5.7
6. 다음은 25 ℃, 1 기압에서 수행한 물(H2O)의 상변화에 대한 실험이다. 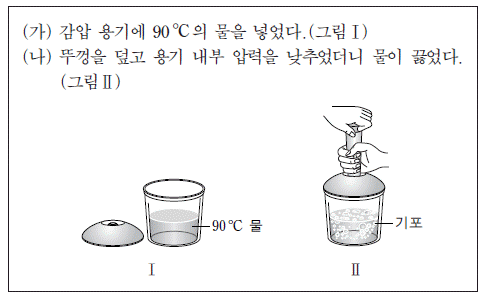
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄷ
- ㄴ, ㄷ
7. 그림 (가)는 수은이 들어 있는 유리관 아래쪽에 소량의 에탄올(C2H6O(l))을 넣은 것을, (나)는 (가)의 에탄올이 수은 기둥 위로 올라간 후 평형에 도달한 것을 나타낸 것이다. (다)는 에탄올 대신 다이에틸 에테르(C4H10O(l))로 실험한 결과를 나타낸 것이다. h1>h2 이다. 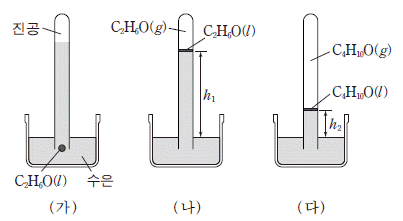
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 온도와 대기압은 일정하다.) [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄷ
- ㄴ, ㄷ
8. 다음은 온도 T 에서 C3H8 의 연소 반응식과 실린더에 반응물이 들어 있는 초기 상태를 나타낸 것이다. 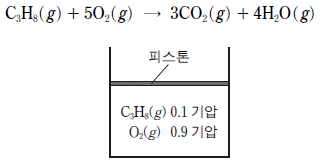
반응이 완결된 후, 온도 T에서 실린더 속 기체에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 대기압은 일정하고 피스톤의 질량과 마찰은 무시한다.) [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
9. 다음은 A 수용액 (가)~(다)를 만드는 과정이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, A의 화학식량은 100 이고 온도는 일정하다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
10. 그림은 구리(Cu)와 은(Ag)을 사용한 화학 전지에서 전지 반응이 일어나고 있는 것을 나타낸 것이다. 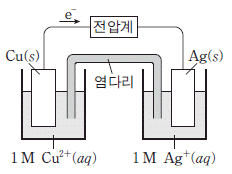
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄷ
- ㄴ, ㄷ
11. 다음은 25 ℃에서 3 가지 열화학 반응식이다. 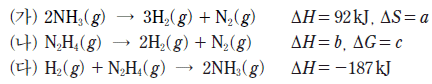
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
12. 단열 용기에 O3 ( g)을 넣어 NO( g)와 반응시켰을 때, 강철 용기 A에 들어 있는 기체에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점](12번 공통지문 문제)
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
13. 다음은 물(H2O)의 상평형 그림이다. 절대 온도 T1, 1 기압에서 물 1 몰이 기화되는 과정의 엔탈피 변화와 엔트로피 변화는 각각 a 와 b 이다. 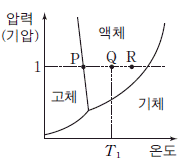
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
14. 다음은 A에서 B와 C가 생성되는 열화학 반응식과 평형 상수 (K)이다. 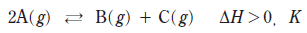
표는 3 개의 강철 용기에 각각 같은 질량의 A를 넣고 반응시켜 도달한 평형 상태 Ⅰ~Ⅲ에 대한 자료이다. 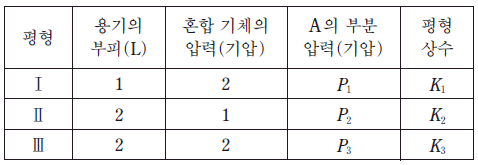
K1~K3 중 최댓값(㉠)과 P1, P2 중 큰 값(㉡)으로 옳은 것은? (순서대로 ㄱ, ㄴ) [3점]
- K1, P1
- K2, P1
- K2, P2
- K3, P1
- K3, P2
15. 다음은 A가 반응하여 B를 생성하는 화학 반응식이다. 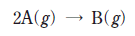
강철 용기에서 이 반응이 일어날 때, 그림 (가)는 온도 T1 과 T2 에서 A의 초기 농도에 따른 초기 반응 속도를, (나)는 온도가 각각 T1 과 T2 에서 일어나는 반응의 시간에 따른 A의 농도를 나타낸 것이다. 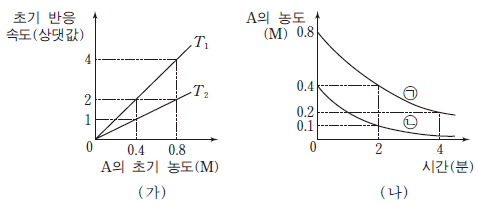
(나)에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
16. 표는 온도 T1 과 T2 에서 각각 포화된 A 수용액 (가)와 (나)에 대한 자료이다. 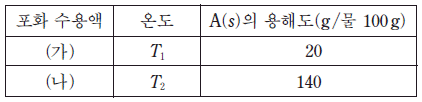
같은 질량의 (가)와 (나)를 혼합한 용액의 온도를 T3 으로 유지 하였을 때, 녹아 있는 A와 석출된 A의 질량비는 3 : 1 이었다. T3 에서 A의 용해도(g/물 100 g)는? [3점]
- 15
- 25
- 30
- 45
- 60
17. 그림은 HCl(aq)과 약산 HA(aq)의 혼합 수용액 100mL 에 1M NaOH(aq)을 넣을 때, 넣은 NaOH(aq)의 부피에 따른 A-의 양을 나타낸 것이다. P에서 pH는 6.3 이다. 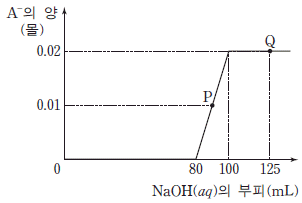
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 온도는 25 ℃로 일정하고, 물의 이온곱 상수(Kw)는 1×10-14이다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
18. 다음은 A가 분해되는 화학 반응식과 평형 상수(K)이다. 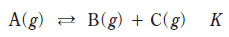
표는 A와 B가 들어 있는 강철 용기에서 A의 분해 반응이 일어날 때, 초기 상태, 평형 상태 Ⅰ, Ⅱ에 대한 자료이다. A의 분자량은 B의 3 배이다. 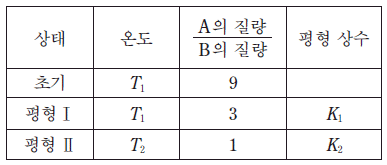
 는?
는?
- 2
- 3
- 4
- 6
- 9
19. 다음은 A에서 B와 C가 생성되는 화학 반응식이다. 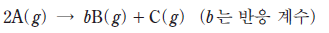
그림은 1기압의 A가 들어 있는 강철 용기에서 반응이 일어날 때, 반응 시간에 따른 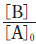 와
와 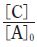 를 나타낸 것이다. [A]0 는 A의 초기 농도이며, 역반응은 일어나지 않는다.
를 나타낸 것이다. [A]0 는 A의 초기 농도이며, 역반응은 일어나지 않는다. 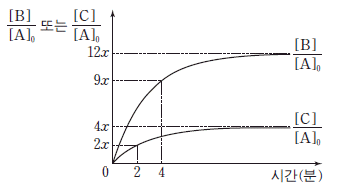
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 온도는 일정하다.) [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ






나: 전기
수소 연료 전지는 화학적 반응을 통해 수소와 산소를 결합시켜 전기를 생산하는 장치이다. 따라서 가는 화학이어야 하고, 생산된 전기를 이용하는 것이므로 나는 전기이어야 한다. "화학, 전기"가 정답이다.
원자력은 핵분열을 통해 전기를 생산하는 것이므로, 수소 연료 전지와는 관련이 없다. 태양은 태양광 발전을 통해 전기를 생산하는 것이므로, 수소 연료 전지와도 관련이 없다.