1과목: 과목 구분 없음
1. 질량이 222.222g이고 부피가 20.0cm3인 물질의 밀도를 올바른 유효숫자로 표시한 것은?
- 11.1111g/cm3
- 11.111g/cm3
- 11.11g/cm3
- 11.1g/cm3
2. 1기압에서 A라는 어떤 기체 0.003몰이 물 900g에 녹는다면 2기압인 경우 0.006몰이 같은 양의 물에 녹게 될 것이라는 원리는 다음 중 어느 법칙과 관련이 있는가?
- Dalton의 분압법칙
- Graham의 법칙
- Boyle의 법칙
- Henry의 법칙
3. 양자수 중의 하나로서 mt로 표시되며 특정 궤도함수가 원자 내의 공간에서 다른 궤도 함수들에 대해 상대적으로 어떠한 배향을 갖는지 나타내는 양자수는?
- 주양자수
- 각 운동량 양자수
- 자기양자수
- 스핀양자수
4. 유기 화합물인 펜테인(C5H12)의 구조이성질체 개수는?
- 1
- 2
- 3
- 4
5. 염소산 포타슘(KClO3)은 가열하면 고체 염화포타슘과 산소 기체를 형성하는 흰색의 고체이다. 2atm, 500K에서 30.0L의 산소 기체를 얻기 위해서 필요한 염소산 포타슘의 몰 수는? (단, 기체상수 R은 0.08L⋅atm/mol⋅K)
- 0.33mol
- 0.50mol
- 0.67mol
- 1.00mol
6. 에틸렌은 CH2=CH2의 구조를 갖는 석유화학 공업에서 아주 중요하게 사용되는 재료이다. 에틸렌 분자 내의 탄소는 어떤 혼성궤도함수를 형성하고 있는가?
- sp
- sp2
- sp3
- dsp3
7. 교통 신호등의 녹색 불빛의 중심 파장은 522nm이다. 이 복사선의 진동수(Hz)는 얼마인가? (단, 빛의 속도는 3.00×108m/s)
- 5.22×107Hz
- 5.22×109Hz
- 5.75×1010Hz
- 5.75×1014Hz
8. Xe는 8A족 기체 중 하나로서 매우 안정한 원소이다. 그런데 반응성이 아주 높은 불소와 반응하여 XeF4라는 분자를 구성한다. 원자가 껍질 전자쌍 반발(VSEPR) 모형에 의하여 예측할 때, XeF4의 분자 구조로 옳은 것은?
- 사각평면
- 사각뿔
- 정사면체
- 팔면체
9. 원소분석을 통하여 분자량이 146.0g/mol인 미지의 화합물을 분석한 결과 질량 백분율로 탄소 49.3%, 수소 6.9%, 산소 43.8%를 얻었다면 이 화합물의 분자식은 무엇인가? (단, 탄소 원자량=12.0g/mol, 수소 원자량=1.0g/mol, 산소 원자량=16.0g/mol)
- C3H5O2
- C5H7O4
- C6H10O4
- C10H14O8
10. 500℃에서 수소와 염소의 반응에 대한 평형상수 Kc=100 이고, 정반응 속도 kf=2.0×103M-1s-1이며 △H=20kJ의 흡열 반응이라면 다음 설명 중 옳은 것은?
- 역반응의 속도가 정반응의 속도보다 빠르다.
- 역반응의 속도는 0.05M-1s-1이다.
- 온도가 증가할수록 평형상수(Kc)의 값은 감소한다.
- 온도가 증가할수록 정반응의 속도가 역반응보다 더 크게 증가한다.
11. 아래에 나타낸 평형 반응에 대한 평형상수는?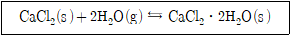
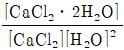
- 1/[H2O]2
- 1/2[H2O]
- [CaCl2⋅2H2O]/[H2O]2
12. 다음 2개의 반응식을 이용해 최종 반응식의 반응 엔탈피(△H3)를 구하면?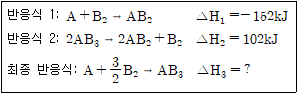
- -254kJ
- -203kJ
- -178kJ
- -50kJ
13. 25℃에서 [OH-]=2.0×10-5M 일 때, 이 용액의 pH 값은? (단, log2=0.30)
- 1.80
- 4.70
- 9.30
- 11.20
14. 진한 암모니아수를 묻힌 솜과 진한 염산을 묻힌 솜을 유리관의 양쪽 끝에 넣고 고무마개로 막았더니 잠시 후 진한 염산을 묻힌 솜 가까운 쪽에 흰 연기가 생겼다. 옳은 설명을 모두 고른 것은?
- 가
- 나
- 가, 나
- 다
15. 토륨-232(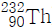 )는 붕괴 계열에서 전체 6개의 α입자와 4개의 β입자를 방출한다. 생성된 최종 동위원소는 무엇인가?
)는 붕괴 계열에서 전체 6개의 α입자와 4개의 β입자를 방출한다. 생성된 최종 동위원소는 무엇인가?
16. 다음 화합물 중 끓는점이 가장 높은 것은?
- HI
- HBr
- HCl
- HF
17. A에서 B로 변하는 어떠한 과정이 모든 온도에서 비자발적 과정이기 위하여 다음 중 옳은 조건은? (단, △H는 엔탈피 변화, △S는 엔트로피 변화)
- △H>0, △S<0
- △H>0, △S>0
- △H<0, △S<0
- △H<0, △S>0
18. 25℃에서 수산화 알루미늄 [Al(OH)3]의 용해도곱 상수(Ksp)가 3.0×10-34 이라면 pH 10으로 완충된 용액에서 Al(OH)3(s)의 용해도는 얼마인가?
- 3.0 × 10-22M
- 3.0 × 10-17M
- 1.73 × 10-17M
- 3.0 × 10-4M
19. 성층권에서 CFCl3와 같은 클로로플루오로탄소는 다음의 반응들에 의해 오존을 파괴한다. 여기에서 Cl과 ClO의 역할을 올바르게 짝지은 것은?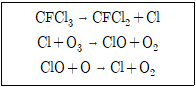
- (Cl, ClO) = (촉매, 촉매)
- (Cl, ClO) = (촉매, 반응 중간체)
- (Cl, ClO) = (반응 중간체, 촉매)
- (Cl, ClO) = (반응 중간체, 반응 중간체)
20. 다음 갈바니 전지 반응에 대한 표준자유에너지변화(△Go)는 얼마인가? (단, E0(Zn2+)=-0.76V, E0(Cu2+)=0.34V이고, F=96,500C/mole-, V=J/C)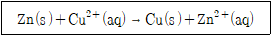
- -212.3kJ
- -106.2kJ
- -81.1kJ
- -40.5kJ






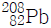
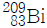

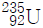
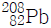 "입니다.
"입니다.