1과목: 과목 구분 없음
1. 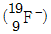 의 양성자, 중성자, 전자 수가 바르게 적힌 것은?
의 양성자, 중성자, 전자 수가 바르게 적힌 것은?
- 양성자: 9, 중성자: 10, 전자: 9
- 양성자: 10, 중성자: 9, 전자: 9
- 양성자: 10, 중성자: 9, 전자: 10
- 양성자: 9, 중성자: 10, 전자: 10
2. <보기>는 수소와 질소가 반응하여 암모니아를 만드는 화학 반응식이다. 이에 대한 설명으로 가장 옳은 것은? (단, 수소 원자량은 1.0g/mol, 질소 원자량은 14.0g/mol 이다.)
- 암모니아를 구성하는 수소와 질소의 질량비는 3 : 14이다.
- 암모니아의 몰질량은 34.0g/mol이다.
- 화학 반응에 참여하는 수소 기체와 질소 기체의 질량비는 3 : 1이다.
- 2몰의 수소 기체와 1몰의 질소 기체가 반응할 경우 이론적으로 2몰의 암모니아 기체가 생성된다.
3. 물에 1몰이 녹았을 때 1몰의 A2+와 2몰의 B- 이온으로 완전히 해리되는 미지의 고체 시료 AB2를 생각해 보자. AB2 15g을 물 250g에 녹였을 때 물의 끓는점이 1.53K 증가함이 관찰되었다. AB2의 몰질량[g/mol]은 얼마인가? (단, 물의 끓는점 오름 상수(Kb)는 0.51K· kg· mol-1로 한다.)
- 30
- 40
- 60
- 80
4. -b[W]/dt=k[W]2로 반응속도가 표현되는 화학종 W를 포함하는 화학 반응에 대하여, 가장 반감기를 짧게 만들 수 있는 방법으로 옳은 것은?
- W의 초기 농도를 3배로 높인다.
- 속도상수 k를 3배로 크게 한다.
- W의 초기 농도를 10배로 높인다.
- 속도상수 k와 W의 초기 농도를 각각 3배로 크게 한다.
5. 암모니아의 합성 반응이 <보기>에 제시되었으며, 특정 실험 온도에서 K값이 6.0×10-2으로 알려져 있다. 해당 온도에서 초기 농도가 [N2]=1.0M, [H2]=1.0×10-2M, [NH3]=1.0×10-4M일 때, 평형에 도달하기 위해 화학 반응이 이동하는 방향을 예측한다면?
- 정반응과 역반응 모두 일어나지 않는다.
- 정반응 방향
- 역반응 방향
- 정반응과 역반응의 속도가 같다.
6. 25℃에서 어떤 수용액의 [H+]=2.0×10-5M일 때, 이 용액의 [OH-] 값[M]으로 옳은 것은?
- 2.0×10-5
- 3.0×10-6
- 4.0×10-8
- 5.0×10-10
7. 외벽이 완전히 단열된 6kg의 철 용기에 담긴 물 23kg이 20℃의 온도에서 평형상태에 존재한다. 이 물에 온도가 70℃인 10kg의 철 덩어리를 넣고 평형에 도달하게 하였을 때 물의 최종 온도[℃]는? (단, 팽창 또는 수축에 의한 영향은 무시한다. 모든 비열은 온도에 무관하다고 가정하며, 물의 비열은 4kJ · kg-1·℃sup>-1, 철의 비열은 0.5kJ · kgsup>-1·℃sup>-1로 한다.)
- 20
- 22.5
- 25
- 27.5
8. KOH(aq)와 Fe(NO3)2(aq)의 균형이 맞추어진 화학 반응식에서 반응물과 생성물의 모든 계수의 합은?
- 3
- 4
- 5
- 6
9. <보기>의 물질 중 입체수(SN, steric number)가 다른 물질은?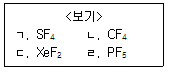
- ㄱ
- ㄴ
- ㄷ
- ㄹ
10. <보기>에 제시된 이상 기체 및 실제 기체에 대한 방정식을 설명한 것으로 가장 옳지 않은 것은?
- 실제 기체 입자들 사이에서 작용하는 인력을 고려할 때, 일정한 압력에서 온도가 낮을수록 실제 기체는 이상 기체에 가까워진다.
- 실제 기체 입자들 사이에서 작용하는 인력을 보정하기 위해 P대신 [P+a(n/V)2]를 사용한다.
- 실제 기체는 기체 입자가 부피를 가지고 있으므로 이를 보정하기 위해 V대신 V-nb를 사용한다.
- 실제 기체는 낮은 압력일수록 이상 기체에 근접한다.
11. 완충 용액에 대한 설명 중 가장 옳지 않은 것은?
- 완충 용액은 약산과 그 짝염기의 혼합으로 만들 수 있다.
- 완충 용액은 약염기와 그 짝산의 혼합으로 만들 수 있다.
- 완충 용액은 센산(strong acid)이나 센염기(strong base)가 조금 가해졌을 때 pH가 잘 변하지 않는다.
- 완충 용량은 pH가 완충 용액에서 사용하는 약산의 pKa에 근접할수록 작아진다.
12. 약산인 아질산(HNO2)은 0.23M의 초기 농도를 갖는 수용액일 때 2.0의 pH를 갖는다. 아질산의 산 이온화 상수(acid ionization constant)인 Ka는?
- 1.8×10-5
- 1.7×10-4
- 4.5×10-4
- 7.1×10-4
13. PCl3 분자의 VSEPR 구조와 PCl3 분자에서 P 원자의 형식 전하를 옳게 짝지은 것은?
- 삼각평면/ +1
- 삼각평면/ 0
- 사면체/ +1
- 사면체/ 0
14. 다음 중에서 가장 작은 이온 반지름을 가지는 이온은?
- F-
- Mg2+
- O2-
- Ne
15. 탄소(C(s)), 수소(H2(g)), 메테인(CH4(g))의 연소 반응 (생성물은 기체 이산화탄소와 액체 물 또는 두 물질 중 하나임.)은 각각 순서대로 390kJ/mol, 290kJ/mol, 890kJ/mol의 열을 방출하는 반응이다. <보기> 반응에서 방출하는 열[kJ/mol]은?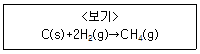
- 80
- 210
- 1,570
- 1,860
16. 어떤 동핵 이원자 분자(X2)의 전자 배치는 <보기>와 같다. 이 분자의 결합 차수는 얼마인가 ?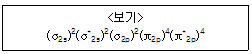
- 1
- 1.5
- 2
- 2.5
17. 미지의 화학종 A가 포함된 두 가지 반쪽반응의 표준환원전위(E°)는 각각 E°(A2+|A)=+0.3V와 E°(A+|A)=+0.4V이다. 이를 바탕으로 계산한 E°(A2+|A+) 값[V]은?
- +0.2
- +0.1
- -0.1
- -0.2
18. S2- 이온의 전자 배치를 옳게 나타낸 것은?
- 1s22s22p63s23p4
- 1s22s22p63s23p6
- 1s22s22p63s23p43d2
- 1s22s22p63s23p44s2
19. HSO4-(Ka=1.2×10-2), HNO2(Ka=4.0×10-4), HOCl(Ka=3.5×10-8), NH4+(Ka=5.6×10-10) 중 1M의 수용액을 형성하였을 때 가장 높은 pH를 보이는 일양성자산은?
- HSO4-
- NH4+
- HOCl
- HNO2
20. 강산인 0.10M HNO3용액 0.5L에 강염기인 0.12M KOH용액 0.5L를 첨가하였다. 반응이 완료된 후의 pH는? (단, 생성물로 생기는 물의 부피는 무시한다.)
- 6
- 8
- 10
- 12





