1과목: 화공열역학
1. 그림에서 동력 W를 계산하는 식은?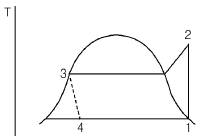
- W=(H2-H3)-(H1-H4)
- W=(H2-H3)-(H4-H1)
- W=(H1-H4)-(H2-H3)
- W=(H4-H1)-(H2-H3)
2. 다음 내연기관 사이클(cycle) 중 같은 조건에서 그 열 역학적 효율이 가장 큰 것은?
- 카르노 사이클(Carnot cycle)
- 오토 사이클(Otto cycle)
- 디젤 사이클(Diesel cycle)
- 사바테 사이클(Sabathe cycle)
3. 일정 온도에서 반데르 발스(Van der Walls) 기체를 V1으로부터 V2 로 팽창시켰다면 내부 에너지 U 의 변화는 1mol 당 얼마가 되겠는가? (단, 반데르 발스 상태방정식은 다음과 같다.)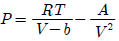
4. P-H선도(P-H diagram)에서 등엔트로피(Isentropic)선의 기울기에 해당하는 식은?
5. 150kPa, 300K에서 2몰 이상기체의 부피는 얼마인가?
- 0.03326m3
- 0.3326m3
- 3.326m3
- 33.26m3
6. 조름공정(Throtting Process)은 다음 중 어느 과정과 그 원리가 같은가?
- 정용과정
- 등온과정
- 등엔드로피과정
- 등엔탈피과정
7. 25℃, 10atm 에서 성분 1, 2 로 된 2성분 액체 혼합물 중 성분 1의 퓨개시티가 다음 식으로 주어진다. 성분 1에 대한 헨리(Henry) 상수는 몇 atm 인가? (단,  은 성분 의 몰분율이고 1 ,
은 성분 의 몰분율이고 1 ,  은 atm 단위를 갖는다.)
은 atm 단위를 갖는다.)
- 10
- 20
- 40
- 50
8. 다음 중 역행 응축(retrograde condensation)을 이용한 것은?
- 가스 같은 기체를 운반하기 위하여 가스통의 압력을 높인다.
- 지하 유정에서 가스를 끌어올 때 가벼운 가스를 다시 넣어주어 압력을 높인다.
- 먼지를 제거하기 위하여 질소를 탱크에서 분사시킨다.
- 냉매를 이용하여 공기를 냉각시켜 에어컨을 가동한다.
9. 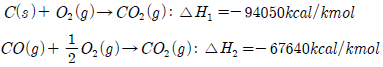 위와 같은 반응을 알고 있을 때 다음의 반응열은 얼마인가?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
위와 같은 반응을 알고 있을 때 다음의 반응열은 얼마인가?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)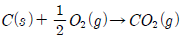
- -37025 kcal/kmol
- -26410 kcal/kmol
- -74050 kcal/kmol
- +26410 kcal/kmol
10. 27℃, 1800atm 하에서 산소 1mol 의 부피는 약 몇 L인가? (단, 압축인자는 1.5 이다.)
- 20.5
- 0.0185
- 0.0205
- 0.00185
11. 이상기체에 대하여 Cp-Cv=nR 이 적용되는 조건은?
12. 단일 성분이 두 상으로 평형을 이룰 때 두 상의 각각의 열역학적 특성치 관계로 옳은 것은?
- 각 상의 내부에너지는 같다.
- 각 상의 자유에너지는 같다.
- 각 상의 엔탈피는 같다.
- 각 상의 일함수는 같다.
13. 어떤 기체의 상태방정식은 P(V-b)=RT 이다. 이 기체 1mol 이 3m3 에서 5m3 로 등온 팽창할 때 행한 일의 크기는? (단, b의 단위는 m3 이고 0 < b < V 이다.)
14. 1atm, 100℃에서 1mol 의 수증기와 물과의 내부에너지 차는 약 몇 cal 인가? (단, 수증기는 이상기체로 생각하고 주어진 압력과 온도에서 물의 증발 잠열은 539cal/g 이다.)
- 189070
- 87090
- 19110
- 8960
15. 물과 에탄올, 벤젠의 3성분계가 기체-액체 상평형을 이루고 있다. 자유도는 얼마인가? (단, 액상은 균일하다.)
- 1
- 2
- 3
- 4
16. 주울-톰슨(Joule-Thomson) 계수 μ에 대한 표현으로 옳은 것은?
17. 절대온도 T 의 일정온도에서 이상기체를 1기압에서 10기압으로 가역적인 압축을 한다면, 외부가 해야 할 일의 크기는?
- RTln10
- RT2
- 9RT
- 10RT
18. 수용액 속에서 낮은 농도로 들어있는 성분(i)에 대하여 그 활동도(activity) 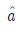 를 옳게 나타낸 것은? (단, Xi= 몰분율, ωi= 질량분율, mi= 몰랄농도(Molarity) 이다.)
를 옳게 나타낸 것은? (단, Xi= 몰분율, ωi= 질량분율, mi= 몰랄농도(Molarity) 이다.)
19. 두헴(Duhem)의 정리는 “초기에 미리 정해진 화학성분들의 주어진 질량으로 구성된 어떤 닫힌계에 대해서도, 임의의 두 개의 변수를 고정하면 평형상태는 완전히 결정된다.”라고 표현할 수 있다. 다음 중 설명이 옳지 않는 것은?
- 정해 주어야 하는 두 개의 독립변수는 세기변수일수도 있고 크기변수일수도 있다.
- 독립적인 크기변수의 수는 상률에 의해 결정 된다.
- F=1 일 때 두 변수 중 하나는 크기변수가 되어야 한다.
- F=0 일 때는 둘 모두 크기변수가 되어야 한다.
20. 다음 중 주울-톰슨(Joule-Thomson) 계수(μ)에 대한 설명으로 옳은 것은?
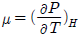 로 정의된다.
로 정의된다.- 항상 양(+)의 값을 갖는다.
- 전환점(inversion point)에서는 1 의 값을 갖는다.
- 이상기체의 경우는 값이 0 이다.
2과목: 단위조작 및 화학공업양론
21. 수분 40wt% 를 함유한 목재 100kg 이 건조기에서 수분 20wt% 까지 건조된다. 증발된 물의 양은 얼마인가?
- 50kg
- 40kg
- 35kg
- 25kg
22. 몰 조성이 79% N2 및 21% O2 인 공기가 있다. 20℃, 740mmHg에서 이 공기의 밀도는 약 몇 g/L 인가?
- 1.17
- 1.34
- 3.21
- 6.45
23. 과열수증기가 190℃(과열), 10 bar 에서 매시간 2000kg/h로 터빈에 공급되고 있다. 증기는 1bar 포화증기로 배출되며 터빈은 이상적으로 가동된다. 수증기의 엔탈피가 다음과 같다고 할 때 터빈의 출력은 몇 kW 인가?
- W = -1200㎾
- W = -292㎾
- W = -130㎾
- W = -30㎾
24. 임계상태에 관련된 설명으로 옳지 않은 것은?
- 임계상태는 압력과 온도의 영향을 받아 기상거동과 액상거동이 동일한 상태이다.
- 임계온도 이하의 온도 및 임계압력 이상의 압력에서 기체는 응축하지 않는다.
- 임계점에서의 온도를 임계온도, 그 때의 압력을 임계 압력이라고 한다.
- 임계상태를 규정짓는 임계압력은 기상거동과 액상거동이 동일해지는 최저압력이다.
25. 상변화에 수반되는 열을 결정하는데 사용되는 Clausis -Clapeyron 식에 대한 설명 중 옳은 것은?
- 온도에 대한 포화증기압 도시(plot)의 최대값으로부터 잠열을 결정할 수 있다.
- 온도에 대한 포화증기압 도시(plot)의 최소값으로부터 잠열을 결정할 수 있다.
- 온도역수에 대한 포화증기압 대수치 도시(plot)의 기울기로부터 잠열을 구할 수 있다.
- 온도역수에 대한 포화증기압 대수치 도시(plot)의 절편으로부터 잠열을 구할 수 있다.
26. CO2 75vol% 과 NH3 25vol% 의 기체 혼합물을 KOH 로 CO2를 제거하였더니 유출가스의 조성은 25vol% CO2 이었다. CO2 제거 효율은 약 몇 % 인가? (단, NH3 의 양은 불변이다.)(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- 10%
- 33%
- 67%
- 89%
27. NH3 가스가 3.5m3 의 용기 속에 21atm, 50℃ 로 들어있다. 이 조건에서 NH3 가스의 압축계수(compressibility factor)가 0.845 라면 용기 속에 들어 있는 NH3 의 양은 약 얼마인가?
- 18.1kg
- 21.4kg
- 47.2kg
- 55.8kg
28. 4HCl+O2→2H2O+2Cl2 의 반응으로 촉매 존재 하에 건조 공기로 건조 염화수소를 산화시켜 염소를 생산한다. 이때 공기를 30% 과잉으로 사용하면 반응기에 들어가는 기체 중 HCl 의 부피조성은 몇 %인가? (단, 공기 중의 산소의 부피조성이 21% 이다.)
- 35.05
- 39.25
- 75.54
- 80.05
29. 30wt% 의 A, 70wt% B 의 혼합물에서의 A의 몰분율은 얼마인가? (단, A 의 분자량은 60이고, B 의 분자량은 140 이다.)
- 0.3
- 0.4
- 0.5
- 0.6
30. 이상기체의 밀도를 옳게 설명한 것은?
- 온도에 비례한다.
- 압력에 비례한다.
- 분자량에 반비례한다.
- 이상기체 상수에 비례한다.
31. 노벽이 두께 25mm 의 내화벽돌과 두께 20cm 의 보통벽돌로 이루어져 있다. 내화벽돌과 보통벽돌의 열전도도는 각각 0.1kcal/mㆍhㆍ℃, 1.2kcal/mㆍhㆍ℃ 이며 노벽의 내면온도는 1000℃ 이고 외면온도는 60℃ 이다. 외부노벽으로부터의 단위면적당 열손실은 몇 kcal/m2ㆍh 인가?
- 1236
- 2256
- 3326
- 4526
32. 펌프의 공동현상을 방지하기 위하여 고려하여야 할 사항이 아닌 것은?
- NPSH(Net Positive Suction Head)를 크게 펌프를 설치한다.
- 유입관로에서의 유속을 작게 배관한다.
- 흡입관로에서의 손실수두를 작게 배관한다.
- 펌프의 회전수를 크게 한다.
33. 원관 내에 유체가 난류로 흐르고 있다. 평균유속은 0.5m/s이며, 축방향 평균제곱 편차속도는 6.35×10-4m2/s2 이다. 난류 강도는 약 몇 % 인가?
- 10
- 8
- 7
- 5
34. 천연가스를 상온 상압에서 150m3 /min 의 유량으로 수송한다. 이 조건에서 공정 파이프 라인(line)의 최적 유속을 1m/s 로 하려면 사용관의 직경은 약 몇 m 로 하여야 하는 가?
- 1.58
- 1.78
- 2.24
- 2.48
35. 저수지로부터 10m 높이의 개방탱크에 펌프로 물을 퍼올린다. 출구의 유속을 3.13m/s 로 유지한다. 유로의 마찰손실을 무시하고 온도가 일정할 때 펌프의 이론 동력은 약 몇 kgfㆍm/kg 인가?
- 10.5
- 13.1
- 14.5
- 16.3
36. 상계점(plait point)에 대한 설명 중 틀린 것은?
- 추출상과 추잔상의 조성이 같아지는 점
- 분배곡선과 용해도곡선과의 교점
- 임계점(critical point)으로 불리기도 하는 점
- 대응선(tie-line)의 길이가 0 이 되는 점
37. 최고공비혼합물에 대한 설명으로 틀린 것은?
- 휘발도가 정규상태보다 비정상적으로 높다.
- 같은 분자간 인력이 다른 분자간 인력보다 작다.
- 활동도계수가 1보다 작다.
- 증기압이 이상용액보다 작다.
38. 증류탑에서 환류비를 나타내는 식으로 옳지 않은 것은? (단, RD, RV 는 환류비, L 은 농축부 강하액량, D 는 탑상부 제품량, V 는 탑내 농축부 상승증기량이다.)
- RD = L/D
- RV = L/V
- RV = L/(L+D)
- RV = D/V
39. 주된 용도가 나머지 셋과 다른 것은?
- 피토관(pitot tube)
- 마노미터(manometer)
- 로타미터(rotameter)
- 벤츄리 미터(venturi meter)
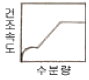
40. 모세관 현상이 지배적인 다공서 고체를 건조할 때 건조속도의 특성을 나타낸 그림은?
3과목: 공정제어
41. 시간 상수가 1분인 1차계로 표현되는 수은 온도계가 25℃의 실내에 놓여 있었다. 어느 순간 이 온도계를 5℃ 의 바깥 공기에 노출시켰다면, 약 몇 분후에 온도계 눈금이 6℃ 를 나타내겠는가?
- 1.0분
- 2.0분
- 3.0분
- 4.0분
42. 0 ~ 500℃ 범위의 온도를 4 - 20mA 로 전환하도록 스팬 조정이 되어 있던 온도센서에 맞추어 조율되었던 PID 제어기에 대하여, 0 ~ 250℃ 범위의 온도를 4 -20mA 로 전환하도록 온도센서의 스팬을 재조정한 경우, 제어성능을 유지하기 위하여 PID 제어기의 조율은 어떻게 바뀌어야 하는가?
- 비례이득값을 2배로 늘린다.
- 비례이득값을 1/2로 줄인다.
- 적분상수값을 1/2로 줄인다.
- 제어기 조율을 바꿀 필요없다.
43. 다음의 함수를 라플라스로 전환한 것으로 옳은 것은?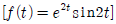
44. 다음 블록선도에서 전달함수 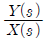 맞는 것은?
맞는 것은?
45. 일차계 공정에 사인파 입력이 들어갔을 때 시간이 충분히 지난 후의 출력은?
- 입력 사인파의 진폭에 공적이득을 곱한 크기의 진폭을 가지는 사인파를 보인다.
- 입력 사인파와 같은 주파수를 가지는 사인파를 보인다.
- 입력 사인파와 같은 위상을 가지는 사인파를 보인다.
- 입력 사인파의 진폭에 공정이득을 나눈 크기의 진폭을 가지는 사인파를 보인다.
46. 비례이득을 변화시켜 공정출력을 연속적으로 진동하게 하여 제어기를 튜닝하는 방법(continuous - cycling)에 관한 다음 설명 중 옳지 않은 것은?
- 시간지연이 없는 1차 공정에 적용이 가능하다.
- 공정에 대한 사전 지식이 없어도 된다.
- 연속진동 주기와 연속진동을 가져오는 비례이득 정보를 이용하여 제어기를 튜닝한다.
- 시간이 많이 걸리고 진동폭이 커지면 위험할 수 있기 때문에 적용할 수 없는 경우가 있다.
47. Disturbance(외부교란)가 시간에 따라 변화할 때 제어변수가 고정된 set point에 따르도록 조절변수를 제어하는 것을 무슨 제어라고 칭하는가?
- 조정(regulatory) 제어
- 서보(servo) 제어
- 감시제어
- 예측제어
48. 어떤 공정이 전달함수 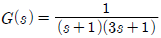 로 표현된다. 공정입력으로 sin(t)가 계속 들어갈 때 시간이 충분히 지난 후의 공정출력에 관한 설명 중 틀린 것은?
로 표현된다. 공정입력으로 sin(t)가 계속 들어갈 때 시간이 충분히 지난 후의 공정출력에 관한 설명 중 틀린 것은?
- 공정출력은 공정입력과 비교해서 an-1(1)+tan-1(3)[radian] 만큼 지연되어서 나타나는 sin파이다.
- 공정출력은 진폭이
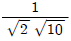 인 sin파이다.
인 sin파이다. - 공정이 안정하기 때문에 출력은 진동하면서 점점 0으로 수렴한다.
- 공정출력은 주파수(frequency)가 1인 sin파이다.
49. Smith predictor 는 어떠한 공정문제를 보상하기 위하여 사용되는가?
- 역응답
- 공정의 비선형
- 지연시간
- 공정의 상호간섭
50. 화학공장에서 공정제어의 필요성에 대한 설명으로 다음 중 가장 거리가 먼 것은?
- 균일한 제품을 생산하여 제품의 질을 향상시키기 위해 필요하다.
- 온도나 압력 등의 공정변수들을 잘 관리하여 사고를 예방하기 위해 필요하다.
- 생산비 절감 및 생산성 향상을 위해 필요하다.
- 공장운전의 완전 무인화를 위해 필요하다.
51. 전달함수가  인 계에서 단위 계단응답 Y(t)는?
인 계에서 단위 계단응답 Y(t)는?
52. 주파수 응답해석(frequency response analysis)에 대한 설명 중 틀린 것은?
- 사인파 형태의 공정입력이 가해졌을 경우, 공정출력의 형태를 해석한 것이다.
- 주파수 응답해석은 앞먹임 제어루프의 안정도를 해석하는 데에 주로 사용된다.
- G(s)를 전달함수로 가지는 공정의 진폭비는 lG(iω)l 이다.
- 보데선도(Bode Plot)는 주파수에 대한 공정의 진폭비와 위상각 변화를 그래프로 표시한 것이다.
53. 어떤 액위(liquid level) 탱크에서 유입되는 유량(m3 /min)과 탱크의 액위(h)간의 관계는 다음과 같은 전달함수로 표시된다. 탱크로 유입되는 유량에 크기 1인 계단변화가 도입되었을 때 정상상태에서 h 의 변화폭은 얼마인가?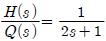
- 1
- 2
- 3
- 6
54. 함수 f(t)의 Laplace 변환이 다음 식과 같을 때 함수 f(t)의 최종 값을 구하면?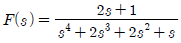
- 0
- 1
- 2
- 3
55. 다음 중 1차 지연시간 공정(First-Order Plus Dead Time process)으로의 근사가 가장 부적절한 공정은?
56. 어떤 계의 단위계단 응답이 다음과 같을 경우 이 계의 단위 충격응답(impulse response)은?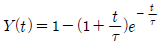
57. 선형계의 제어시스템의 안정성을 판별하는 방법이 아닌 것은?
- Routh-Hurwitz 시험법 적용
- 특성방정식 근궤적 그리기
- Bode 나 Nyquist 선도 그리기
- Laplace 변환 적용
58. 어떤 압력측정장치의 측정범위는 0~400psig, 출력범위는 4~20mA 로 조정되어 있다. 이 장ㅣ의 이득을 구하면 얼마인가?
- 25 mA/psig
- 0.01 mA/psig
- 0.08 mA/psig
- 0.04 mA/psig
59. 다음 중 되먹임 제어계가 불안정한 경우에 나타나는 특성은?
- 이득여유(gain margin)가 1보다 작다.
- 위상여유(phase margin)가 0보다 크다.
- 제어계의 전달함수가 1차계로 주어진다.
- 교차주파수(crossover frequency)에서 갖는 개루프 전달함수의 진폭비가 1보다 작다.
60. 시간지연이 없고 안정한 1차 공정을 비례-적분 제어기로 제어하는 경우에 대한 설명으로 틀린 것은?
- 비례대(proportional band)가 커질수록 폐루프(closed loop)의 응답이 느려진다.
- 직선적으로 증가하는 설정치 변화에 대한 잔류오차는 비례이득(proportional gain)이 증가하면 작아진다.
- 비례이득을 증가시키면 폐루프는 불안정해진다.
- 폐루프 전달함수에 영점(zero)이 나타난다.
4과목: 공업화학
61. 폴리카보네이트의 합성방법은?
- 비스페놀-A와 포스겐의 축합반응
- 비스페놀-A와 포름알데히드의 축합반응
- 하이드로퀴논과 포스겐의 축합반응
- 하이드로퀴논과 포름알데히드의 축합반응
62. H2 와 Cl2 를 직접 결합시키는 합성염화수소의 제법에서는 활성화된 분자가 연쇄를 이루기 때문에 반응이 폭발적으로 진행된다. 실제 조작에서는 폭발을 막기위해서 어떤 조치를 하는가?
- 염소를 다소 과잉으로 넣는다.
- 수소를 다소 과잉으로 넣는다.
- 수증기를 공급하여 준다.
- 반응압력을 낮추어 준다.
63. 다음 중 질산 제조시 가장 널리 사용되는 촉매는?
- V2O5
- Fe-Co
- Pt-Rh
- Cr2O3
64. 암모니아 소다법에서 조중조의 하소(calcination) 때 생성되는 물질은?
- NaHCO3
- Na2CO3
- NaOH
- CaCl2
65. 200kg 의 인산(H3PO4)제조 시 필요한 인광석의 양은 약 몇 kg 인가? (단, 인광석 내에는 30% 의 P2O5 가 포함되어 있으며 P2O5 의 분자량은 142 이다.)
- 241.5
- 362.3
- 483.1
- 603.8
66. 다음 중 국내 올레핀계탄화수소의 공급원으로 가장 많이 쓰이는 것은?
- 석탄가스
- 정유소가스
- 나프타의 열분해
- 석유유분의 분리
67. 박막형성기체 중에서 SiO2 막에 사용되는 기체로 가장 거리가 먼 것은?
- SiH4
- O2
- N2O
- PH3
68. 소오다회 제조법 중 거의 100% 의 식염의 이용이 가능한 것은?
- solvay 법
- Le Blanc 법
- 염안소다법
- 가성화법
69. 연실법 Glover 탑의 질산 환원공정에서 35wt% HNO3 25kg으로부터 NO 를 약 몇 kgf 얻을 수 있는가?
- 2.17kg
- 4.17kg
- 6.17kg
- 8.17kg
70. 암모니아 합성용 수성가스(water gas)의 주성분은?
- H2O, CO
- CO2, H2O
- CO, H2
- H2O, N2
71. 다음 중 질소질비료가 아닌 것은?
- 요소
- 질산암모늄
- 석회질소
- 용성인비
72. 벤조트리클로리드를 알칼리로 가수분해 시켰을 때 얻을 수 있는 주 생성물은?
- 벤조산
- 페놀
- 소듐페녹시드
- 염화벤젠
73. Ni/Cd 전지에서 음극의 수소발생을 억제하기 위해 음극에 과량으로 첨가하는 물질은?
- Cd(OH)2
- KOH
- MnO2
- Ni(OH)2
74. 다음 중 전기 전도성 고분자로 가장 거리가 먼 것은?
- 폴리아세틸렌
- 폴리티오펜
- 폴리피롤
- 폴리실록산
75. 다음 중 1차 전지가 아닌 것은?
- 산화은전지
- Ni-MH전지
- 망간전지
- 수은전지
76. 비중이 1.84 인 황산 10m3 는 몇 kg 인가?
- 10000
- 13500
- 15269
- 18400
77. Friedel - Craft 반응에 사용되는 촉매는?
- AlCl3
- ZnO
- V2O5
- PCl5
78. 석유화학공업에서 분해에 의해 에틸렌 및 프로필렌 등의 제조의 주된 공업원료로 이용되고 있는 것은?
- 경유
- 등유
- 나프타
- 중유
79. 접촉식 황산 제조법에서 주로 사용되는 촉매는?
- Fe
- V2O5
- KOH
- Cr2O3
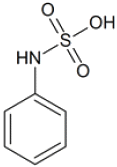
80. 방향족 아민에 1당량의 황산을 가했을 때의 생성물에 해당하는 것은?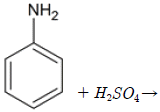
5과목: 반응공학
81. 다음 중 활성화 에너지와 반응속도에 관한 내용으로 틀린것은?
- 주어진 반응에서 반응속도는 항상 고온일 때가 저온일 때보다 온도에 더욱 민감하다.
- 활성화 에너지는 Arrhenius plot 으로부터 구할 수 있다.
- 활성화 에너지가 커질수록 반응속도는 온도에 더욱 민감해진다.
- 경험법칙에 의하면 온도가 10℃ 증가함에 따라 반응 속도는 2배씩 증가하는 경우가 있다.
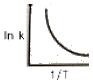
82. 반응속도 상수 k 는 온도 T 의 영향을 많이 받는다. In k와 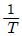 사이의 관계를 옳게 나타낸 그래프는?
사이의 관계를 옳게 나타낸 그래프는?
83. 회분식 반응기에서 어떤 액상 비가역 1차 반응으로 1000초 동안에 반등물의 50% 가 분해되었다. 반응물이 처음 농도의 1/10 이 될 때까지의 시간은 약 얼마인가?
- 33초
- 1600초
- 3340초
- 9320초
84. 비가역 연속 흡열반응 A → R → S 에서 첫 단계 반응의 활성화에너지가 둘째단계 반응의 그것보다 작다. 온도를 조절할 수 있는 플러그 흐름 반응기에서 반응 시킨다면 목표 생성물 R 을 가장 많이 얻기에 가장 적합한 온도분포는?
- 가능한 한 높은 온도를 유지 한다.
- 가능한 한 낮은 온도를 유지 한다.
- 반응기 입구에서는 높은 온도, 출구에서는 낮은 온도를 유지 한다.
- 반응기 입구에서는 낮은 온도, 출구에서는 높은 온도를 유지 한다.
85. 복합반응에서 온도에 따라 활성화에너지(activation energy, E) 변화가 달라지는 것은 반응 메커니즘의 변화 때문이다. 이에 대한 설명으로 가장 적절한 것은?
- 고온에서 E 가 크고 저온에서 E 가 작아지는 것은 연속(직렬)반응이다.
- 고온에서 E 가 크고 저온에서 E 가 작아지는 것은 평행(병렬)반응이다.
- In k 와
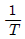 의 그래프에서 오른쪽으로 갈 때 기울기의 절대치가 작아지는 것은 연속(직렬)반응이다.
의 그래프에서 오른쪽으로 갈 때 기울기의 절대치가 작아지는 것은 연속(직렬)반응이다. - In k 와
 의 그래프에서 2개의 직선이 나타나면 메커니즘을 결정할 수 없다.
의 그래프에서 2개의 직선이 나타나면 메커니즘을 결정할 수 없다.
86. A → R, 1차 기초반응이 등온에서 일어나는 정용회분반응기에서 원료 A의 99%가 전환된다. 하루 10시간 조업으로 4752mol 의 R 이 생성되고, 반응온도로 가열시키는 시간이 0.26h 이다. 생성물을 배출시켜 다음 반응을 진행시키는 시간은 0.9h 이다. 속도상수 kc 가 0.02min-1 , 순수 A 의 몰밀도가 8mol/L 일 때 소요 반응기의 체적(L)은?
- 150
- 200
- 250
- 300
87. (CH3)2O→CH4+CO+H2 기상반응이 1atm, 550℃ 하에 CSTR에서 진행될 때 순수한 디메틸에테르의 전화율이 20% 될 때 까지 공간시간(s)은? (단, 반응차수는 1차이고, 속도상수는 4.50×10-3 s 이다.)
- 57.78
- 67.78
- 77.78
- 87.78
88. A + R → R + R 인 자동촉매반응(autocatalytic reaction)에서 반응속도를 반응물의 농도로 플롯할 때 그래프를 옳게 설명한 것은?
- 단조증가한다.
- 단조감소한다.
- 최소치를 갖는다.
- 최대치를 갖는다.
89. 다음과 같은 반응속도식에서 반응속도상수 k 의 단위는?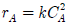
- (mol/L)-1
- (mol/L)-1cm-2
- (mol/L)-1cm-1
- (mol/L)-1h-1
90. 정온 회분반응기(Batch reactor)에서 A 라는 액체가 일차반응에 의해서 분해된다. 5분간 60% 의 A 가 분해 된다고 하면 90% 가 분해되려면 얼마나 오래 걸리는가?
- 약 15.4분
- 약 12.6분
- 약 8.5분
- 약 20.6분
91. 직렬로 연결된 2개의 혼합반응기에서 다음과 같은 액상반응이 진행될 때 두 반응기의 체적 V1 과 V2 의 합이 최소가 되는 체적비 V1/V2 에 관한 설명으로 옳은 것은? (단, V1 은 앞에 설치된 반응기의 체적이다.)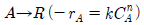
- 0 < n < 1 이면 V1/V2 는 항상 1보다 작다.
- n = 1 이면 V1/V2 는 항상 1 이다.
- n > 1 이면 V1/V2 는 항상 1 보다 크다.
- n > 0 이면 V1/V2 는 항상 1 이다.
92. 액상 직렬 반응 A → R → S 에서 R 이 목표 생성물이다. 이 반응을 플러그 흐름 반응기에서 진행시켜 최대의 R을 얻고자 할 때 반응기의 크기에 관한 설명을 h가장 옳은 것은?
- 작은 것일수록 좋다.
- 큰 것일수록 좋다.
- 반응 속도식에 따라 큰 것일수록 또는 작은 것일수록 좋을 수 있다.
- 항상 최적의 크기가 있다.
93. 반응물 A 는 1차 반응 A → R 에 의해 분해된다. 서로 다른 2개의 플러그 흐름 반응기에 다음과 같이 반응물의 주입량을 달리하여 분해 실험을 하였다. 두 반응기로부터 동일한 전화율 80% 를 얻었을 경우 두 반응기의 부피비 V2/V1 은 얼마인가? (단, FA0 는 공급몰 속도이고 CA0 는 초기 농도 이다.) 반응기 1 : FA0 = 1, CA0 = 1 반응기 2 : FA0 = 2, CA0 = 1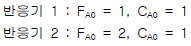
- 0.5
- 1
- 1.5
- 2
94. 회분식 반응기에서 반응시간이 tF 일 때 CA/CA0 의 값을 F라 하면 반응차수 n 과 tF 의 관계를 옳게 표현한 식은? (단, k 는 반응속도상수 이고, n ≠ 1 이다.)
95. 정용 회분식 반응기에서 단분자형 0차 비가역 반응에서의 반응이 지속되는 시간 t 의 범위는? (단, CA0 는 A 성분의 초기농도, k 는 속도상수를 나타낸다.)
96. 다음의 A 와 B 가 참여하는 기초반응에 의해서 목적 생성물 R 과 동시에 부생성물 U, V 를 생성한다. R 로의 전화를 촉진시키기 위한 각 반응물의 농도는? (단, 물질의 가격, 원하는 전화율, 순환의 가능성 등의 인자는 여기서는 고려하지 않는다.)
- CA, CB 모두 높게 유지 한다.
- CA, CB 모두 낮게 유지 한다.
- CA 는 높게, CB 는 낮게 유지 한다.
- CA 는 낮게, CB 는 높게 유지 한다.
97. CSTR(Continuous Stirred Tank Reactor)의 체류시간 분포를 측정하기 위해서 계단입력과 펄스입력을 이용하였다. 다음 중 틀린 것은?
- 계단입력과 펄스입력의 체류시간 분포는 다르다.
- 계단입력과 펄스입력의 평균 체류시간은 같다.
- 펄스입력의 출력곡선은 체류시간 분포와 같다.
- 평균 체류시간은 반응기내의 반응물 부피를 공급량으로 나눈 것과 같다.
98. 관형 반응기를 다음과 같이 연결하였을 때 A 쪽 반응기들의 전화율과 B 쪽 반응기들의 전화율이 같기 위하여 B 쪽으로의 전체 공급 속도에 대한 분율은 얼마인가?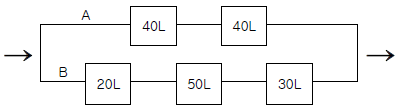
99. 나프탈렌에서 산화반응에 의해 무수푸탈산이 얻어진다. 다음 중 틀린 것은?
- 반응은 발열반응이다.
- 산화촉매의 과열에 의한 열화(劣化)를 방지해야 한다.
- 고온이 적합하므로 액상반응이 적합하다.
- 반응열 제거에 의해 반응은 촉진된다.
100. 균일계 1차 액상반응이 회분 반응기에서 일어날 때 전화율과 반응시간의 관계를 옳게 나타낸 것은?
- In(1-XA)=kt
- -In(1-XA)=kt
- In[XA/(1-XA)]=kt
- In[1/(1-XA)]=kCAOt






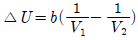
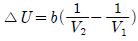
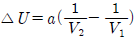
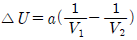
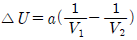 " 이다.
" 이다.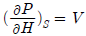
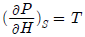

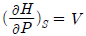
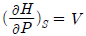 " 입니다.
" 입니다.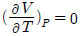
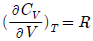
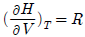
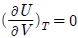
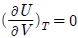 "가 정답이다. 다른 보기들은 이상기체가 아닌 실제 기체의 경우에 해당하는 조건들이다.
"가 정답이다. 다른 보기들은 이상기체가 아닌 실제 기체의 경우에 해당하는 조건들이다.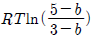
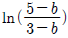
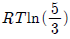
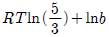
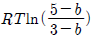 " 이다.
" 이다.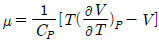
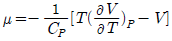
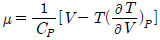

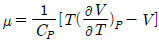 "이다. 이유는 주울-톰슨 계수 μ는 온도와 압력의 변화에 따른 엔탈피 변화를 나타내는 값으로, 이를 수식으로 나타내면 μ = (ΔH/ΔT)p로 표현된다. 따라서 온도 변화에 따른 엔탈피 변화가 크면 μ 값도 커지게 되고, 이는 "
"이다. 이유는 주울-톰슨 계수 μ는 온도와 압력의 변화에 따른 엔탈피 변화를 나타내는 값으로, 이를 수식으로 나타내면 μ = (ΔH/ΔT)p로 표현된다. 따라서 온도 변화에 따른 엔탈피 변화가 크면 μ 값도 커지게 되고, 이는 "

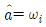
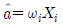
 "이다. 활동도는 실제 농도와 이상적인 농도(표준상태에서의 농도)의 비율로 나타내는 값이다. 따라서 활동도는 몰분율, 질량분율, 몰랄농도와는 다른 개념이다.
"이다. 활동도는 실제 농도와 이상적인 농도(표준상태에서의 농도)의 비율로 나타내는 값이다. 따라서 활동도는 몰분율, 질량분율, 몰랄농도와는 다른 개념이다.


 "이다.
"이다.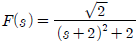
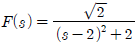
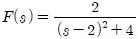
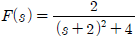
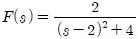 " 이다.
" 이다.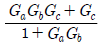

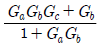
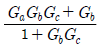
 "가 될 수 있다.
"가 될 수 있다.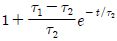
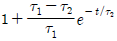
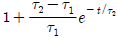
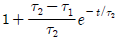
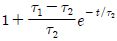 "이다.
"이다.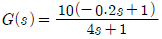
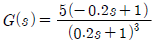
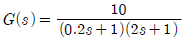

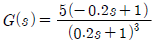 "가 가장 부적절한 공정이다. 이유는 1차 지연시간 공정은 일반적으로 시스템의 동적 특성을 잘 근사하기 때문에, 시스템의 지연시간이 크지 않은 경우에 적합하다. 하지만 "
"가 가장 부적절한 공정이다. 이유는 1차 지연시간 공정은 일반적으로 시스템의 동적 특성을 잘 근사하기 때문에, 시스템의 지연시간이 크지 않은 경우에 적합하다. 하지만 "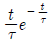
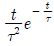
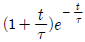
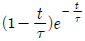
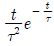
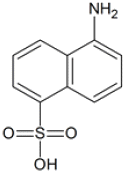
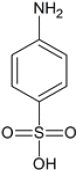
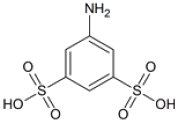
 "이다.
"이다.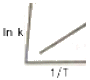

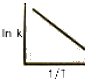
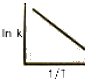 "
"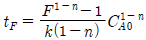

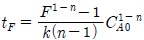

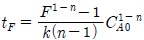 " 이다. 이유는 위에서 설명한 것과 같이, F = 1 - CA/CA0 이므로, CA/CA0 이 0에 가까워질수록 F는 1에 가까워지게 된다. 따라서, 반응이 완료되는 시간인 tF는 더 길어지게 되며, 이는 F와 tF가 반비례 관계에 있음을 의미한다.
" 이다. 이유는 위에서 설명한 것과 같이, F = 1 - CA/CA0 이므로, CA/CA0 이 0에 가까워질수록 F는 1에 가까워지게 된다. 따라서, 반응이 완료되는 시간인 tF는 더 길어지게 되며, 이는 F와 tF가 반비례 관계에 있음을 의미한다.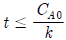

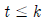

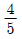
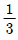

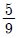
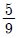 "입니다.
"입니다.