1과목: 화공열역학
1. Carnot 냉동기가 -5℃의 저열원에서 10,000kcal/h의 열량을 흡수하여 20℃의 고열원에서 방출할 때 버려야할 최소 열량은?
- 7,760kcal/h
- 8,880kcal/h
- 10,932kcal/h
- 12,242kcal/h
2. 다성분 상평형에 대한 설명으로 옳지 않은 것은?
- 각 성분의 화학포텐셜이 모든 상에서 같다.
- 각 성분의 퓨개시티가 모든 상에서 동일하다.
- 시간에 따라 열역학적 특성이 변하지 않는 다.
- 엔트로피가 최소이다.
3. 다음 열역학식 중 틀린 것은? (단, H : 엔탈피, Q : 열량, P : 압력, V : 부피, G : 깁스에너지, S : 엔트로피, W : 일)
- H = Q - PV
- G = H - TS
- ΔS = ∫dQrev/T
- W = -∫PdV
4. 이상기체의 주울-톰슨 계수(Joule-Thomson coefficient)의 값은?
- 0
- 0.5
- 1
- ∞
5. 공기가 10Pa, 100m3 에서 일정압력 조건에서 냉각된 후 일정부피 하에서 가열되어 20Pa, 50m3 가 되었다. 이 공정이 가역적이라고 할때 계에 공급된 일의 양은 얼마인가?
- 100J
- 500J
- 1000J
- 2000J
6. 다음 중 상태함수(State function)가 아닌 것은?
- 내부에너지
- 엔트로피
- 자유에너지
- 일
7. 알코올 수용액의 증기와 평형을 이루고 있는 시스템(system)의 자유도는?
- 0
- 1
- 2
- 3
8. 깁스-두헴(Gibbs-Duhem)의 식에 대한 올바른 표현은? (단, M: 몰당 용액의 성질, 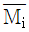 : 용액내 i성분의 부분몰 성질, xi: 몰분율)
: 용액내 i성분의 부분몰 성질, xi: 몰분율)
9. 반응 평형에 대한 설명 중 옳지 않은 것은?
- 평형상수의 계산을 위해서는 각 물질의 생성 깁스 에너지를 알아야 한다.
- 평형상수의 온도 의존성을 위해서는 각 물질의 생성 엔탈피와 열용량을 알아야 한다.
- 평형상수를 이용하면 반응의 속도를 정확히 알 수 있다.
- 평형상수를 이용하면 반응 후 최종 조성을 정확히 알 수 있다.
10. 비리얼 계수에 대한 다음 설명 중 옳은 것을 모두 나열한 것은?
- A
- B
- A, B
- 모두 틀림
11. 다음은 이상기체일 때 퓨개시티(Fugacity) fi를 표시한 함수들이다. 틀린 것은? (단, 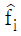 : 용액 중 성분 i 의 퓨개시티, fi: 순수성분 i 의 퓨개시티, xi: 용액의 몰분율, P : 압력)
: 용액 중 성분 i 의 퓨개시티, fi: 순수성분 i 의 퓨개시티, xi: 용액의 몰분율, P : 압력)
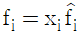
- fi=cP(c=상수)_
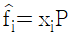
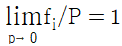
12. 혼합물 중 성분 i 의 화학포텐셜 μi에 관한 식으로 옳은 것은? (단, G 는 깁스 자유에너지, ni는 성분 i 의 몰수, nj는 i 번째 성분 이외의 몰수를 나타낸다.)
13. 이상기체의 단열과정에서 온도와 압력에 관계된 식이다. 옳게 나타낸 것은? (단, 열용량비 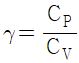 이다.)
이다.)
14. 활동도계수(Activity coefficient)를 구할 수 있는 식이 아닌 것은?
- 윌슨(Wilson)식
- 반 라르(Van Laar)식
- 레드리히-키스터(Redlich-Kister)식
- 베네딕트-웹-루빈(Benedict-Webb-Rubin)식
15. 기체상의 부피를 구하는데 사용되는 식과 가장 거리가 먼 것은?
- 반데르 발스 방정식(Van der Waals Equation)
- 래킷 방정식(Rackett Equation)
- 펭-로빈슨 방정식(Peng-Robinson Equation)
- 베네딕트-웹-루빈 방정식(Benedict-Webb-Rubin Equation)
16. 326.84℃ 와 26.84℃ 사이에서 작동하는 가역 열기관의 열효율은?
- 0.7
- 0.5
- 0.3
- 0.1
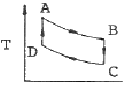
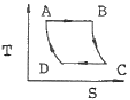
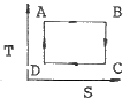
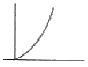
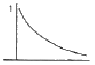
17. 카르노사이클(Carnot cycle)의 T-S선도는?
18. 다음의 액상에서의 과잉에너지 함수를 나타낸 것 중 국부조성 모델이 아닌 것은?
- 반 라르(Van Laar)모델
- 윌슨(Wilson)모델
- NRTL모델
- UNIQUAC모델
19. 고립계의 평형 조건을 나타내는 식으로 옳은 것은? (단, G : 깁스에너지, N : 몰수, H : 엔탈피, S : 엔트로피, U : 내부에너지, V : 부피)
20. PVn=상수 인 폴리트로픽 변화(Polytropic change)에서 정용과정인 변화는? (단, n 은 정수이고, 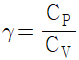 이다.)
이다.)
- n = 0
- n = ±∞
- n = 1
- n = γ
2과목: 단위조작 및 화학공업양론
21. NaCl 10%, KCl 3%, H2O 87% 의 수용액 18400kg 을 증발기(evaporator)에서 농축하여 NaCl 결정만이 석출되고 NaCl 16.8%, KCl 21.6%, H2O 61.6%의 농축액을 얻었다면 석출된 NaCl의 양은 얼마인가?
- 4700kg
- 1840kg
- 1411kg
- 1250kg
22. 표준상태에서 측정한 프로판가스 100m3 을 액화하였다. 액체 프로판은 몇 kg 인가?
- 196.43
- 296.43
- 396.43
- 469.43
23. 개천의 유량을 측정하기 위하여 dilution method를 사용하였다. 처음 개천물을 분석하였더니 Na2SO4의 농도가 180 ppm 이었다. 1시간에 걸쳐 Na2SO4 10kg 을 혼합한 후 하류에서 Na2SO4를 측정하였더니 3300ppm 이었다. 이 개천물의 유량은 약 몇 kg/h 인가?
- 3195
- 3250
- 3345
- 3395
24. 어떤 여름날의 일기가 낮의 온도 32℃, 상대습도 80% 대기압 738mmHg 에서 밤의 온도 20℃, 대기압 745mmHg 로 수분이 포화되어 있다. 낮의 수분 몇 % 가 밤의 이슬로 변하였는가? (단, 32℃ 와 20℃ 에서 포화수증기압은 각각 36mmHg 17.5mmHg 이다.)
- 39.3%
- 40.7%
- 51.5%
- 60.7%
25. 터빈을 운전하기 위해 2kg/s의 증기가 5atm, 300℃에서 50m/s로 터빈에 들어가고 300m/s 속도로 대기에 방출된다. 이 과정에서 터빈은 400kw의 축일을 하고 100KJ/s 열을 방출하였다면, 엔탈피 변화는 얼마인가? (단, work:외부에 일할시 +, heat:방출시 -)
- 212.5kw
- -387.5kw
- 412.5kw
- -587.5kw
26. 표준상태에서 56m3 의 용적을 가진 프로판 기체를 완전히 액화하였을 때 얻을 수 있는 액체 프로판은 몇 kg 인가?
- 28.6
- 110
- 125
- 246
27. 이상기체법칙이 적용된다고 가정할 때 용적이 5.5m3 인 용기에 질소 28kg 을 넣고 가열하여 압력이 10atm 이 될 때 도달하는 기체의 온도(℃)는?
- 81.51
- 176.31
- 287.31
- 397.31
28. 25℃에서 벤젠이 bomb 열량계 속에서 연소되어 이산화탄소와 물이 될 때 방출된 열량을 실험으로 재어보니 벤젠 1mol 당 780890cal 이었다. 25℃에서의 벤젠의 표준연소열은 약 몇 cal 인가? (단, 반응식은 다음과 같으며 이상기체로 가정한다.)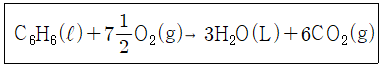
- -781778
- -781588
- -781201
- -780003
29. 열화학반응식을 이용하여 클로로포름의 생성열을 계산하면 약 얼마인가?
- 28108cal
- -28108cal
- 24003cal
- -24003cal
30. 이상기체 상수 R 의 단위를 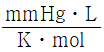 로 하였을 때 다음 중 R 값에 가장 가까운 것은?
로 하였을 때 다음 중 R 값에 가장 가까운 것은?
- 1.98
- 62.32
- 82
- 108
31. 두께 45cm 의 벽돌로 된 평판노벽을 두께 8.5cm 석면으로 보온하였다. 내면온도와 외면 온도가 각각 1000℃와 40℃ 일 때 벽돌과 석면사이의 계면온도는 몇 ℃가 되는가? (단, 벽돌노벽과 석면의 열전도도는 각각 3.0kcal/mㆍhㆍ℃, 0.1kcal/mㆍhㆍ℃이다.)
- 296℃
- 632℃
- 856℃
- 904℃
32. 뉴톤 유체가 관속을 흐를 때 관 중심으로부터 거리 r 만큼 떨어진 점에서 전단응력 τ는?
- r 에 비례한다.
- r 에 반비례한다.
- r2에 비례한다.
- r2에 반비례한다.
33. 고체내부의 수분이 건조되는 단계로 재료의 건조 특성이 단적으로 표시되는 기간은?
- 재료 예열기간
- 감율 건조기간
- 항율 건조기간
- 항율건조 제2기간
34. 안지름이 5cm인 관에서 레이놀즈(Reynolds) 수가 1500 일 때, 관 입구로부터 최종 속도분포가 완성되기까지의 전이길이(transition length)는 약 몇 m 인가?
- 2.75
- 3.75
- 5.75
- 6.75
35. 비중 0.9 인 액체의 절대압력이 3.6kgf/cm2 일 때 두(Head)로 환산하면 약 몇 m 에 해당하는가?
- 3.24
- 4
- 25
- 40
36. 흑체의 복사능은 절대온도의 4 승에 비례 한다는 법칙은 누구의 법칙인가?
- 키르히호프(Kirchhoff)
- 패러데이(Faraday)
- 스테판-볼츠만(Stefan-Boltzmann)
- 빈(Wien)
37. 액-액 추출에서 plait point(상계점)에 대한 설명 중 틀린 것은?
- 임계점(critical point)라고도 한다.
- 추출상과 추잔상에서 추질의 농도가 같아지는 점이다.
- tie line 의 길이는 0 이 된다.
- 이 점을 경계로 추제성분이 많은 쪽이 추잔상이다.
38. 공급원료 1몰을 원료 공급단에 넣었을 때 그 중 증류탑의 탈거부(stripping section)로 내려가는 액체의 몰수를 q 로 정의한다면, 공급원료가 과열증기일 때 q 값은?
- q < 0
- 0 < q < 1
- q = 0
- q = 1
39. "분쇄에 필요한 일은 분쇄전후의 대표 입경의 비(Dp1/Dp2)에 관계되며 이 비가 일정하면 일의 양도 일정하다." 는 법칙은 무엇인가?
- Sherwood 법칙
- Rittinger 법칙
- Bond 법칙
- Kick 법칙
40. 40mol% 벤젠-톨루엔 혼합물을 증류하여 탑정에서 98mol% 벤젠을 얻었다. 공급액은 비 점에서 공급하며 벤젠 액조성 40mol% 일 때 기액평형상태의 증기조성은 68mol% 이다. 이때 최소환류비는 얼마인가?
- 0.76
- 0.92
- 1.07
- 1.21
3과목: 공정제어
41. 제어동작에 대한 다음 설명 중 틀린 것은?
- 단순한 비례동작제어는 오프셋을 일으킬 수 있다.
- 비례적분동작제어는 오프셋을 일으키지 않는다.
- 비례미분동작제어는 공정 출력을 set point에 유지시키면서 장시간에 걸쳐 계를 정상상태로 이끌어간다.
- 비례적분미분동작제어는 PD동작제어와 PI 동작 제어의 장점을 복합한 것이다.
42. 다음 중 cascade 제어에 관한 설명으로 옳은 것은?
- 직접 측정되지 않는 외란에 대한 대처에 효과적일 수 없다.
- Slave 루프는 master 루프에 비해 느린 동특성을 가져야 한다.
- 외란이 master 루프에 영향을 주기 전에 slave 루프가 외란을 미리 제거할 수 있다.
- Slave 루프를 재튜닝해도 master 루프를 재튜닝할 필요는 없다.
43. 열전대(Thermocouple)와 관계있는 효과는?
- Thomson - Peltier 효과
- Piezo - electric 효과
- Joule - Thomson 효과
- Van der waals 효과
44. 다음의 block diagram으로 나타낸 제어계가 안정하기 위한 최대 조건(upper bound)은?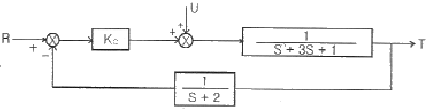
- Kc < 13.7
- Kc < 14.6
- Kc < 10.4
- Kc < 16.5
45. 주파수 응답을 이용한 3차계의 안정성을 판정하기 위한 이득 여유에 관한 설명으로 옳은 것은?
- 계가 안정하기 위해서는 Bode 선도 중 위상각이 -180도일 때의 진폭비가 1 보다 작아야 하므로 이득 여유는 1 에서 이 때의 진폭비를 뺀 값이 된다.
- 계가 안정하기 위해서는 Bode 선도 중 위상각이 -180도일 때의 진폭비가 1 보다 작아야 하지만 로그좌표를 사용하므로 이득 여유는 이 때의 진폭비의 역수가 된다.
- 계가 안정하기 위해서는 Bode 선도 중 위상각이 -180도일 때의 진폭비가 1 보다 커야 하므로 이득 여유는 이 때의 진폭비에서 1 을 뺀 값이 된다.
- 계가 안정하기 위해서는 Bode 선도 중 위상각이 -180도일 때의 진폭비가 1 보다 커야 하지만 로그좌표를 사용하므로 이득 여유는 이때의 진폭비가 된다.
46. 다음 라플라스 함수 중 최종값 정리를 적용할 수 없는 것은?
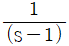
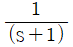
- e-3s
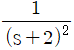
47. 다음 그림의 블록선도에서 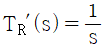 일 때, 서보(servo) 문제의 정상상태 잔류편차(offset)는 얼마인가?
일 때, 서보(servo) 문제의 정상상태 잔류편차(offset)는 얼마인가?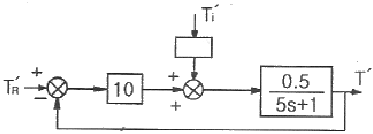
- 0.133
- 0.167
- 0.189
- 0.213
48. 공정의 전달함수가 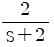 이다. 이 계에
이다. 이 계에 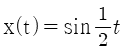 의 입력이 주어졌을 때, 위상지연(phase lag)은?
의 입력이 주어졌을 때, 위상지연(phase lag)은?
- 12.05˚
- 14.04˚
- 15.03˚
- 17.02˚
49. 어떤 반응기에 원료가 정상상태에서 100L/min 의 유속으로 공급될 때 제어밸브의 최대유량을 정상상태 유량의 4배로 하고 I/P 변환기를 설정하였다면 정상상태에서 변환기에 공급된 표준 전류신호는 몇 mA 인가? (단, 제어밸브는 선형특성을 가진다.)
- 4
- 8
- 12
- 16
50. 탑상에서 고순도 제품을 생산하는 증류탑의 탑상 흐름의 조성을 온도로부터 추론(inferential) 제어하고자 한다. 이때 맨 위 단보다 몇 단 아래의 온도를 측정하는 경우가 있는 데 다음 중 그 이유로 가장 타당한 것은?
- 응축기의 영향으로 맨 위 단에서는 다른 단에 비하여 응축이 많이 일어나기 때문에
- 제품의 조성에 변화가 일어나도 맨 위 단의 온도 변화는 다른 단에 비하여 매우 작기 때문에
- 맨 위 단은 다른 단에 비하여 공정 유체가 넘치거나(flooding) 방울져 떨어지기(weeping) 때문에
- 운전 조건의 변화 등에 의하여 맨 위 단은 다른 단에 비하여 온도는 변동(fluctuation)이 심하기 때문에
51. Laplace 변환된 형태가  와 같은 경우, 역 Laplace 변환을 구하면?
와 같은 경우, 역 Laplace 변환을 구하면?
52. 그림과 같은 계의 총괄 전달함수는?
53. 다음 중 과소감쇠진동공정(underdamped process)의 전달함수를 나타낸 것은?
54. 제어기 설계를 위한 공정모델과 관련된 설명으로 틀린 것은?
- PID 제어기를 Ziegler-Nichols 방법으로 조율하기 위해서는 먼저 공정의 전달함수를 구하는 과정이 필수로 요구된다.
- 제어기 설계에 필요한 모델은 수지식으로 표현되는 물리적 원리를 이용하여 수립될 수 있다.
- 제어기 설계에 필요한 모델은 공정의 입출력 신호만을 분석하여 경험적 형태로 수립될 수 있다.
- 제어기 설계에 필요한 모델은 물리적 모델과 경험적 모델을 혼합한 형태로 수립될 수 있다.
55. 앞먹임 제어(feedforward control)의 특징으로 옳은 것은?
- 공정모델값과 측정값과의 차이를 제어에 이용
- 외부교란변수를 사전에 측정하여 제어에 이용
- 설정점(set point)을 모델값과 비교하여 제어에 이용
- 공정의 이득(gain)을 제어에 이용
56. 어떤 함수의 Laplace transform 은  이다. 이 함수를 나타내는 그래프는?
이다. 이 함수를 나타내는 그래프는?
57. 동적계(Dynamic System)를 전달함수로서 표현하는 경우를 옳게 설명한 것은?
- 선형계의 동특성을 전달함수로 표현할 수 없다.
- 비선형계를 선형화하고 전달함수로 표현하면, 비선형 동특성을 근사할 수 있다.
- 비선형계를 선형화하고 전달함수로 표현하면, 비선형 동특성을 정확히 표현할 수 있다.
- 비선형계의 동특성을 전달함수로 표현할 수 있다.
58. 다음 중 공정제어의 목적과 가장 거리가 먼 것은?
- 반응기의 온도를 최대 제한값 가까이에서 운전함으로 반응속도를 올려 수익을 높인다.
- 평형반응에서 최대의 수율이 되도록 반응 온도를 조절한다.
- 안전을 고려하여 일정 압력이상이 되지 않도록 반응속도를 조절한다.
- 외부 시장 환경을 고려하여 이윤이 최대가 되도록 생산량을 조정한다.
59. 다음 그림과 같은 제어계의 전달함수 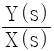 는?
는?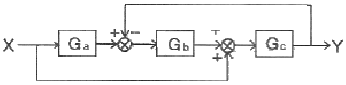
60. 2차계에 대한 단위계단응답은 다음과 같다. 임계감쇠(critical damping)인 경우 응답곡선 Y(t)는? (단, 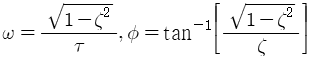 이다.)
이다.)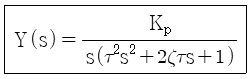
4과목: 공업화학
61. 염화수소 가스를 제조하기 위해 고온, 고압에서 H2와 Cl2를 연소시키고자 한다. 다음중 폭발 방지를 위한 운전조건으로 가장 적합한 H2:Cl2의 비율은?
- 1.2 : 1
- 1 : 1
- 1 : 1.2
- 1 : 1.4
62. 염산을 르블랑(LeBlanc)법으로 제조하기 위하여 소금을 원료로 사용한다. 100% HCl 3000kg 을 제조하기 위한 85% 소금의 이론량은 약 얼마인가? (단, NaCl M.W = 58.5, HCl M.W = 36.5 이다.)
- 3636kg
- 4646kg
- 5657kg
- 6667kg
63. CuO 존재하에 염화벤젠에 NH3를 첨가하고 가압하면 생성되는 주요 물질은?
64. 휘발유의 안티-녹킹(anti-knocking)성의 정도를 표시하는 값은?
- 산가
- 세탄가
- 옥탄가
- API도
65. 다음 중 Nylon 6 제조의 주된 원료로 사용되는 것은?
- 카프로락탐
- 세바크산
- 아디프산
- 헥사메틸렌디아민
66. 석유 유분에서 접촉분해와 비교한 열분해반응의 특징이 아닌 것은?
- 코크스나 타르의 석출이 많다.
- 디올레핀이 비교적 많이 생성된다.
- 방향족 탄화수소가 적다.
- 분자 지방족 중 특히 C3~C6의 탄화수소가 많다.
67. 인광석에 인산을 작용시켜 수용성 인산분이 높은 인산비료를 얻을 수 있는데 이에 해당하는 것은?
- 토마스인비
- 침강 인산석회
- 소성인비
- 중과린산석회
68. 공업용수 중 칼슘이온의 농도가 20mg/L 이었다면, 이는 몇 ppm 경도에 해당하는가?
- 20
- 30
- 40
- 50
69. 다음 중 암모니아 산화반응시 촉매로 주로 쓰이는 것은?
- Nd - Mo
- Ra
- Pt - Rh
- Al2O3
70. 다음 중 천연 고무와 가장 관계가 깊은 것은?
- Propane
- Ethylene
- Isoprene
- Isobutene
71. 소다회 제법에서 solvay 공정의 주요 반응이 아닌 것은?
- 정제반응
- 암모니아 함수의 탄산화반응
- 암모니아 회수반응
- 가압 흡수반응
72. 솔베이법의 기본공정에서 사용되는 물질로 가장 거리가 먼 것은?
- CaCO3
- NH3
- HNO3
- NaCl
73. 염화물의 에스테르화 반응에서 Schotten -Baumann(쇼텐-바우만)법에 해당하는 것은?
74. 발색단만을 가지고 있는 화합물에 도입하면 색을 짙게 하는 동시에 섬유에 대하여 염착하기 쉽게 하는 원자단은?
- -OH
- -N=N-
- -N=O
75. 테레프탈산을 공업적으로 제조하는 방법에 해당하는 것은?
- o - 크실렌의 산화
- p - 크실렌의 산화
- 톨루엔의 산화
- 나프탈렌의 산화
76. 고분자의 분자량을 측정하는데 사용되는 방법으로 가장 거리가 먼 것은?
- 말단기정량법
- 삼투압법
- 광산란법
- 코킹법
77. 석유화학 공정에 대한 설명 중 틀린 것은?
- 비스브레이킹 공정은 열분해법의 일종이다.
- 열분해란 고온하에서 탄화수소 분자를 분해하는 방법이다.
- 접촉분해공정은 촉매를 이용하지 않고 탄화수소의 구조를 바꾸어 옥탄가를 높이는 공정이다.
- 크래킹은 비점이 높고 분자량이 큰 탄화수소를 분자량이 작은 저비점의 탄화수소로 전환하는 것이다.
78. 고분자의 사슬성장 중합은 벌크중합, 용액중합 등에 의해 이루어지는데, 이 중 용액중합에 대한 설명으로 가장 거리가 먼 것은?
- 반응속도가 빠르고 분자량이 크다.
- 용매의 회수 및 제거가 필요하다.
- 반응열 조절이 용이하다.
- 이온중합에 사용될 수 있다.
79. 다음 고분자 중 Tg(glass transition temperature)가 가장 높은 것은?
- Polycarbonate
- Polystyrene
- Poly vinyl chloride
- Polyisoprene
80. 연료전지에 있어서 캐소드에 공급되는 물질은?
- 산소
- 수소
- 탄화수소
- 일산화탄소
5과목: 반응공학
81. 다음과 같은 연속(직렬) 반응에서 A 와 R의 반응속도가 -rA=k1CA, rR=k1CA-k2일 때 회분식 반응기에서 CR/CA0를 구하면? (단, 반응은 순수한 A 만으로 시작한다.)
82. 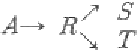 의 1차 반응에서 A → R 의 반응속도상수를 k1, R → S 의 반응속도상수를 k2, R → T 의 반응속도상수를 k3라 할때 k1=10e-3500/T, k2=1012e-10500/T, k3=108e-7000/T이고, 이 반응의 조작 가능 온도는 7~77℃ 이며 A 의 공급 농도는 1mol/L 이다. 이 때 목적 생산물이 S 라면 조작온도는?
의 1차 반응에서 A → R 의 반응속도상수를 k1, R → S 의 반응속도상수를 k2, R → T 의 반응속도상수를 k3라 할때 k1=10e-3500/T, k2=1012e-10500/T, k3=108e-7000/T이고, 이 반응의 조작 가능 온도는 7~77℃ 이며 A 의 공급 농도는 1mol/L 이다. 이 때 목적 생산물이 S 라면 조작온도는?
- 7℃
- 42℃
- 63℃
- 77℃
83. 부피가 일정한 회분식반응기에서 CH3CHO 증기를 518℃ 에서 열분해 결과, 반감기는 처음 압력이 363mmHg 일 때 410s이고, 169mmHg 일 때 880s 이었다. 이 반응의 차수는?
- 0차 반응
- 1차 반응
- 2차 반응
- 3차 반응
84. R 이 목적생산물인 반응 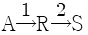 에서 각 경로에서의 활성화에너지가 E1<E2인 경우의 반응에 대한 설명으로 옳은 것은?
에서 각 경로에서의 활성화에너지가 E1<E2인 경우의 반응에 대한 설명으로 옳은 것은?
- 공간시간(τ)이 상관없다면 가능한 한 최저온도에서 반응시킨다.
- 등온 반응에서 공간시간(τ) 값이 주어지면 가능한 한 최고 온도에서 반응시킨다.
- 온도 변화가 가능하다면 초기에는 낮은 온도에서, 반응이 진행됨에 따라 높은 온도에서 반응시킨다.
- 온도 변화가 가능하더라도 등온 조작이 가장 유리하다.
85. 다음의 반응에서 R 의 수율은 반응기의 온도조건에 따라 달라진다. R 의 수율을 높이기 위해서 반응기의 온도를 시간이 지남에 따라 처음에는 낮은 온도로부터 높은 온도까지 변화시켜야 했다. 다음 사항 중 각 경로에서 활성화 에너지(E) 관계로 옳은 것은?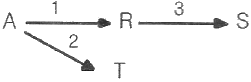
- E1>E2, E1>E3
- E1>E2, E1<E3
- E1<E2, E1<E3
- E1<E2, E1>E3
86. 직렬로 연결된 2개의 혼합 흐름 반응기에서 액상 1차 반응이 일어날 때 주어진 전화율에 대하여 두 반응기의 체적이 최소가 되도록 하는 두 반응기의 체적비는?
- 1:1
- 1:2
- 1:3
- 1:4
87. 액상에서 운전되는 회분식반응기에서 시간에 따른 농도변화를 측정하여 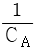 와 t 를 도시(plot)하였을 때 직선이 되는 반응은?
와 t 를 도시(plot)하였을 때 직선이 되는 반응은?
- 0 차반응
- 1/2 차반응
- 1 차반응
- 2 차 반응
88. NO2의 분해반응은 1차 반응이고 속도상수는 694℃ 에서 0.138s-1, 812℃ 에서는 0.37s-1이다. 이 반응의 활성화 에너지는 약 몇 kcal/mol 인가?
- 17.42
- 27.42
- 37.42
- 47.42
89. 비가역 1차 액상반응 A → R 이 플러그흐름 반응기에서 전화율이 50% 로 반응된다. 동일조건에서 반응기의 크기만 2배로 하면 전화율은 몇 % 가 되는가?
- 67
- 70
- 75
- 100
90. 다음 중 일반적으로 볼 때 불균일 촉매반응으로 가장 적합한 것은?
- 대부분의 액상 반응
- 콜로이드계의 반응
- 효소반응과 미생물반응
- 암모니아 합성반응
91. 공간시간(space time)에 대한 설명으로 옳은 것은?
- 한 반응기 부피만큼의 반응물을 처리하는 데 필요한 시간을 말한다.
- 반응물이 단위부피의 반응기를 통과하는데 필요한 시간을 말한다.
- 단위시간에 처리할 수 있는 원료의 몰수를 말한다.
- 단위시간에 처리할 수 있는 원료의 반응기 부피의 배수를 말한다.
92. A → B 의 화학반응에서 생성되는 물질의 화학반응속도식 rB와 소실되는 반응물질의 화학반응속도식 -rA를 옳게 나타낸 것은?
93. 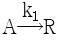 및
및 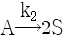 인 두 액상 반응이 동시에 등온 회분반응기에서 진행된다. 50분 후 A 의 90% 가 분해되어 생성물 비는 9.1mol R/1mol S 이다. 반응차수는 각각 1차일 때, 반응속도상수 k2는 몇 min-1인가?
인 두 액상 반응이 동시에 등온 회분반응기에서 진행된다. 50분 후 A 의 90% 가 분해되어 생성물 비는 9.1mol R/1mol S 이다. 반응차수는 각각 1차일 때, 반응속도상수 k2는 몇 min-1인가?
- 2.4×10-6
- 2.4×10-5
- 2.4×10-4
- 2.4×10-3
94. 이상기체 반응물 A 가 1L/s 속도로 체적 1L 의 혼합 흐름 반응기에 공급되어 50% 가 반응된다. 반응식이 A → 3R 일 때 일정한 온도와 압력하에서 반응물 A의 평균 체류시간(mean residence time)은 몇 초 인가?
- 0.5
- 1.0
- 1.5
- 2.0
95. A + B → R 인 2차 반응에서 CA0와 CB0의 값이 서로 다를 때 반응속도상수 k 를 얻기 위한 방법은?
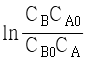 와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다.
와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다.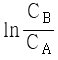 와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다.
와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다.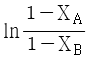 와 t 를 도시(plot)하여 절편이
와 t 를 도시(plot)하여 절편이 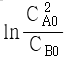 인 직선을 얻는다.
인 직선을 얻는다.- 기울기가 1+(CA0-CB0)2K인 직선을 얻는다.
96. A → R 의 반응에서 0℃ 와 100℃ 사이에서 반응이 진행되는데 두 온도사이에서 A 와 R 의 비열이 같고 반응엔탈피 △Hr298=-18,000cal이였다면 △Hr373은 얼마인가?
- -3.375cal
- -18,000cal
- +3.375cal
- +18,000cal
97. 100℃, 1atm 에서 2A → R+S 을 반응시키는데 20% 의 비활성 물질을 포함하는 원료를 회분식 반응기에서 처리 할 경우, 반응물 A 는 95% 가 전환되고 이 때 소요된 시간이 5분 10초 이다. 만일 동일조성의 반응물을 100mol/h 의 속도로 플러그 흐름 반응기로 처리하여 95% 전환시키고자 할 경우 필요한 반응기 크기는 몇 L 이겠는가? (단, 이 반응은 기상반응이며 이상기체라고 가정한다.)
- 235
- 329
- 540
- 660
98. 회분반응기(batch reactor)의 일반적인 특성에 대한 설명으로 가장 거리가 먼 것은?
- 일반적으로 소량 생산에 적합하다.
- 단위 생산량당 인건비와 취급비가 적게 드는 장점이 있다.
- 연속조작이 용이하지 않은 공정에 사용된다.
- 하나의 장치에서 여러 종류의 제품을 생산하는데 적합하다.
99. 어떤 반응의 속도상수가 25℃ 에서는 3.46×10-5s-1이고, 65℃ 에서는 4.87×10-3s-1이다. 이 반응의 활성화 에너지는 약 몇 kcal 인가?
- 14.8
- 24.8
- 34.8
- 44.8
100. 20℃ 와 30℃에서 어떤 반응의 평형상수 K 는 각각 2×10-3, 1×10-2이다. 이 반응의 반응열 △Hr 값은 약 몇 kcal/mol 인가?
- 12.2
- 24.3
- 28.4
- 56.4






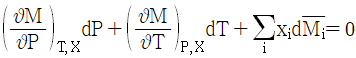
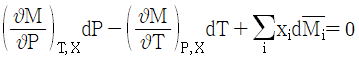
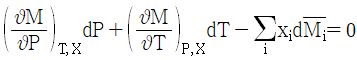
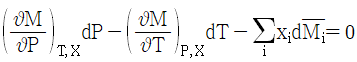
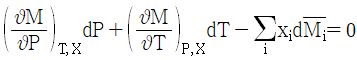 "
" = x1
= x1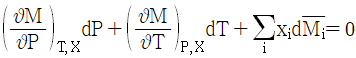 + x2
+ x2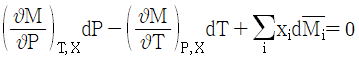 + ... + xn
+ ... + xn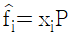 "
"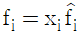 "와 "
"와 "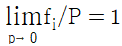 "와 같은 식을 사용해야 한다.
"와 같은 식을 사용해야 한다.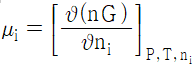
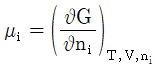
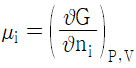
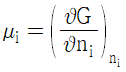
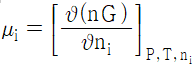 " 이다.
" 이다.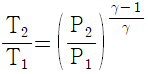
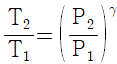
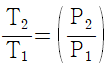
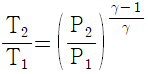 "
"

 "가 정답이다.
"가 정답이다.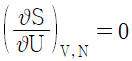
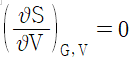


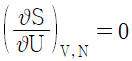 "이다. 이 식은 고립계의 에너지 보존 법칙과 엔트로피 증가 법칙을 나타낸 것이다. 고립계에서는 에너지가 보존되므로 내부에너지와 깁스에너지의 합은 일정하다. 또한, 엔트로피는 항상 증가하므로 엔트로피의 변화량은 항상 양수이다. 이를 종합하면 위의 식이 나오게 된다.
"이다. 이 식은 고립계의 에너지 보존 법칙과 엔트로피 증가 법칙을 나타낸 것이다. 고립계에서는 에너지가 보존되므로 내부에너지와 깁스에너지의 합은 일정하다. 또한, 엔트로피는 항상 증가하므로 엔트로피의 변화량은 항상 양수이다. 이를 종합하면 위의 식이 나오게 된다.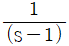 "이다.
"이다. 

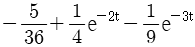
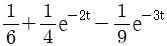
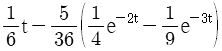
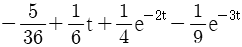
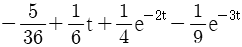 이 된다. 이유는 분모의 두 항이 각각
이 된다. 이유는 분모의 두 항이 각각 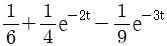 ,
, 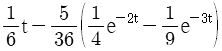 이므로, 각각의 역 Laplace 변환을 구하면
이므로, 각각의 역 Laplace 변환을 구하면 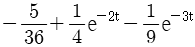 ,
, 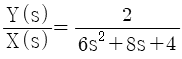
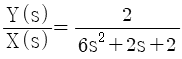
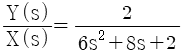
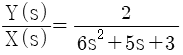
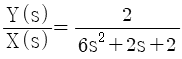 "이다.
"이다.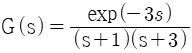
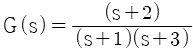
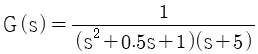
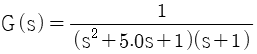
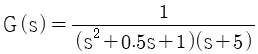 "가 과소감쇠진동공정의 전달함수를 나타내는 것입니다.
"가 과소감쇠진동공정의 전달함수를 나타내는 것입니다.
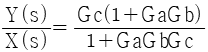
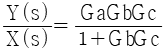
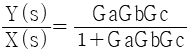
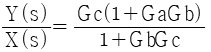
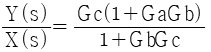 " 이다.
" 이다.
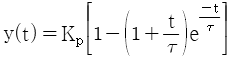
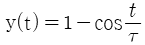
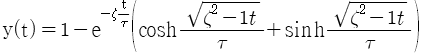
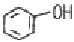

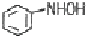

 "입니다.
"입니다.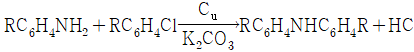
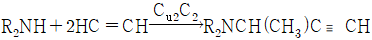
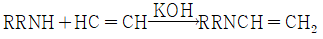

 "가 Schotten-Baumann법에 해당한다.
"가 Schotten-Baumann법에 해당한다.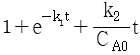
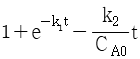
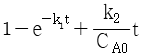

 " 이다.
" 이다.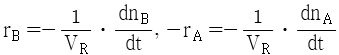
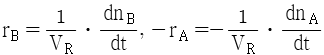
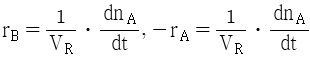
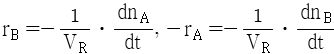
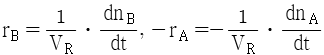 "이다.
"이다.
열량과 효율을 이용하여 버려야할 최소 열량을 구할 수 있다. Carnot 냉동기가 흡수한 열량은 10,000kcal/h이므로, 고열원에서 방출할 수 있는 최대 열량은 10,000kcal/h / 0.375 = 26,667kcal/h이다.
따라서 버려야할 최소 열량은 26,667kcal/h - 10,000kcal/h = 16,667kcal/h이다. 이 중에서 가장 가까운 값은 10,932kcal/h이므로 정답은 "10,932kcal/h"이다.