1과목: 화공열역학
1. 이성분 혼합물에 대한 깁스 두헴(Gibbs-Duhem)식에 속하지 않는 것은? (단, 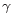 는 활성도계수(activity coefficient), μ는 화학퍼텐셜, x는 몰분율)
는 활성도계수(activity coefficient), μ는 화학퍼텐셜, x는 몰분율)
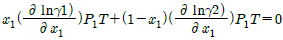
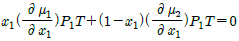
- x1dμ1+x2dμ2=0(const, T, P)
- μ1dx1+μdx2=0(const, T, P)
2. i 성분의 부분 몰 성질 i (partial molar property 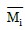 )을 옳게 나타낸 것은? (단, M ; 열역학적 용량변수의 단위 몰당의 값(예 : U, H, S, G 등을 표시함, ni ; i성분의 몰 수, nj : i 번째 성분 이외의 모든 몰수를 일정하게 유지한다는 것을 의미한다.)
)을 옳게 나타낸 것은? (단, M ; 열역학적 용량변수의 단위 몰당의 값(예 : U, H, S, G 등을 표시함, ni ; i성분의 몰 수, nj : i 번째 성분 이외의 모든 몰수를 일정하게 유지한다는 것을 의미한다.)
3. 기상 반응계에서 평형상수가 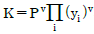 로 표시될 경우는? (단, vi는 성분 i의 양수론,
로 표시될 경우는? (단, vi는 성분 i의 양수론, 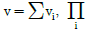 는 모든 화학종 i의 곱을 나타낸다.)
는 모든 화학종 i의 곱을 나타낸다.)
- 평형 혼합물이 이상기체와 같은 거동을 할 때
- 평형 혼합물이 이상용액과 같은 거동을 할 때
- 반응에 따른 몰수 변화가 없을 때
- 반응열이 온도에 관계없이 일정할 때
4. 열역학의 기초 사항에 대한 설명으로 가장 적절한 것은?
- 이상기체의 엔탈피는 온도만의 함수이다.
- 1기압에서 결정 상태에 있는 물질의 엔트로피는 0℃에서 0이다.
- 가역과정에서 계가 하는 일은 상태함수이다.
- 제2종 영구기관은 불가능하지만 제1종 영구기관은 가능하다.
5. 평형(equilibrium)의 정의와 가장 거리가 먼 것은?
- △GTP=0
- 시간에 따른 열역학적 특성 변화가 없는 상태
- 정반응 속도와 역반응의 속도가 같다.
- ΔVmix=0
6. 일정한 T, P에 있는 닫힌계가 평형상태에 도달하는 조건에 해당하는 것은?
- (dGt)T, P = 0
- (dGt)T, P > 0
- (dGt)T, P < 0
- (dGt)T, P = 1
7. 액화공정에 대한 설명으로 틀린 것은?
- 일정 압력 하에서 열교환에 의해 기체는 액화될 수 있다..
- 등엔탈피 팽창을 하는 조름공정(throttling process)에 의하여 기체를 액화시킬 수 있다.
- 기체는 터빈에서 등엔트로피 압축에 의하여 액화된다.
- 린데(Linde)공정과 클라우데(Claude)공정이 대표적인 액화 공정이다.
8. 실제기체가 이상기체에 가장 가까울 때의 조건은?
- 저압고온
- 저압저온
- 고압저온
- 고압고온
9. 증기 터빈(steam turbin)에서 가장 많은 동력을 얻을 수 있는 공정은?
- 등온공정
- 등엔탈피공정
- 등엔트로피공정
- 정압공정
10. 공비혼합물을 이루는 어느 이성분계혼합물이 있다. 일정한 온도에서 P-x 선도가 다음의 식으로 표시된다고 할 때 이 온도에서 이 혼합물의 공비점의 조성(X1)은?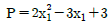
- 0.35
- 0.45
- 0.60
- 0.75
11. 실제 기체의 압력이 0에 접근할 때 잔류(residual) 특성에 대한 설명으로 옳은 것은? (단, 온도는 일정하다.)
- 잔류 엔탈피는 무한대에 접근하고 잔류 엔트로피는 0에 접근한다.
- 잔류 엔탈피와 잔류 엔트로피 모두 무한대에 접근한다.
- 잔류 엔탈피와 잔류 엔트로피 모두 0에 접근한다.
- 잔류 엔탈피는 0에 접근하고 잔류 엔트로피는 무한대에 접근한다.
12. 그림과 같은 압력-엔탈피 선도(lnP 대 H)에서 엔탈피 변화(H2-H1)는 무엇에 해당하는가?
- 승화열
- 혼합열
- 증발열
- 용해열
13. 다음 반응에서 초기 반응물의 농도가 각각 H2S 1mol, H2O 3mol의 비율로 주어진다. 이 화학반응이 평형에 도달할 경우 반응계의 자유도 수는?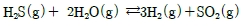
- 1
- 2
- 3
- 4
14. A, B 성분의 이상용액에서 혼합에 의한 함수변화 값으로 틀린 것은? (단, xA, xB는 액상의 몰분율을 나타낸다.)
- △G = RT(xAlnxA+xBlnxB)
- △V = 0
- △H = ∞
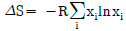
15. 25℃에서 정용열량계의 용기에서 벤젠을 태워 CO2와 액체인 물로 변화했을 때의 발열량이 780,090cal/mol이었다. 25℃에서의 표준연소열은? (단, 반응은 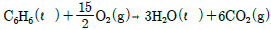 이며, 반응에 사용된 기체는 이상기체라 가정한다.)
이며, 반응에 사용된 기체는 이상기체라 가정한다.)
- 약 -780,980 cal
- 약 -783,090 cal
- 약 -786,011 cal
- 약 -779,498 cal
16. 그림과 같이 계가 일을 할 때 이 계의 효율을 옳게 나타낸 것은?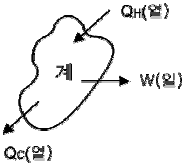
17. 20℃, 1atm에서 아세톤의 부피팽창계수 β는 1.487×10-3℃-1, 등온압축계수 K는 62×10-6atm-1이다. 아세톤을 정적 하에서 20℃, 1atm으로부터 30℃까지 가열하였을 때 압력은 약 몇 atm인가? (단, β와 K의 값은 항상 일정하다고 가정한다.)
- 12.1
- 24.1
- 121
- 241
18. 2성분 혼합물이 액체-액체 상평형을 이루고 있는 α상과 β상이 있을 때 액체-액체 상평형 계산에 사용되는 관계식에 해당하는 것은? (단, x1은 성분 1의 조성, 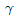 는 활동도계수,
는 활동도계수, 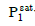 는 성분 1의 증기압, H1은 성분1의 헨리상수,
는 성분 1의 증기압, H1은 성분1의 헨리상수, 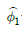 은 성분 1의 퓨개시티 계수이다.)
은 성분 1의 퓨개시티 계수이다.)
19. 비리얼(Virial))식으로부터 유도된 옳은 식은? (단, B = 제2비리얼계수, Z = 압축계수)
20. Carnot 순환으로 작동되는 어떤 가역 열기관이 500℃에서 1000cal의 열을 받아 일을 생산하고 나머지의 열을 100℃에서 배출한다. 가역 열기관이 하는 일은?
- 417cal
- 517cal
- 373cal
- 773cal
2과목: 단위조작 및 화학공업양론
21. 용해도에 영향을 미치는 조건에 대한 설명이 틀린 것은?
- 온도증가는 기체의 용해도를 감소시킨다.
- 온도증가는 고체, 액체의 용해도를 증가시킨다.
- 압력은 고체, 액체, 기체의 용해도에 크게 영향을 미친다.
- 분자구조에 따라서 극성은 극성을, 비극성은 비극성을 녹인다.
22. 벤젠과 톨루엔은 이상 용액에 가까운 용액을 만든다. 80℃에서 벤젠과 톨루엔의 증기압은 각각 743mmHg 및 280mmHg이다. 이 온도에서 벤젠의 몰분율이 0.2인 용액의 증기압은?
- 352.6 mmHg
- 362.6 mmHg
- 372.6 mmHg
- 38.26 mmHg
23. “고체나 액체의 열용량은 그 화합물을 구성하는 개개 원소의 열용량의 합과 같다.”는 누구의 법칙인가?
- Dulong Petit
- Kopp
- Trouton
- Hougen Watson
24. 그림과 같이 연결된 두 탱크가 있다. 처음 두 탱크 사이는 닫혀 있었으며, 이 때 탱크 1에는 600kPa, 70℃의 공기가 들어 있었고, 탱크 2에는 1200kPa, 100℃에서 O2 10%, N2 90%인 기체가 들어있었다. 밸브를 열어서 두 탱크의 기체가 완전히 섞이게 한 결과, N2 88% 이었다. 탱크 2의 부피는?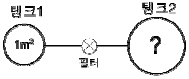
- 1.27m3
- 2.45m3
- 3.72m3
- 3.84m3
25. 수소 16wt%, 탄소 84wt%의 조성을 가진 연료유 100g을 다음 반응식과 같이 연소시킨다. 이때 연소에 필요한 이론 산소량은 몇 mol인가?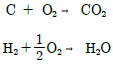
- 6
- 11
- 22
- 44
26. 에너지 소비율 7.1×1012W은 매년 몇 칼로리씩 소모되는 양인가?
- 2.2×1020cal/year
- 5.3×1019cal/year
- 3.2×1019cal/year
- 4.3×1020cal/year
27. 500mL 용액에 10g의 NaOH가 들어 있다. 이 물질의 N농도는?
- 2.0
- 1.0
- 0.5
- 0.25
28. 75℃, 1.5bar, 40% 상대습도를 갖는 습공기가 1000m3/h로 한 단위공정에 들어갈 때 이 습공기의 비교습도는 약 몇 %인가? (단, 75℃에서의 포화증기압은 289 mmHg이다.)
- 30%
- 33%
- 38.4%
- 40.0%
29. 다음과 같은 반응의 표준반응열은 몇 kcal/mol인가? (단,C2H5OH, CH3COOH, CH3COOC2H5의 표준연소열은 각각 -326700kcal/mol, -208340kcal/mol, -538750kcal/mol 이다.)(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)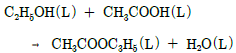
- -14240
- -3710
- 3710
- 14240
30. 어떤 기체의 임계압력이 2.9atm이고, 반응기내의 계기압력이 30psig 였다면 환산압력은?
- 0.727
- 1.049
- 0.99
- 1.112
31. 3층의 벽돌로 된 로벽이 있다. 내부로부터 각 벽돌의 두께는 각각 10, 8, 30cm이고 열전도도는 각각 0.10, 0.05, 1.5kcal/mㆍhㆍ℃이고 노벽의 내면 온도는 1000도이고 외면온도는 40℃일 때 단위 면적당의 열 손실은 약 얼마인가? (단, 벽돌 간의 접촉저항은 무시한다.)
- 343kcal/m2ㆍh
- 533kcal/m2ㆍh
- 694kcal/m2ㆍh
- 830kcal/m2ㆍh
32. 기본 단위에서 길이를 L, 질량을 M, 시간을 T로 시할 때 다음에서 차원이 틀린 것은?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- 힘 : MLT-2
- 압력 : ML-2T2
- 점도 : ML1T-1
- 일 : ML2T2
33. 기-액 평형의 원리를 이용하는 분리공정에 해당하는 것은?
- 증류(distillation)
- 액체추출(liquid extraction)
- 흡착(adsorption)
- 침출(leaching)
34. 초산과 물의 혼합액에 벤젠을 추제로 가하여 초산을 추출한다. 추출상의 wt%가 초산 3, 물 0.5, 벤젠 96.5이고 추잔상은 wt%가 초산 27, 물 70, 벤젠 3일 때 초산에 대한 벤젠의 선택도는 약 얼마인가?
- 8.95
- 15.6
- 72.5
- 241.5
35. 직선 원형관으로 유체가 흐를 때 유체의 레이놀즈수가 1500이고 이 관의 안지름이 50mm 일 때 전이길이가 3.75m이다. 동일한 조건에서 100mm의 안지름을 가지고 같은 레이놀즈수를 가진 유체 흐름에서의 전이 길이는 약 몇 m인가?
- 1.88
- 3.75
- 7.5
- 15
36. 흡수 충전탑에서 조작선(operating line)의 기울기를 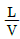 이라 할 때 틀린 것은?
이라 할 때 틀린 것은?
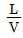 의 값이 커지면 탑의 높이는 짧아진다.
의 값이 커지면 탑의 높이는 짧아진다.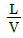 의 값이 작아지면 탑의 높이는 길어진다.
의 값이 작아지면 탑의 높이는 길어진다.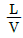 의 값은 흡수탑의 경제적인 운전과 관계가 있다.
의 값은 흡수탑의 경제적인 운전과 관계가 있다.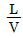 의 최소값은 흡수탑 하부에서 기액간의 농도차가 가장 클 때의 값이다.
의 최소값은 흡수탑 하부에서 기액간의 농도차가 가장 클 때의 값이다.
37. 퍼텐셜 흐름(potential flow)에 대한 설명이 아닌 것은?
- 이상유체(ideal fluid)의 흐름이다.
- 고체 벽에 인접한 유체층에서의 흐름이다.
- 비회전흐름(irrotational flow)이다.
- 마찰이 생기지 않은 흐름이다.
38. 무차원 항이 밀도와 관계없는 것은?
- 레이놀즈(Reynolds)수
- 너셀(Nusselt)수
- 슈미트(Schnudt)수
- 그라쇼프(Grashof)수
39. 3중 효용관의 첫 증발관에 들어가는 수증기의 온도는 110℃이고 맨 끝 효용관에서 용액의 비점은 53℃이다. 각 효용관의 총괄 열전달계수 (W/m2ㆍ ℃ )가 2500, 2000, 1000일 때 2효용관액의 끓는점은 약 몇℃인가? (단, 비점 상승이 매우 작은 액체를 농축하는 경우이다.)
- 73
- 83
- 93
- 103
40. HETP에 대한 설명으로 가장 거리가 먼 것은?
- “Height Equivalent to a Theoretical plate“를 말한다.
- HEPT의 값이 1m 보다 클 때 단의 효율이 좋다.
- (충전탑의 높이 : Z) / (이론 단위수 : N)이다.
- 탑의 한 이상단과 똑같은 작용을 하는 충전탑의 높이이다.
3과목: 공정제어
41. S3+4S2+2S+6=0 로 특정방정식이 주어지는 계의 Routh 판별을 수행할 때 다음 배열의 (a), (b)에 들어갈 숫자는?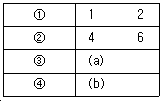
42. 근사적으로 다음 보우드(bode)선도와 같은 주파수 응답을 보이는 전달함수는? (단 AR은 진폭비, ω는 각 주파수이다.)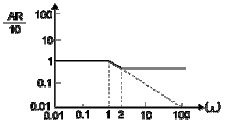
43. Anti Reset Windup에 관한 설명으로 가장 거리가 먼 것은?
- 제어기 출력이 공정 입력 한계에 걸렸을 때 작동한다.
- 적분 동작에 부과된다.
- 큰 서정치 변화에 공정 출력이 크게 흔들리는 것을 방지한다.
- Off set을 없애는 동작이다.
44. 어떤 공정의 동특성은 다음과 같은 미분방정식으로 표시된다. 이 공정을 표준형 2차계로 표현했을 때 시간상수(τ)는? (단, 입력변수와 출력변수 X, Y는 모두 편차변수(deviation variable) 이다.)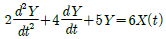
- 0.632
- 0.854
- 0.985
- 0.998
45. 사람이 차를 운전하는 경우 신호등을 보고 우회전하는 것을 공정 제어계와 비교해 볼 때 최종 조작변수에 해당된다고 볼 수 있는 것은?
- 사람의 두뇌
- 사람의 눈
- 사람의 손
- 사람의 가슴
46. 어떤 공정의 전달함수가 G(s)이다. G(O2)=5이고 G(2i)=-2 였다. 공정의 공정이득(k), 임계이득(kcu)과 임계주기(Pu)는 무엇인가?
- k = 5.0, kcu=0.5, Pu = π
- k = 0.2, kcu=0.5, Pu = 2
- k = 5.0, kcu=2.0, Pu = π
- k = 0.2, kcu=2.0, Pu = 2
47. 주파수 3에서 amplitude ratio가 1/2, phase angle이 -π/3인 공정을 고려할 때 공정 입력u(t)=sin(3t+2π/3)을 적용하면 시간이 많이 지난 후의 공정 출력 y(t)는?
- y(t)=sin(t-π/3)
- y(t)=2sin(t+π)
- y(t)=sin(3t)
- y(t)=0.5sin(3t+π/3)
48. 그림과 같은 단위 계단함수의 Laplae 변환은?
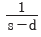
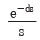
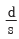
- se-us
49. 불안정한 계에 해당하는 것은?
50. 다음 공정의 단위 계단응답은?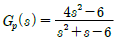
- y(t)=1+e2t+e-2t
- y(t)=1+2e2t+e-2t
- y(t)=1+2e2+e-3t
- y(t)=1+e2t+2e-3t
51. 변수 값을 측정하는 감지시스템은 일반적으로 센서, 전송기로 구성된다. 다음 중 전송기에서 일어나는 문제점으로 가장 거리가 먼 것은?
- 과도한 수송지연
- 잡음
- 잘못된 보정
- 낮은 해상도
52. 전달함수가 G(s)=1/(s3+s2+s+0.5)인 공정을 비례 제어하 때 한계이득(폐루프의 안전성을 보장하는 비례 이득의 최대치)과 이때의 진동주기로 옳은 값은?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- 1, 2π
- 0.5, 2π
- 1, π
- 0.5, π
53. 전달함수가 G(s)=exp(-θs)/(τs+1)인 공정에 공정 입력 u(t)=sin(1/√2t)를 입력했을 때 시간이 많이 흐른 후 공정 출력은 y(t)=(1√2)sin(√2t-π/2)였다. θ와 τ는 무엇인가?
- τ=1/2, θ=π/2√2
- τ=1√2, θ=π/4√2
- τ=1/2, θ=π/4√2
- τ=1/2, θ=π/2√2
54. 다음의 블록선도는 제어기 내부 구조를 나타낸다. 이 선도가 나타내는 제어 모드는?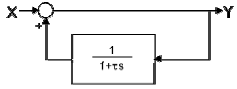
- 비례(P) 제어
- 비례적분(PI) 제어
- 비례미분(PD) 제어
- 비례적분미분(PID) 제어
55. 위상지연이 180°이 주파수는?
- 고유 주파수
- 공명(resonant) 주파수
- 구석(corner) 주파수
- 교차(crossover) 주파수
56. 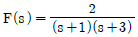 의 laplace 역변환은?
의 laplace 역변환은?
- et-e3t
- e-t-e-3t
- e3t-et
- e3t-e-t
57. PID 제어기의 비례, 적분, 미분 동작이 폐루프 응답에 미치는 효과 중 틀린 것은?
- 비례동작이 클수록 폐루프 응답이 빨라진다.
- 적분동작은 오프셋을 제거하고 시스템의 안정성을 증가시킨다.
- 미분동작은 오차의 변화율만을 고려하며 오차 크기 자체에는 무관하다.
- 적분동작은 위상지연, 미분동작은 위상앞섬의 효과가 있다.
58. 다음 블록다이어그램에 관한 사항으로 옳은 것은?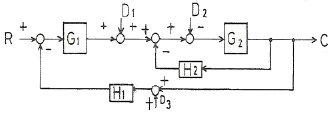
59. 그림과 같이 나타나는 함수의 Laplace 변환은?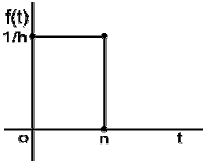
60. 연속 입출력 흐름과 내부 전기 가열기가 있는 저장조의 온도를 설정 값으로 유지하기 위해 들어오는 입력흐름의 유량과 내부 가열기에 공급 전력을 조작하여 출력흐름의 온도와 유량을 제어하고자 하는 시스템을 분류한다면 어떠한 것에 해당하는가?
- 다중 입력 - 다중 출력 시스템
- 다중 입력 - 단일 출력 시스템
- 단일 입력 - 단일 출력 시스템
- 단일 입력 - 다중 출력 시스템
4과목: 공업화학
61. 반도체 제조 공정 중 패턴이 형성된 표면에서 원하는 부분을 화학반응 혹은 물리적 과정을 통하여 제거하는 공정을 의미하는 것은?
- 세정공정
- 에칭공정
- 포토리소그래피
- 건조공정
62. 산과 알코올이 어떤 반응을 일으켜 에스테르가 생성되는가?
- 점화
- 환원
- 축합
- 중화
63. 95.6% 황산 100g을 40% 발연황산을 이용하여 100% 황산으로 만들려고 한다. 이론적으로 필요한 발연황산의 무게는?
- 42.4g
- 48.9g
- 53.6g
- 60.2g
64. 다음 중 Le Blanc 법과 관계가 없는 것은?
- 망초(황산나트륨)
- 흑회(black ash)
- 녹액(green liquor)
- 암모니아 함수
65. 질소비료 중 암모니아를 원료로 하지 않는 비료는?
- 황산암모늄
- 요소
- 질산암모늄
- 석회질소
66. 담체(Carrier)에 대한 설명으로 옳은 것은?
- 촉매의 일종으로 반응속도를 증가시킨다.
- 자체는 촉매작용을 못하고, 촉매의 지지체로 촉매의 활성을 도와준다.
- 부촉매로서 촉매의 활성을 억제시키는 첨가물이다.
- 불균일 촉매로서 촉매의 유효면적을 감소시켜 촉매의 활성을 잃게 한다.
67. 헥산(C6H14)의 구조이성질체 수는?
- 4개
- 5개
- 6개
- 7개
68. 전지 CulCuSO4(0.05M), HgSO4(S)lHg의 기전력은 25℃에서 약 0.418 V이다. 이 전지의 자유에너지 변화는?
- -9.65 kcal
- -19.3 kcal
- -96 kcal
- -193 kcal
69. 다음의 암모니아 산화반응식에서 공기산화를 위한 혼합가스 중 NH3가스의 부피 백분율은? (단, 공기와 NH3가스는 양론적 요구량만큼만 공급한다고 가정하다.)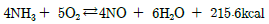
- 14.4%
- 22.3%
- 33.3%
- 41.4%
70. RCH=CH3와 할로겐화 메탄 등의 저분자 물질을 중합하여 제조되는 짧은 사슬의 중합체는?
- 덴드리머(dendrimer)
- 아이오노머(ionomer)
- 텔로머(telomer)
- 프리커서(precursor)
71. 석유, 석탄 등의 화석연료 이용 효율 및 환경오염에 대한 설명으로 옳은 것은?
- CO2의 배출은 오존층파괴의 주원인이다.
- CO2와 SOX는 광화학스모그의 주원인이다.
- NOX는 산성비의 주원인이다.
- 열에너지로부터 기계에너지로의 변환효율은 100%이다.
72. NaOH 제조에 사용하는 격막법과 수은법을 옳게 비교한 것은?
- 전류밀도는 수은법이 크고, 제품의 품질은 격막법이 좋다.
- 전류밀도는 격막법이 크고, 제품의 품질은 수은법이 좋다.
- 전류밀도는 격막법이 크고, 제품의 품질도 격막법이 좋다.
- 전류밀도는 수은법이 크고, 제품의 품질도 수은법이 좋다.
73. 합성염산 제조 시 원료기체인 H2와 CL2는 어떻게 제조하여 사용하는가?
- 공기의 액화
- 공기의 아크방전법
- 소금물의 전해
- 염화물의 치환법
74. 스타이렌-부타디엔-스타이렌 블록공중합체를 제조하는 방법은?
- 양이온 중합
- 리빙 음이온 중합
- 라디칼 중합
- 메탈로센 중합
75. 열제거가 용이하고 반응 혼합물의 점도를 줄일 수 있으나 저분자량의 고분자가 얻어지는 단점이 있는 중합방법은?
- 괴상 중합
- 용액 중합
- 현탁 중합
- 유화 중합
76. 열가소성(thermoplastic) 고분자에 대한 설명으로 틀린것은?
- 망상구조의 고분자가 갖고 있는 특징이다.
- 비결정성 플라스틱의 경우는 일반적으로 투명하다.
- 고체상태의 고분자 물질이 많다.
- PVC 같은 고분자가 이에 속한다.
77. 아닐린을 삼산화크롬으로 산화시킬 때 생성물은?
- 벤젠
- 벤조퀴논
- 크실렌
- 스티렌
78. 암모니아소다법에서 탄산화과정의 중화탑이 하는 주된 작용은?
- 암모니아 함수의 부분 탄산화
- 알칼리성을 강산성으로 변화
- 침전탑에 도입되는 가소로 가스와 암모니아의 완만한 반응유도
- 온도 상승을 억제
79. 연실식 황산제조에서 Gay-Lussac 탑의 주된 기능은?
- 황산의 생성
- 질산의 환원
- 질소산화물의 회수
- 니트로실 황산의 분해
80. 아디프산과 헥사메틸렌디아민을 원료로 하여 제조되는 물질은?
- 나일론 6
- 나일론 66
- 나일론 11
- 나일론12
5과목: 반응공학
81. 크기가 같은 plug flow 반응기(PFR)와 mixed flow 반응기(MFR)를 서로 연결하여 다음의 2차 반응을 실행하고자 한다. 반응물 A의 전화율이 가장 큰 경우는?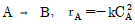
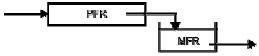

- 앞의 세 경우 모두 전화율이 똑같다.
82. 어떤 1차 비가역 반응의 반감기는 20분이다. 이 반응의 속도상수를 구하면 몇 min-1인가?
- 0.0347
- 0.1346
- 0.2346
- 0.3460
83. 회분식 반응기에서 전화율을 75%까지 얻는데 소요된 시간이 3시간이었다고 한다. 같은 전화율로 3ft3min을 처리하는데 필요한 플러그 흐름 반응기의 부피는? (단, 반응에 다른 밀도 변화는 없다.)
- 540ft3
- 620ft3
- 720ft3
- 840ft3
84. 액상 반응을 위해 다음과 같이 CSTR 반응기를 연결 하였다. 이 반응의 반응 차수는?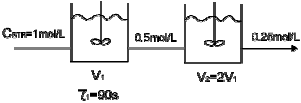
- 1
- 1.5
- 2
- 2.5
85. 순환비가 1인 등온 순환 플러그 흐름 반응기에서 기초 2차 액상 반응 2A → 2R이 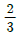 의 전화를 일으킨다. 순환비를 0으로 하였을 경우 전화율은?
의 전화를 일으킨다. 순환비를 0으로 하였을 경우 전화율은?
- 0.25
- 0.5
- 0.75
- 1
86. H2O2를 촉매를 이용하여 회분식 반응기에서 분해시켰다. 분해반응이 시작된 t분 후에 남아있는 H2O2의 양(v)을 KMnO4표준용액으로 적정한 결과는 다음 표와 같다. 이 반응은 몇 차 반응이겠는가?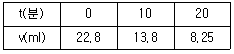
- 0차 반응
- 1차 반응
- 2차 반응
- 3차 반응
87. 포스핀의 기상분해 반응은 다음과 같다. 처음에 순수한 포스핀만 있다고 할 때 이 반응계의 팽창계수( 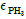 )는?
)는?
88. Michaelis - Menten 반응(A → R, 효소반응)의 속도식은? (단, [Ea] 효소의 초기농도, [M] : Michaelis - Menten 상수, [A] : A의 농도)
- rR=k[A][E0]/([M]+[A])
- rR=k[A][M]/([E0]+[A])
- rR=k[A][E0]/([M]+E0])
- rR=k[A][E0]/([M]-[A])
89. 혼합흐름반응기에서 다음과 같은 1차 연속반응이 일어날 때 중간생성물 R의 최대농도(CR-max/CA0)는?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)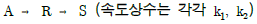
- [k2/k1)2+1]L/2
- [(k1/k2)2+1]-1/2
- [(k2/k1)1/2+1]2
- [(k1/k+2)1/2+1]-2
90. 다음은 CH3CHO의 기상열분해 반응에 대해 정용등은 회분식반응기에서 얻은 값이다. 이 반응의 치수에 가장 가까운 값은?
- 1차
- 1.7차
- 2.1차
- 2.8차
91. 난분자형 1차 비가역 반동을 시키기 위하여 관형반응기를 사용하였을 때 공간속도가 2500/h이었으며 이때 전화율은 30%였다. 만일 전화율이 90%로 되었다면 공간속도는?
- 367h1
- 377h1
- 387h1
- 397h1
92. 이상기체 반응 A → R + S가 순수한 A로부터 정용회 분식 반응기에서 진행될 때 분압과 전압간의 상관식으로 옳은 것은? (단, PA: A의 분압, PR: R의 분압, π0: 초기전압, π: 전압)
- PA=2π0-π
- PA=2π-π0
- PA2=2(π0-π)+PR
- PA2=2(π-π0)PR
93. 다음은 어떤 가역 반응의 단열 조작선의 그림이다. 조작선의 기울기는 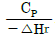 로 나타내는데 이 기울기가 큰 경우에는 어떤 형태의 반응기가 가장 좋겠는가? (단, CP 는 열용량, ΔHr은 반응열을 나타낸다.)
로 나타내는데 이 기울기가 큰 경우에는 어떤 형태의 반응기가 가장 좋겠는가? (단, CP 는 열용량, ΔHr은 반응열을 나타낸다.)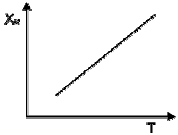
- 플러그 흐름 반응기
- 혼합 흐름 반응기
- 교반형 반응기
- 순환 반응기
94. 물리적 흡착에 대한 설명으로 가장 거리가 먼 것은?
- 다분자 층 흡착이 가능하다.
- 활성화 에너지가 작다.
- 가역성이 낮다.
- 고체표면에서 일어난다.
95. 다음 중 불균일 촉매반응(heterogeneous catalytie reaction)의 속도를 구할 때 일반적으로 고려하는 단계가 아닌 것은?
- 생성물의 탈착과 확산
- 반응물의 물질전달
- 촉매표면에 반응물의 흡착
- 촉매표면의 구조변화
96. 다음과 같은 액상 1차 직렬반응이 관형 반응기와 혼합반응기에서 일어날 때 R 성분의 농도가 최대가 되는 관형 반응기의 공간시간 τp와 혼합 반응기의 공간시간 τm에 관한 식으로 옳은 것은? (단, 두 반응의 속도상수는 같다.)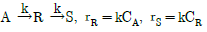
- τm > τp > 1
- τp/τm > 1
- τp/τm = 1
- τp/τm = k
97. 어떤 반응의 온도를 47℃에서 57℃로 증가시켰더니 이 반응의 속도는 두 배로 빨라졌다고 한다. 이때의 활성화 에너지는?
- 약 12,500cal
- 약 13,500cal
- 약 14,500cal
- 약 15,500cal
98. Space time이 5분이라면 다음 설명 중 어떤 것을 뜻 하는가?
- 원하는 전환율을 얻는데 걸리는 시간이
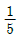 분이다.
분이다. - 분당반응기 체적의 5배되는 feed를 처리할 수 있다.
- 5분 만에 100% 전환을 얻을 수 있다.
- 분당 반응기 체적의
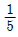 배 되는 feed를 처리할 수 있다.
배 되는 feed를 처리할 수 있다.
99. 다음의 병행반응에서 A가 반응물질, R이 요구하는 물질일 때 instantaneous fractional yield(순간적 수득분율) 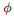 는?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
는?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- dCR/(-dCA)
- dCR/dCA
- dCS/(-dCA)
- dCS/dCA
100. 기초 2차 액상반응 2A → 2R을 순환비가 2인 등온플러그 흐름반응기에서 반응시킨 결과 50%의 전화율을 얻었다. 동일반응에서 순환류를 폐쇄시킨다면 전화율은?
- 0.6
- 0.7
- 0.8
- 0.9





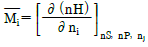
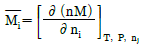
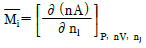
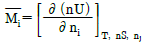

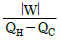
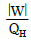
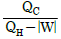
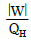 "이다. 이유는 계가 일을 할 때 입력된 에너지 중 실제로 유용하게 사용되는 에너지의 비율이 가장 높기 때문이다. 즉, 계가 일을 할 때 입력된 에너지 중 가장 많은 양이 유용하게 사용되어 일을 수행하게 된다는 것을 의미한다.
"이다. 이유는 계가 일을 할 때 입력된 에너지 중 실제로 유용하게 사용되는 에너지의 비율이 가장 높기 때문이다. 즉, 계가 일을 할 때 입력된 에너지 중 가장 많은 양이 유용하게 사용되어 일을 수행하게 된다는 것을 의미한다.

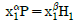
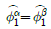
 "이다. 이유는 액체-액체 상평형 계산에서는 각 상의 화학평형 상수가 같아지는 지점에서 상평형이 이루어지기 때문이다. 따라서 위의 관계식에서는 두 상의 화학평형 상수가 같아지는 지점에서 x1 값을 구하게 된다.
"이다. 이유는 액체-액체 상평형 계산에서는 각 상의 화학평형 상수가 같아지는 지점에서 상평형이 이루어지기 때문이다. 따라서 위의 관계식에서는 두 상의 화학평형 상수가 같아지는 지점에서 x1 값을 구하게 된다.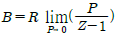
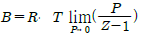
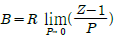

 " 이다.
" 이다.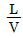 의 최소값은 흡수탑 하부에서 기액간의 농도차가 가장 클 때의 값이다."이 맞는 설명입니다.
의 최소값은 흡수탑 하부에서 기액간의 농도차가 가장 클 때의 값이다."이 맞는 설명입니다.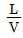 "와 "
"와 "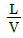 "는 조작선의 기울기와 반대의 관계를 가지게 됩니다.
"는 조작선의 기울기와 반대의 관계를 가지게 됩니다.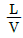 의 값은 흡수탑의 경제적인 운전과 관계가 있다."는 설명은 조작선의 기울기와는 직접적인 연관성이 없으며, 탑의 경제적인 운전과 관련된 다른 요소들과 연관이 있습니다.
의 값은 흡수탑의 경제적인 운전과 관계가 있다."는 설명은 조작선의 기울기와는 직접적인 연관성이 없으며, 탑의 경제적인 운전과 관련된 다른 요소들과 연관이 있습니다.
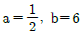
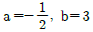
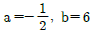

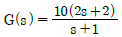
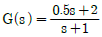
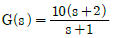
 " 이다.
" 이다.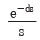 "입니다.
"입니다.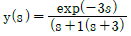
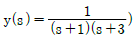
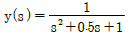
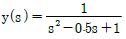
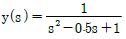 "이다. 이것은 불안정한 계를 나타내는 것으로, 그 이유는 불안정한 계의 특징인 불규칙한 모양과 불안정한 균형을 나타내기 때문이다. 다른 보기들은 안정적인 계를 나타내는 것으로, 규칙적인 모양과 안정적인 균형을 나타낸다.
"이다. 이것은 불안정한 계를 나타내는 것으로, 그 이유는 불안정한 계의 특징인 불규칙한 모양과 불안정한 균형을 나타내기 때문이다. 다른 보기들은 안정적인 계를 나타내는 것으로, 규칙적인 모양과 안정적인 균형을 나타낸다.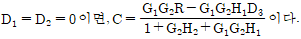

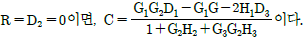

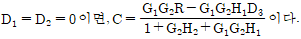 "은 고객이 입금을 하는 경우를 나타내며, "
"은 고객이 입금을 하는 경우를 나타내며, " "은 고객이 출금을 하는 경우를 나타낸다. "
"은 고객이 출금을 하는 경우를 나타낸다. "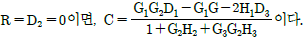 "은 입출금 내역을 기록하는 업무를 수행하는 부서를 나타내며, "
"은 입출금 내역을 기록하는 업무를 수행하는 부서를 나타내며, " "은 입출금 내역을 관리하는 업무를 수행하는 부서를 나타낸다. 따라서, 정답은 "
"은 입출금 내역을 관리하는 업무를 수행하는 부서를 나타낸다. 따라서, 정답은 "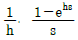
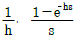

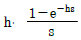
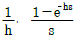 "이다.
"이다.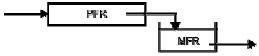 " 이다.
" 이다.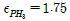
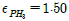
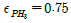

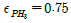 "이 정답입니다.
"이 정답입니다.
부분 몰 성질 i는 i 성분의 몰수를 일정하게 유지하면서 시스템의 다른 조건을 변화시켰을 때 i 성분의 몰에 대한 변화량을 의미한다. 따라서, "