1과목: 화공열역학
1. 1kg 질소가스가 2.3atm, 367K에서 압력이 2배로 증가하는데, PV1.3 = comst. 의 폴리트로픽 공정(Polytropic process)에 따라 변화한다고 한다. 질소가스의 최종 온도는 약 얼마인가?
- 360 K
- 400 K
- 430 K
- 730 K
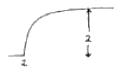
2. 그림의 2단 압축조작에서 각 단에서의 기체는 처음 온도로 냉각 된다고 한다. 각 압력사이에 어떤 관계가 성립할 때 압축에 소요되는 전 소요일(total work)량이 최소가 되겠는가?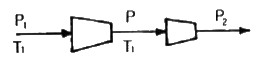
3. 공기표준 디젤 사이클의 구성요소로서 그 과정이 옳은 것은?
- 단열압축 → 정압가열 → 단열팽창 → 정적방열
- 단열압축 → 정적가열 → 단열팽창 → 정적방열
- 단열압축 → 정적가열 → 단열팽창 → 정압방열
- 단열압축 → 정압가열 → 단열팽창 → 정압방열
4. 비리얼 방정식(Virial equation)이 Z = 1 + BP 로 표시되는 어떤 기체를 가역적으로 등온압축 시킬 때 필요한 일의 양은? (단, Z = PV/RT, B : 비리얼 계수)
- 이상기체의 경우와 같다.
- 이상기체의 경우보다 많다.
- 이상기체의 경우보다 적다.
- B 값에 따라 다르다.
5. 열역학에 관한 설명으로 옳은 것은?
- 일정한 압력과 온도에서 일어나는 모든 비가역과정은 깁스(Gibbs)에너지를 증가시키는 방향으로 진행한다.
- 공비물의 공비조성에서는 끓는 액체에서와 같은 조성을 갖는 기체가 만들어지며 액체의 조성은 증발하면서도 변화하지 않는다.
- 압력이 일정한 단일상의 PVT 계에서
 이다.
이다. - 화학반응이 일어나면 생성물의 에너지는 구성 원자들의 물리적 배열의 차이에만 의존하여 변한다.
6. 다음 그림은 A, B-2성분계 용액에 대한 1기압 하에서의 온도-농도간의 평형관계를 나타낸 것이다. A의 몰분율이 0.4 인 용액을 1기압 하에서 가열할 경우, 이 용액의 끓는 온도는 몇 ℃ 인가? (단, XA 는 액상 몰분률이고, yA는 기상 몰분률이다.)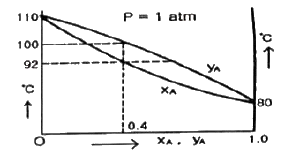
- 80℃
- 80℃ 부터 92℃ 까지
- 92 ℃부터 100℃ 까지
- 110℃
7. 여름철에 집안에 있는 부엌을 시원하게 하기 위하여 부엌의 문을 닫아 부엌을 열적으로 집안의 다른 부분과 격리하고 부엌에 있는 전기냉장고의 문을 열어놓았다. 이 부엌의 온도는?
- 온도가 내려간다.
- 온도의 변화는 없다.
- 온도가 내려갔다, 올라갔다를 반복한다.
- 온도는 올라간다.
8. 평형상수의 온도에 따른 변화를 알기 위하여 필요한 물성은 무엇인가?
- 반응에 관여한 물질의 증기압
- 반응에 관여한 물질의 확산계수
- 반응에 관여한 물질의 임계상수
- 반응에 수반되는 엔탈피 변화량
9. 다음 중 이심인자(acentric factor) 값이 가장 큰 것은?
- 제논(Xe)
- 아르곤(Ar)
- 산소(O2)
- 크립톤(Kr)
10. 열역학 제2법칙에 대한 설명 중 틀린 것은?
- 고립계로 생각되는 우주의 엔트로피는 증가한다.
- 어떤 순환공정도 계가 흡수한 열을 완전히 계에 의해 행하여지는 일로 변환시키지 못한다.
- 열이 고온부로부터 저온부로 이동하는 현상은 자발적이다.
- 연기관의 최대효율은 100% 이다.
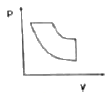
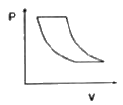
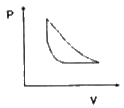
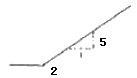
11. 다음 중에서 공기표준오토(Air-Standard Otto) 엔진의 압력-부피 도표에서 사이클을 옳게 나타낸 것은?
12. 등온과정에서 300K일 때 기체의 압력이 10atm 에서 2atm 으로 변했다면 소요된 일의 크기는? (단, 기체는 이상기체라 가정하고, 기체상수 R은 1.987cal/mol·K이다.)
- 596.1cal
- 959.4cal
- 2494.2cal
- 4014.3cal
13. 진공에서 CaCO3(s)가 CaO(s)와 CO2(g)로 완전분해하여 만들어진 계에 대해 자유도(Degree of freedom) 수는?
- 0
- 1
- 2
- 3
14. 압축인자(compressibility factor)인 Z를 표현하는 비리얼 전개(Virial expansion)는 다음과 같다. 이에 대한 설명으로 옳지 않은 것은? (단, B, C, D 등은 비리얼 계수이다.)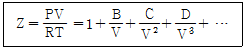
- 비리얼 계수들은 실제기체의 분자상호간의 작용 때문에 나타나는 것이다.
- 비리얼 계수들은 주어진 기체에서 온도 및 압력에 관계없이 일정한 값을 나타낸다.
- 이상기체의 경우 압축인자의 값은 항상 1이다.
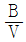 항은
항은  항에 비해 언제나 값이 크다.
항에 비해 언제나 값이 크다.
15. 화학평형상수에 미치는 온도의 영향을 옳게 나타낸 것은? (단, ΔH°는 표준반응 엔탈피로서 온도에 무관하며, K0 는 온도 T0 에서의 평형상수, K 는 온도 T 에서의 평형상수이다.)
- 발열반응이면 온도증가에 따라 화학평형상수는 증가
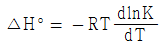
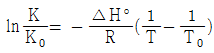
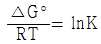
16. 1atm, 32℃의 공기를 0.8atm 까지 가역단열 팽창시키면 온도는 약 몇 ℃ 가 되겠는가? (단, 비열비가 1.4 인 이상기체라고 가정한다.)
- 3.2℃
- 13.2℃
- 23.2℃
- 33.2℃
17. 열역학 제1법칙에 대한 설명 중 틀린 것은?
- 에너지는 여러 가지 형태를 가질 수 있지만 에너지의 총량은 일정하다.
- 계의 에너지 변화량과 외계의 에너지 변화량의 합은 영(zero)이다.
- 한 형태의 에너지가 없어지면 동시에 다른 형태의 에너지로 나타난다.
- 닫힌 계에서 내부에너지 변화량은 영(zero)이다.
18. 다음 중 기-액 상평형 자료의 건전성을 검증하기 위하여 사용하는 것으로 가장 옳은 것은?
- 깁스-두헴(Gibbs-Duhem)식
- 클라우지우스-클레이페이론(Clausisus-Clapeyron)식
- 맥스웰 관계(Maxwell relation)식
- 헤스의 법칙(Hess's Law)
19. 오토(Otto) 사이클의 효율(η)을 표시하는 식으로 옳은 것은? (단, k = 비열비, rV = 압축비, rf = 팽창비 이다.)
20. 0℃, 1atm 인 상태에 있는 100L 의 헬륨을 밀폐된 용기에서 100℃로 가열하였을 때 ΔH를 구하면 약 몇 cal 인가? (단, 헬륨은 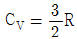 인 이상기체로 가정하고, 기체상수 R=1.987cal/mol·K 이다.)
인 이상기체로 가정하고, 기체상수 R=1.987cal/mol·K 이다.)
- 1477
- 1772
- 2018
- 2216
2과목: 단위조작 및 화학공업양론
21. 산소 75vol% 와 메탄 25vol%로 구성된 혼합가스의 평균분자량은?
- 14
- 18
- 28
- 30
22. 25℃에서 다음 반응의 정압에서와 정용에서의 반응열의 차이를 구하면 약 몇 cal 인가?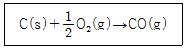
- 29.6
- 59.2
- 296
- 592
23. 500mL 플라스크에 4g 의 N2O4 를 넣고 50℃에서 해리시켜 평형에 도달하였을 때 전압이 3.63atm 이었다. 이때 해리도는 약 몇 % 인가? (단, 반응식은 N2O4 → 2NO2 이다.)
- 27.5
- 37.5
- 47.5
- 57.5
24. 임계상태에 관련된 설명으로 옳지 않은 것은?
- 임계상태는 압력과 온도의 영향을 받아 기상거동과 액상거동이 동일한 상태이다.
- 임계온도 이하의 온도 및 임계압력 이상의 압력에서 기체는 응축하지 않는다.
- 임계점에서의 온도를 임계온도, 그 때의 압력을 임계압력이라고 한다.
- 임계상태를 규정짓는 임계압력은 기상거동과 액상거동이 동일해지는 최저압력이다.
25. 어떤 공업용수 내에 칼슘(Ca)함량이 100ppm 이면 무게 백분율(wt%)로 환산하면 얼마인가? (단, 공업용수의 비중은 1.0 이다.)
- 0.01%
- 0.1%
- 1%
- 10%
26. 보일러에 Na2SO3 를 가하여 공급수 중의 산소를 제거한다. 보일러 공급수 200톤에 산소함량 2ppm 일 때 이 산소를 제거하는데 필요한 Na2SO3 의 이론량은?
- 1.58kg
- 3.15kg
- 4.74kg
- 6.32kg
27. 점도 0.05 poise를 kg/m·s로 환산하면?
- 0.005
- 0.025
- 0.05
- 0.25
28. 30℃, 742mmHg에서 수증기로 포화된 H2 가스가 2300cm3 의 용기 속에 들어있다. 30℃, 742mmHg에서 순 H2 가스의 용적은 약 몇 cm3 인가? (단, 30℃에서 포화수증기압은 32mmHg이다.)
- 2200
- 2090
- 1880
- 1170
29. 도관 내 흐름을 해석할 때 사용되는 베르누이식에 대한 설명으로 틀린 것은?
- 마찰손실이 압력손실 또는 속도수두 손실로 나타나는 흐름을 해석할 수 있는 식이다.
- 수평흐름이면 압력손실이 속도수두 증가로 나타나는 흐름을 해석할 수 있는 식이다.
- 압력수두, 속도수두, 위치수두의 상관관계 변화를 예측할 수 있는 식이다.
- 비점성, 비압축성, 정상상태, 유선을 따라 적용할 수 있다.
30. 300kg 의 공기와 24kg 의 탄소가 반응기내에서 연소하고 있다. 연소하기 전 반응기내에 있는 산소는 약 몇 kmol 인가?
- 2
- 2.18
- 10.34
- 15.71
31. 반경이 R 인 원형파이프를 통하여 비압축성 유체가 층류로 흐를 때의 속도분포는 다음 식과 같다. v 는 파이프 중심으로부터 벽 쪽으로의 수직거리 r 에서의 속도이며, Vmax 는 중심에서의 최대속도이다. 파이프 내에서 유체의 평균속도는 최대속도의 몇 배 인가?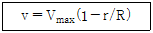
- 1/2
- 1/3
- 1/4
- 1/5
32. 전압이 1atm에서 n-헥산과 n-옥탄의 혼합물이 기-액 평형에 도달하였다. n-헥산과 n-옥탄의 순성분 증기압이 1025mmHg 와 173mmHg 이다. 라울의 법칙이 적용될 경우 n-헥산의 기상 평형 조성은 약 얼마인가?
- 0.93
- 0.69
- 0.57
- 0.49
33. 상계점(plait point)에 대한 설명 중 틀린 것은?
- 추출상과 추잔상의 조성이 같아지는 점
- 분배곡선과 용해도곡선과의 교점
- 임계점(critical point)으로 불리기도 하는 점
- 대응선(tie-line)의 길이가 0 이 되는 점
34. FPS 단위로부터 레이놀즈수를 계산한 결과 1000 이었다. MKS 단위로 환산하여 레이놀즈수를 계산하면 그 값은 얼마로 예상할 수 있는가?
- 10
- 136
- 1000
- 13600
35. 건조조작에서 임계함수율(critical moisture content)을 옳게 설명한 것은?
- 건조 속도가 0 일 때의 함수율이다.
- 감률 건조기간이 끝날 때의 함수율이다.
- 항률 건조기간에서 감률 건조기간으로 바뀔 때의 함수율이다.
- 건조조작이 끝날 때의 함수율이다.
36. 확산에 의한 물질전달현상을 나타낸 Fick 의 법칙처럼 전달속도, 구동력 및 저항사이의 관계식으로 일반화되는 점에서 유사성을 갖는 법칙은 다음 중 어느 것인가?
- Stefan-Boltzman 법칙
- Henry 법칙
- Fourier 법칙
- Raoult 법칙
37. 공극률(porosity)이 0.3 인 충전탑 내를 유체가 유효 속도(superficial velocity) 0.9m/s 로 흐르고 있을 때 충전탑내의 평균 속도는 몇 m/s 인가?
- 0.2
- 0.3
- 2.0
- 3.0
38. 다음 중에서 Nusselt 수(NNu)를 나타내는 것은? (단, h 는 경막열전달계수, D 는 관의 직경, k 는 열전도도 이다.)
- k · D · h
- k · D
- D / (k · h)
- (D · h) / k
39. 혼합에 영향을 주는 물리적 조건에 대한 설명으로 옳지 않은 것은?
- 섬유상의 형상을 가진 것은 혼합하기가 어렵다.
- 건조분말과 습한 것의 혼합은 한 쪽을 분할하여 혼합한다.
- 밀도차가 클 때는 밀도가 큰 것이 아래로 내려가므로 상하가 고르게 교환되도록 회전방법을 취한다.
- 액체와 고체의 혼합·반죽에서는 습윤성이 적은 것이 혼합하기 쉽다.
40. 원심 펌프의 장점에 대한 설명으로 가장 거리가 먼 것은?
- 대량 유체 수송이 가능하다.
- 구조가 간단하다.
- 처음 작동 시 Priming 조작을 하면 더 좋은 양정을 얻는다.
- 용량에 비해 값이 싸다.
3과목: 공정제어
41. PI제어기는 Bode diagram상에서 어떤 특징을 갖는가? (단, τI 는 PI제어기의 적분시간을 나타낸다.)
- ωτI가 1일 때 위상각이 -45°
- 위상각이 언제나 0
- 위상 앞섬(phase lead)
- 진폭비가 언제나 1보다 작음
42. 비례 제어기를 이용하는 어떤 폐루프 시스템의 특성방정식이 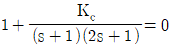 와 같이 주어진다. 다음 중 진동응답이 예상되는 경우는?
와 같이 주어진다. 다음 중 진동응답이 예상되는 경우는?
- Kc = -1.25
- Kc = 0
- Kc = 0.25
- Kc 에 관계없이 진동이 발생된다.
43. 다음 중 0 이 아닌 잔류편차(offset)를 발생시키는 제어방식이며 최종값 도달시간을 가장 단축시킬 수 있는 것은?
- P형
- PI형
- PD형
- PID형
44. 어떤 1차계의 함수가 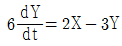 일 때 이 계의 전달함수의 시정수(times constant)는?
일 때 이 계의 전달함수의 시정수(times constant)는?
- 2/3
- 3
- 1/2
- 2
45. 앞먹임 제어(feedforward control)의 특징으로 옳은 것은?
- 공정모델값과 측정값과의 차이를 제어에 이용
- 외부교란변수를 사전에 측정하여 제어에 이용
- 설정점(set point)을 모델값과 비교하여 제어에 이용
- 제어기 출력값은 이득(gain)에 비례
46. 센서는 선형이 되도록 설계되는 것에 반하여, 제어밸브는 quick opening 혹은 equal percentage 등으로 비선형 형태로 제작되기도 한다. 다음 중 그 이유로 가장 타당한 것은?
- 높은 압력에 견디도록 하는 구조가 되기 때문
- 공정 흐름과 결합하여 선형성이 좋아지기 때문
- stainless steal 등 부식에 강한 재료로 만들기가 쉽기 때문
- 충격파를 방지하기 위하여
47. 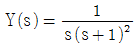 일 때에 y(t), t ≥ 0 값은?
일 때에 y(t), t ≥ 0 값은?
- 1+e-t-et
- 1-e-t+et
- 1-e-t-te-t
- 1-e-t+te-t
48. 50℃에서 150℃ 범위의 온도를 측정하여 4mA에서 20mA의 신호로 변환해 주는 변환기(transducer)에서의 영점(zero)과 변화폭(span)은 각각 얼마인가?
- 영점 = 0℃, 변화폭 = 100℃
- 영점 = 100℃, 변화폭 = 150℃
- 영점 = 50℃, 변화폭 = 150℃
- 영점 = 50℃, 변화폭 = 100℃
49. 탑상에서 고순도 제품을 생산하는 증류탑의 탑상 흐름의 조성을 온도로부터 추론(inferential) 제어하고자 한다. 이때 맨 위 단보다 몇 단 아래의 온도를 측정하는 경우가 있는데 다음 중 그 이유로 가장 타당한 것은?
- 응축기의 영향으로 맨 위 단에서는 다른 단에 비하여 응축이 많이 일어나기 때문에
- 제품의 조성에 변화가 일어나도 맨 위 단의 온도 변화는 다른 단에 비하여 매우 작기 때문에
- 맨 위 단은 다른 단에 비하여 공정 유체가 넘치거나(flooding) 방울져 떨어지기(weeping) 때문에
- 운전 조건의 변화 등에 의하여 맨 위 단은 다른 단에 비하여 온도는 변동(fluctuation)이 심하기 때문에
50. 단위 귀환(unit negative feedback)계의 개루프 전달함수가 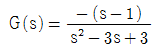 이다. 이 제어계의 폐회로 전달함수의 특정방정식의 근은 얼마인가?
이다. 이 제어계의 폐회로 전달함수의 특정방정식의 근은 얼마인가?
- -2, +2
- -2(중근)
- +2(중근)
- ±3j(중근)
51. 0~500℃ 범위의 온도를 4~20mA 로 전환하도록 스팬 조정이 되어 있던 온도센서에 맞추어 조율되었던 PID 제어기에 대하여, 0~250℃ 범위의 온도를 4~20mA 로 전환하도록 온도센서의 스팬을 재조정한 경우, 제어 성능을 유지하기 위하여 PID 제어기의 조율은 어떻게 바뀌어야 하는가? (단, PID 제어기의 피제어 변수는 4~20mA 전류이다.)
- 비례이득값을 2배 늘린다.
- 비례이득값을 1/2로 줄인다.
- 적분상수값을 1/2로 줄인다.
- 제어기 조율을 바꿀 필요없다.
52. 다음 중 공정제어의 목적과 가장 거리가 먼 것은?
- 반응기의 온도를 최대 제한값 가까이에서 운전함으로 반응속도를 올려 수익을 높인다.
- 평형반응에서 최대의 수율이 되도록 반응온도를 조절한다.
- 안전을 고려하여 일정 압력이상이 되지 않도록 반응속도를 조절한다.
- 외부 시장 환경을 고려하여 이윤이 최대가 되도록 생산량을 조정한다.
53. 전달함수가 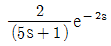 인 공정의 계단입력
인 공정의 계단입력 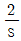 에 대한 응답형태는?
에 대한 응답형태는?
54. 다음 공정에 P 제어기가 연결된 닫힌루프 제어계가 안정하려면 비례이득 Kc 의 범위는? (단, 나머지 요소의 전달함수는 1 이다.)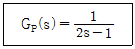
- Kc < 1
- Kc > 1
- Kc < 2
- Kc > 2
55. 블록선도(Block diagram)가 다음과 같은 계의 전달함수를 구하면?
56. 그래프의 함수와 그의 Laplace 변환된 형태의 함수가 옳게 되어 있는 항은? (단, U(t)는 단위계단함수(unit step function)이다.)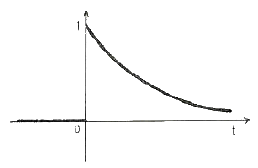
57. 블록선도에서 전달함수 G(s) = C(s)/R(s)를 옳게 구한 것은?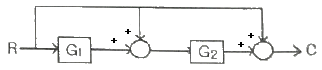
- 1 + G1G2
- 1 + G2+G1G2
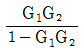
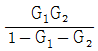
58. 복사에 의한 열전달 식은 q = kcAT4 으로 표현된다고 한다. 정상상태에서 T = Ts 일 때 이 식을 선형화 시키면? (단, k, c, A 는 상수 이다.)
- 4kcATs3(T-0.75Ts)
- kcA(T-Ts)
- 3kcATs3(T-Ts)
- kcATs4(T-Ts)
59. 전달함수 G(s)가 다음과 같은 1차계에서 입력 x(t) 가 단위충격(impulse)인 경우 출력 y(t)는?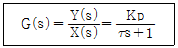
60. 안정한 2차계에 대한 공정응답 특성으로 옳은 것은?
- 사인파 입력에 대한 시간이 충분히 지난 후의 공정응답은 같은 주기의 사인파가 된다.
- 두 개의 1차계 공정이 직렬로 이루어진 2차계의 경우 큰 계단 입력에 대해 진동응답을 보인다.
- 공정 이득이 클수록 진동주기가 짧아진다.
- 진동응답이 발생할 때의 진동주기는 감쇠계수 ζ 에만 영향 받는다.
4과목: 공업화학
61. 다음 중 축합(condensation)중합반응으로 형성되는 고분자로서 알코올기와 이소시안산기의 결합으로 만들어진 것은?
- 폴리에틸렌(polyethylene)
- 폴리우레탄(polyurethane)
- 폴리메틸메타크릴레이트(poly(methylmethacrylate))
- 폴리아세트산비닐(poly(vinyl acetate))
62. 다음은 각 환원반응과 표준환원전위이다. 이것으로부터 예측한 다음의 현상 중 옳은 것은?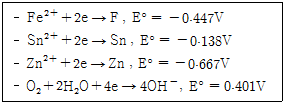
- 철은 공기 중에 노출 시 부식되지만 아연은 공기 중에서 부식되지 않는다.
- 철은 공기 중에 노출 시 부식되지만 주석은 공기 중에서 부식되지 않는다.
- 주석과 아연이 접촉 시에 주석이 우선적으로 부식된다.
- 철과 아연이 접촉 시에 아연이 우선적으로 부식된다.
63. 오산화바나듐(V2O5) 촉매하에 나프탈렌을 공기 중 400℃에서 산화시켰을 때 생성물은?
- 프탈산 무수물
- 초산 무수물
- 말레산 무수물
- 푸마르산 무수물
64. 접촉식 황산제조에서 SO3 흡수탑에 사용하기에 적합한 황산의 농도와 그 이유를 바르게 나열한 것은?
- 76.5%, 황산 중 수증기 분압이 가장 낮음
- 76.5%, 황산 중 수증기 분압이 가장 높음
- 98.3%, 황산 중 수증기 분압이 가장 낮음
- 98.3%, 황산 중 수증기 분압이 가장 높음
65. 다음 중 전도성 고분자가 아닌 것은?
- 폴리아닐린
- 폴리피롤
- 폴리실록산
- 폴리티오펜
66. 암모니아 합성용 수성가스(water gas)의 주성분은?
- H2O, CO
- CO2, H2O
- CO, H2
- H2O, N2
67. 수은법에 의한 NaOH 제조에 있어서 아말감 중의 Na 의 함유량이 많아지면 어떤 결과를 가져오는가?
- 유동성이 유동성이 좋아진다.
- 아말감의 분해속도가 느려진다.
- 전해질 내에서 수소가스가 발생한다.
- 불순물의 혼입이 많아진다.
68. 다음 중 옥탄가가 가장 낮은 것은?
- 2-Methyl heptane
- 1-Pentene
- Toluene
- Cyclohexane
69. 다음 중 CFC-113 에 해당되는 것은?
- CFCl3
- CFCl2CF2Cl
- CF3CHCl2
- CHClF2
70. 암모니아 합성장치 중 고온전환로에 사용되는 재료로서 뜨임 취성의 경향이 적은 것은?
- 18-8 스테인리스강
- Cr-Mo강
- 탄소강
- Cr-Ni강
71. 아세틸렌에 무엇을 작용시키면 염화비닐이 생성되는가?
- HCl
- Cl2
- HOCl
- NaCl
72. 용액중합반응의 일반적인 특징을 옳게 설명한 것은?
- 유화제로는 계면활성제를 사용한다.
- 온도조절이 용이하다.
- 높은 순도의 고분자물질을 얻을 수 있다.
- 물을 안정제로 사용한다.
73. 분자량 1.0×104g/mol 인 고분자 100g 과 분자량 2.5×104g/mol 인 고분자 50g, 그리고 분자량 1.0×105g/mol 인 고분자 50g 이 혼합되어 있다. 이 고분자 물질의 수평균 분자량은?
- 16000
- 28500
- 36250
- 57000
74. 수(水)처리와 관련된 보기의 설명 중 옳은 것으로만 나열한 것은?
- ①, ②, ③
- ②, ③, ④
- ①, ③, ④
- ①, ②, ④
75. 석유화학공정에서 열분해와 비교한 접촉분해(catalytic cracking)에 대한 설명 중 옳지 않은 것은?
- 분지지방족 C3 ~ C6 파라핀계 탄화수소가 많다.
- 방향족 탄화수소가 적다.
- 코크스, 타르의 석출이 적다.
- 디올레핀의 생성이 적다.
76. 20% HNO3용액 1000kg을 55% 용액으로 농축하였다. 증발된 수분의 양은 얼마인가?
- 550kg
- 800kg
- 334kg
- 636kg
77. 다음 중 염산의 생산과 가장 거리가 먼 것은?
- 직접합성법
- NaCl의 황산분해법
- 칠레초석의 황산분해법
- 부생염산 회수법
78. 순수 염화수소(HCl) 가스의 제법 중 흡착법에서 흡착제로 이용되지 않는 것은?
- MgCl2
- CuSO4
- PbSO4
- Fe3(PO4)2
79. Na2CO3·10H2O 중에는 H2O 를 몇 % 함유하는가?
- 48%
- 55%
- 63%
- 76%
80. 다음 화합물 중 산성이 가장 강한 것은?
- C6H5SO3H
- C6H5OH
- C6H5COOH
- CH3CH2COOH
5과목: 반응공학
81. 반응장치 내에서 일어나는 열전달 현상과 관련된 설명으로 틀린 것은?
- 발열반응의 경우 관형 반응기 직경이 클수록 관중심의 온도는 상승한다.
- 급격한 온도의 상승은 촉매의 활성을 저하시킨다.
- 모든 반응에서 고온의 조건이 바람직하다.
- 전열조건에 의해 반응의 전화율이 좌우된다.
82. 90mol%의 A 45mol/L 와 10mol% 의 불순물 B 5mol/L 와의 혼합물이 있다. A/B를 100/1 수준으로 품질을 유지하고자 한다. D 는 A 또는 B 와 다음과 반이 반응한다. 완전반응을 가정했을 때, 필요한 품질을 유지하기 위해서 얼마의 D를 첨가해야 하는가?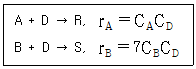
- 19.7mol
- 29.7mol
- 39.7mol
- 49.7mol
83. 순수한 액체 A 의 분해반응이 25℃ 에서 아래와 같을 때, A 의 초기농도가 2mol/L 이고, 이 반응이 혼합반응기에서 S를 최대로 얻을 수 있는 조건하에서 진행되었다면 S 의 최대농도는?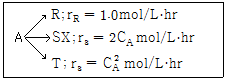
- 0.33mol/L
- 0.25mol/L
- 0.50mol/L
- 0.67mol/L
84. 어떤 반응에서 1/CA 을 시간 t 로 플롯하여 기울기 1인 직선을 얻었다. 이 반응의 속도식은?
- -rA = CA
- -rA = 2CA
- -rA = CA2
- -rA = 2CA2
85. 비가역 직렬반응 A→R→S 에서 1단계는 2차반응, 2단계는 1차반응으로 진행되고 R이 원하는 제품일 경우 다음 설명 중 옳은 것은?
- A의 농도를 높게 유지할수록 좋다.
- 반응 온도를 높게 유지할수록 좋다.
- 혼합흐름 반응기가 플러그 반응기보다 성능이 더 좋다.
- A 의 농도는 R 의 수율과 직접 관계가 없다.
86. 액상 반응이 다음과 같이 병렬 반응으로 진행될 때 R을 많이 얻고 S를 적게 얻으려면 A, B 의 농도는 어떻게 되어야 하는가?
- CA 는 크고, CB 도 커야 한다.
- CA 는 작고, CB 도 커야 한다.
- CA 는 크고, CB 도 작아야 한다.
- CA 는 작고, CB 도 작아야 한다.
87. 밀도가 일정한 비가역 1차 반응 A 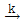 Product 가 혼합흐름반응기(mixed flow reactor 또는 CSTR)에서 등온으로 진행될 때 정상사태 조건에서의 성능 방정식(performance equation)으로 옳은 것은? (단, τ 는 공간속도, k 는 속도상수, CA0 는 초기농도, XA 는 전화율, CAf 는 유출농도 이다.)
Product 가 혼합흐름반응기(mixed flow reactor 또는 CSTR)에서 등온으로 진행될 때 정상사태 조건에서의 성능 방정식(performance equation)으로 옳은 것은? (단, τ 는 공간속도, k 는 속도상수, CA0 는 초기농도, XA 는 전화율, CAf 는 유출농도 이다.)
88. 혼합반응기(CSTR)에서 균일액상반응 A→R, -rA = kCA2인 반응이 일어나 50% 의 전화율을 얻었다. 이때 이 반응기의 다른 조건은 변하지 않고 반응기 크기만 6배로 증가한다면 전화율은 얼마인가?
- 0.65
- 0.75
- 0.85
- 0.95
89. 회분식 반응기에서 일어나는 다음과 같은 1차 가역 반응에서 A만으로 시작했을 때 A의 평형 전화율은 60%이다. 평형상수 k 는 얼마인가?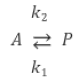
- 1.5
- 2
- 2.5
- 3
90. 다음은 n차(n >0) 단일 반응에 대한 한 개의 혼합 및 플러그 흐름 반응기 성능을 비교 설명한 내용이다. 옳지 않은 것은? (단, Vm 은 혼합흐름반응기 부피, Vp 는 플러그흐름 반응기 부피를 나타낸다.)
- Vm 은 Vp 보다 크다.
- Vm/Vp 는 전화율의 증가에 따라 감소한다.
- Vm/Vp 는 반응차수에 따라 증가한다.
- 부피변화 분율이 증가하면 Vm/Vp 가 증가한다.
91. 일반적인 반응 A → B 에서 생성되는 물질 기준의 반응속도 표현을 옳게 나타낸 것은? (단, n 은 몰수, VR 은 반응기의 부피이다.)
92. 회분식 반응기에서 0.5차 반응을 10min 동안 수행하니 75% 의 액체 반응물 A 가 생성물 R 로 전화되었다. 같은 조건에서 15min 간 반응을 시킨다면 전화율은 약 얼마인가?
- 0.75
- 0.85
- 0.90
- 0.94
93. 부피 3.2L 인 혼합흐름 반응기에 기체 반응물 A 가 1L/s 로 주입되고 있다. 반응기에서는 A → 2P 의 반응이 일어나며 A 의 전화율은 60% 이다. 반응물의 평균 체류시간은?
- 1초
- 2초
- 3초
- 4초
94. 회분식 반응기 내에서의 균일계 액상 1차 반응 A → R 과 관계가 없는 것은?
- 반응속도는 반응물 A 의 농도에 정비례한다.
- 전화율 XA 는 반응시간에 정비례 한다.
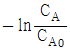 와 반응시간과의 관계는 직선으로 나타난다.
와 반응시간과의 관계는 직선으로 나타난다.- 반응속도 상수의 차원은 시간의 역수이다.
95. A + B → R 인 2차 반응에서 CA0 와 CB0 의 값이 서로 다를 때 반응속도상수 k를 얻기 위한 방법은?
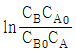 와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다.
와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다.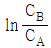 와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다.
와 t 를 도시(plot)하여 원점을 지나는 직선을 얻는다.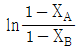 와 t 를 도시(plot)하여 절편이
와 t 를 도시(plot)하여 절편이 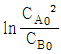 인 직선을 얻는다.
인 직선을 얻는다.- 기울기가 1+(CA0-CB0)2k 인 직선을 얻는다.
96. 단일상 이상(理想)반응기가 아닌 것은?
- 회분식 반응기
- 플러그 흐름 반응기
- 유동층 반응기
- 혼합 흐름 반응기
97. 80% 전화율을 얻는데 필요한 공간시간이 4h 인 혼합흐름 반응기에서 3L/min을 처리하는데 필요한 반응기 부피는 몇 L 인가?
- 576
- 720
- 900
- 960
98. 직렬로 연결된 2개의 혼합흐름반응기에서 다음과 같은 액상반응이 진행될 때 두 반응기의 체적 V1 과 V2 의 합이 최소가 되는 체적비 V1/V2 에 관한 설명으로 옳은 것은? (단, V1 은 앞에 설치된 반응기의 체적이다.)
- 0 < n < 1 이면 V1/V2 는 항상 1보다 작다.
- n = 1 이면 V1/V2 는 항상 1 이다.
- n > 1 이면 V1/V2 는 항상 1보다 크다.
- n > 0 이면 V1/V2 는 항상 1 이다.
99. A → R 로 표시되는 화학반응의 반응열이 ΔHr = 1800cal/mol A 로 일정할 때 입구온도 95℃ 인 단열반응기에서 A 의 전화율이 50% 이면, 반응기의 출구온도는 몇 ℃ 인가? (단, A와 R의 열용량은 각각 10cal/mol·K 이다.)
- 5
- 15
- 25
- 35
100. 비가역 액상 0차 반응에서 반응이 완전히 완결되는데 필요한 반응시간은?
- 초기농도의 역수와 같다.
- 속도상수의 역수와 같다.
- 초기농도를 속도상수로 나눈 값과 같다.
- 초기농도에 속도상수를 곱한 값과 같다.







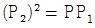
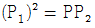

 "가 정답이다.
"가 정답이다.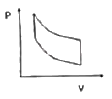
 " 입니다.
" 입니다. 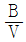 항은
항은  항에 비해 값이 작아질수도 있고 커질수도 있으며, 이는 기체의 종류와 상태에 따라 다르다.
항에 비해 값이 작아질수도 있고 커질수도 있으며, 이는 기체의 종류와 상태에 따라 다르다.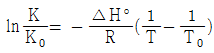 "이 옳다.
"이 옳다.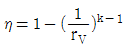
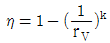
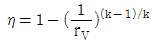
 "이다.
"이다.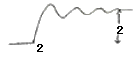
 " 입니다. 이유는 계단입력이 전달함수의 단위계단함수와 합성되어 전달함수의 일부분이 됩니다. 이 때, 계단함수는 전달함수의 고유한 특성을 반영하지 않기 때문에 전달함수의 응답형태는 계단함수와 달리 부드러운 곡선 형태를 띄게 됩니다. 따라서, 계단입력에 대한 전달함수의 응답형태는 부드러운 곡선 형태인 "
" 입니다. 이유는 계단입력이 전달함수의 단위계단함수와 합성되어 전달함수의 일부분이 됩니다. 이 때, 계단함수는 전달함수의 고유한 특성을 반영하지 않기 때문에 전달함수의 응답형태는 계단함수와 달리 부드러운 곡선 형태를 띄게 됩니다. 따라서, 계단입력에 대한 전달함수의 응답형태는 부드러운 곡선 형태인 "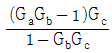
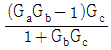
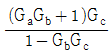
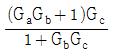
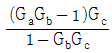 " 이다.
" 이다.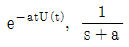



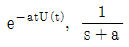 "이다.
"이다. "은 그래프와 Laplace 변환된 함수가 모두 옳지 않다.
"은 그래프와 Laplace 변환된 함수가 모두 옳지 않다.  "은 그래프는 옳지만 Laplace 변환된 함수가 옳지 않다.
"은 그래프는 옳지만 Laplace 변환된 함수가 옳지 않다.  "은 그래프와 Laplace 변환된 함수가 모두 옳지 않다.
"은 그래프와 Laplace 변환된 함수가 모두 옳지 않다. 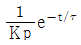

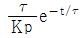
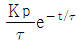
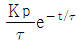 "입니다.
"입니다.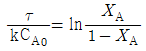

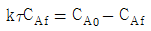
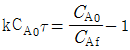
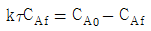 이 옳은 이유는 혼합흐름반응기가 등온으로 운전되므로 정상상태에서 입구와 출구의 농도가 동일하다. 따라서, 유출농도 CAf는 입구농도 CA0와 동일하다.
이 옳은 이유는 혼합흐름반응기가 등온으로 운전되므로 정상상태에서 입구와 출구의 농도가 동일하다. 따라서, 유출농도 CAf는 입구농도 CA0와 동일하다.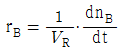
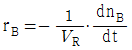
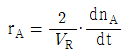
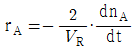
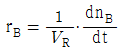 "이다.
"이다.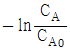 와 반응시간과의 관계는 직선으로 나타난다."
와 반응시간과의 관계는 직선으로 나타난다."
P1V11.3 = P2V21.3
2.3 x V11.3 = 4.6 x V21.3
V2 = (2.3/4.6)1/1.3 x V1 = 0.843 x V1
질소가스의 상태방정식인 PV = nRT 를 이용하여, V1 = nRT1/P1, V2 = nRT2/P2 이므로,
T2 = (P2/P1) x (V1/V2) x T1 = (4.6/2.3) x (1/0.843) x 367 K = 430 K
따라서, 질소가스의 최종 온도는 약 430 K 이다.