1과목: 화공열역학
1. 카르노사이클(Carnot cycle)의 가역 순서를 옳게 나타낸 것은?
- 단열 압축 → 단열팽창 → 등온팽창 → 등온압축
- 등온팽창 → 등온압축 → 단열팽창 → 단열압축
- 단열팽창 → 등온팽창 → 단열압축 → 등온압축
- 단열압축 → 등온팽창 → 단열팽창 → 등온압축
2. 기상 반응계에서 평형상수가 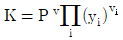 로 표시될 경우는? (단, vi는 성분 I의 양론수,
로 표시될 경우는? (단, vi는 성분 I의 양론수, 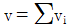 및
및 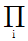 는 모든 화학종 i의 곱을 나타낸다.)
는 모든 화학종 i의 곱을 나타낸다.)
- 평형혼합물물이 이상기체와 같은 거동을 할 떼
- 평형혼합물이 이상용액과 같은 거동을 할 때
- 반응에 따른 몰수 변화가 없을 때
- 반응열이 온도에 관계없이 일정할 때
3. 다음 중 경로함수(path property)에 해당하는 것은?
- 내부에너지(J/mol)
- 위치에너지(J/mol)
- 열(J/mol)
- 엔트로피(J/mol)
4. 다음 중 등엔트로피 과정(Isentropeic process)은?
- 줄ㆍ톰슨 팽창
- 가역등온 과정
- 가역등압 과정
- 가역단열 과정
5. 내연기관 중 자동차에 사용되는 것으로 흡입행정은 거의 정압에서 일어나며, 단열압축 후 전기 점화에 의해 단열팽창하는 사이클은?
- 오토(Otto)
- 디젤(Diesel)
- 카르노(Carnot)
- 랭킨(Rankin)
6. 이상용액의 활동도 계수 γ는?
- γ>1
- γ<1
- γ=0
- γ=1
7. 어떤 가스(gas) 1g의 정압비열(Cp)이 온도의 함수로서 다음 식으로 주어질 때 계수 온도를 0℃에서 100℃로 변화시켰다면 이때 계의 가해진 열량은 몇 cal인가? (단, 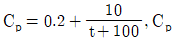 Cp는 cal/gㆍ℃, t는 ℃이며, 계의 압력은 일정하고 온도 범위에서 가스의 상변화는 없다.)
Cp는 cal/gㆍ℃, t는 ℃이며, 계의 압력은 일정하고 온도 범위에서 가스의 상변화는 없다.)
- 20.05
- 22.31
- 24.71
- 26.93
8. 실제 기체 압력이 0에 접근할 때, 잔류(residual) 특성에 대한 설명으로 옳은 것은? (단, 온도는 일정하다.)
- 잔류 엔탈피는 무한대에 접근하고 잔류 엔트로피는 0에 접근한다.
- 잔류 엔탈피와 잔류 엔트로피 모두 무한대에 접근한다.
- 잔류 엔탈피와 잔류 엔트로피 모두 0에 접근한다.
- 잔류 엔탈피는 0에 접근하고 잔류 엔트로피는 무한대에 접근한다.
9. 순환법칙 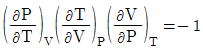 에서 얻을 수 있는 최종 식은? (단, β는 부피팽창률(Volume expansivity), k는 등온압축률(lsothermal compressebility)이다.)
에서 얻을 수 있는 최종 식은? (단, β는 부피팽창률(Volume expansivity), k는 등온압축률(lsothermal compressebility)이다.)
10. 흐름열량계(Flow Calorimeter)를 이용하여 엔탈피 변화량을 측정하고자 한다. 열량계에서 측정된 열량이 2000W라면, 입력 흐름과 출력 흐름의 비엔탈피(Specific Enthalpy)의 차이는 몇 J/g인가? (단, 흐름열량계의 입력 흐름에서는 0℃의 물이 5g/s의 속도로 들어가며, 출력 흐름에서는 3기압, 300℃의 수중기가 배출된다.)
- 400
- 2000
- 10000
- 12000
11. 반데르발스(vam der Waals)식에 맞는 실제기체를 등온가역 팽창시켰을 때 행한 일(work)의 크기는? (단, 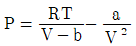 이며, V1은 초기부피, V2는 최종부피이다.)
이며, V1은 초기부피, V2는 최종부피이다.)
12. 용액 내에서 한 설분의 퓨개시티 계수를 표시한 식은? (단, øi는 퓨개시티 계수, 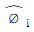 는 용액 중의 성분 i의 퓨개시티, fi는 순수성분 i의 퓨개시티,
는 용액 중의 성분 i의 퓨개시티, fi는 순수성분 i의 퓨개시티, 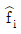 는 용액 중의 성분 i의 퓨개시티 xi는 용액의 몰 분율이다.)
는 용액 중의 성분 i의 퓨개시티 xi는 용액의 몰 분율이다.)
13. 평형에 대한 다음 조건 중 틀린 것은? (단, øi는 순수성분의 퓨개시티 계수, 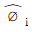 는 용액중의 성분 i의 퓨개시티,
는 용액중의 성분 i의 퓨개시티, 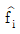 는 혼합물에서 성분 i의 퓨개시티, γi는 활동도 계수이며, xi는 액상에서 성분 i의 조성을 나타내며, 상첨자 V는 기상, L은 액상, S는 고상, l과 ll는 두 액상을 나타낸다.)
는 혼합물에서 성분 i의 퓨개시티, γi는 활동도 계수이며, xi는 액상에서 성분 i의 조성을 나타내며, 상첨자 V는 기상, L은 액상, S는 고상, l과 ll는 두 액상을 나타낸다.)
- 순수성분의 기-액 편형:
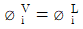
- 2성분 혼합물의 기-액 평형:
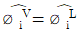
- 2성분 혼한물의 액-액 평형:
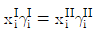
- 2성분 혼합물의 고-기 평형:
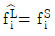
14. 평형의 조건이 되는 열역학적 물성이 아닌 것은?
- 퓨개시티(fugacity)
- 깁스자유에너지(Gibbs free energy)
- 화학 포텐셜(Chemical potential)
- 엔탈피(Enthalpy)
15. 3성분계의 기-액 상평형 계산을 위하여 필요한 최소의 변수의 수는 몇 개인가? (단, 반응이 없는 계로 가정한다.)
- 1개
- 2개
- 3개
- 4개
16. 0℃ 1atm의 물 1kg이 100℃ 1atm의 물로 변하였을 때 엔트로피 변화는 몇 kcal/k인가? (단, 물의 비열은 1.0cal/gㆍK이다.)
- 100
- 1.366
- 0.312
- 0.136
17. 부피를 온도와 압력의 함수로 나타낼 때 부피 팽창률(β)과 등온압축률(k) 의 관계를 나타낸 식으로 옳은 것은?
18. Cp=5cal/molㆍK인 이상기체를 25℃, 1기압으로부터 단열, 가역 과정을 통해 10기압까지 압축시킬 경우, 기체의 최종 온도는 약 몇 ℃인가?
- 60
- 470
- 745
- 1170
19. 설탕물을 만들다가 설탕을 너무 많이 넣어 아무리 저어도 컵 바닥에 설탕이 여전히 남아있을 때의 자유도는? (단, 물의 증발은 무시한다.)
- 1
- 2
- 3
- 4
20. 이상기체가 P1, V1, T1의 상태에서 P2, V2, T2까지 가역적으로 단열팽창되었다. 상관관계로 옳지 않은 것은? (단, γ는 비열비이다.)
2과목: 단위조작 및 화학공업양론
21. 0.℃. 0.5atm 하에 있는 질소가 있다. 이 기체를 같은 압력 하에서 20℃ 가열하였다면 처음 체적의 몇 %가 증가하였는가?
- 0.54
- 3.66
- 7.33
- 103.66
22. CO2 25vol%와 NH3 75vol%의 기체 혼합물 중 NH3의 일부가 산에 흡수되어 제거된다. 이 흡수탑을 떠나는 기체가 37.5vol%의 NH3을 가질 때 처음에 들어있던 NH3의 몇 %가 제거되었는가? (단, CO2의 양은 변하지 않는다고 하며, 산용액의 조금도 증발하지 않는 다고 한다.)
- 85%
- 80%
- 75%
- 65%
23. 정상상태로 흐르는 유체가 유로의 확대된 부분을 흐를 때 변화하지 않는 것은?
- 유량
- 유속
- 압력
- 유동단면적
24. 습한 쓰레기에 71wt% 수분이 포함되어 있었다. 최초 수분이 60%를 증발시키면 증발 후 쓰레기 내 수분의 조성은 몇 %인가?
- 40.5
- 49.5
- 50.5
- 59.5
25. 1.5wt% NaOH 수용액을 10wt% NaOH 수용액으로 농축하기 위해 농축 증발관으로 1.5wt% NaOH 수용액을 1000kg/h로 공급하면 시간당 증발되는 수문의 양은 몇 kg인가?
- 450
- 650
- 750
- 850
26. 실제기체의 거동을 예측하는 비리얼 상태식에 대한 설명으로 옳은 것은?
- 제1비리얼 계수는 압력에만 의존하는 상수이다.
- 제2비리얼 계수는 조성에만 의존하는 상수이다.
- 제3비리얼 계수는 체적에만 의존하는 상수이다,
- 제4비리얼 계수는 온도에만 의존하는 상수이다.
27. 37wt% HNO3 용액의 노르말(N) 농도는? (단, 이 용액의 비중은 1.227이다.)
- 6
- 7.2
- 12.4
- 15
28. 반대수(semi-log) 좌표계에서 직선을 얻을 수 있는 식은? (단, F와 Y는 종속변수이고, t와 x는 독립변수이며, a와 b는 상수이다.)
- F(t)=atb
- F(t)=aebt
- y(x)=ax2+b
- y(x)=ax
29. Ethylene glycol의 열용량 값이 다음과 같은 온도의 함수일 때, 0℃~100℃ 사이의 온도 범위 내에서 열용량의 평균값은 몇 cal/g ℃인가?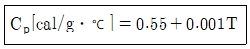
- 0.60
- 0.65
- 0.70
- 0.75
30. 30kg의 공기를 20℃에서 120℃까지 가열하는 데 필요한 열량은 몇 kcal인가? (단, 공기의 평균정압 비열은 0.24kcal/kg℃이다.)
- 720
- 820
- 920
- 980
31. 정압비열 0.24kcal/kgㆍ℃의 공기가 수평관 속을 흐르고 있다. 입구에서 공기온도가 21℃, 유속이 90m/s이고, 출구에서 유속은 150m/s이며, 외부와 열교환이 전혀 없다고 보면 출구에서의 공기온도는?
- 10.2℃
- 13.8℃
- 28.2℃
- 31.8℃
32. 다음 중 국부속도(local velocity) 측정에 가장 적합한 것은?
- 오리피스미터
- 피토관
- 벤츄리미터
- 로터미터
33. 온도에 민감하여 증발하는 동안 손상되기 쉬운 의약품을 농축하는 방법으로 적절한 것은?
- 가열시간을 늘린다.
- 증기공간이 절대압력을 낮춘다.
- 가열온도를 높인다.
- 열전도도가 높은 재질을 쓴다.
34. 고체건조의 항률 건조 단계(constant rate period)에 대한 설명으로 틀린 것은?
- 항률 건조 단계에서 복사나 전도에 의한 열전달이 없는 경우 고체 온도는 공기의 습구온도와 동일하다.
- 항률 건조 단계에서 고체의 건조 속도는 고체의 수분함량과 관계가 없다.
- 항률 건조 속도는 열전달식이나 물질전달식이나 물질전달식을 이용하여 계산할 수 있다.
- 주로 고체의 임계 함수량(critical moisture content) 이하에서 항률 건조를 할 수 있다.
35. 추출에서 추료(feed)에 추제(extracting solvent)를 가하여 잘 접촉시키면 2상으로 분리된다. 이 중 불활성 물질이 많이 남아 있는 상을 무엇이라고 하는가?
- 추출상(extract)
- 추잔상(raffinate)
- 추질(solute)
- 슬러지(sludge)
36. 증류에서 일정한 비휘발도의 값으로 2를 가지는 2성분 혼합물을 90mol%인 탑위제품과 10mol%인 탑밑제품으로 분리하고자 한다. 이 때 필요한 최소 이론 단수는?
- 3
- 4
- 6
- 7
37. 노즐흐름에서 충격파에 대한 설명으로 옳은 것은?
- 급격한 단면적 증가로 생긴다.
- 급격한 속도 감소로 생긴다.
- 급격한 압력 감소로 생긴다.
- 급격한 밀도 증가로 생긴다.
38. 흡수 충전탑에서 조작선(operating line)의 기울기를 L/V이라 할 때 틀린 것은?
- L/V의 값이 커지면 탑의 높이는 낮아진다.
- L/V의 값이 작아지면 탑의 높이는 높아진다.
- L/V의 값은 흥수탑의 경제적인 운전과 관계가 있다.
- L/V의 최솟값은 흡수탑 하무에서 기-액 간의 농도차가 가장 클 때의 값이다.
39. 룰 문쇄기에 상당직격 4cm인 원료를 도입하여 상당직경 1cm로 문쇄한다. 문쇄 원료와 롤 사이의 마찰계수가 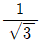 일 때 롤 지름은 약 몇 cm인가?
일 때 롤 지름은 약 몇 cm인가?
- 6.6
- 9.2
- 15.3
- 18.4
40. 운동점도(Kinematic viscosity)의 단위는?
- Nㆍs/m2
- m2/s
- cP
- m2/sㆍN
3과목: 공정제어
41. 전류식 비례제어기가 20℃에서 100℃까지의 범위로 온도를 제어하는 데 사용된다. 제어기는 출력전류가 4mA에서 20ma까지 도달하도록 조정되어 있다면 제어기의 이득(mA/℃)은?
- 5
- 0.2
- 1
- 10
42. PD 제어기에서 다음과 같은 입력신호가 들어올 경우, 제어기 출력 형태는? (단, Kc는 1이고 τD는 1이다.)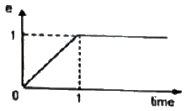
43. Anti Reset Windup에 관한 설명으로 가장 거리가 먼 것은?
- 제어기 출력이 공정 입력 한계에 결렸을 때 작동한다.
- 적분 동장에 부과된다.
- 큰 설정치 변화에 공정 출력이 크게 흔들리는 것은 방지한다.
- Offset을 없애는 동작이다.
44. 다음과 같은 2차계의 주파수 응답에서 감쇄 계수 값에 관계없이 위상의 지연이 90°가되는 경우는? (단, τ는 시정수이고, ω는 주파수이다.)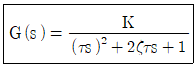
- ωτ-1일 때
- ω=τ일 때
- ωτ=√2 일 때
- ω=τ2 일 때
45. 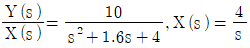 인 계에서 y(t) 의 최종값(ultimate value)은?
인 계에서 y(t) 의 최종값(ultimate value)은?
- 10
- 2.5
- 2
- 1
46. 다음 그림과 같은 액위제어계에서 제어밸브는 ATO(Air To-Opeen)형이 사용된다고 가정할 때에 대한 설명으로 옳은 것은? (단,Ditect는 공정출력이 상승할 때 제어출력이 상승함을, Revetse는 제어출력이 하강함을 의미한다.)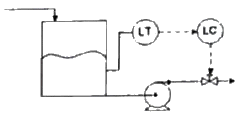
- 제어기 이득의 부호에 관계없이 제어기의 동작 방향은 Revetse이어야 한다.
- 제어기 동장방향은 Direct, 즉 제어기 이득은 음수이어야 한다.
- 제어기 동작뱡향은 Direct, 즉 제어기 이득은 양수이어야 한다.
- 제어기 동작뱡향은 Revetse, 즉 제어기 이득은 음수이어햐 한다.
47. 다음과 같은 특성식(characteristic eauation)을 갖는 계가 있다면 이 께는 Routh 시험 법에 의하여 다음의 어느 경우에 해당하는가?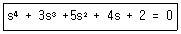
- 안정(stable)하다.
- 불안정(unstable)하다.
- 모든 근(root)이 허수축의 우특반면에 존재한다.
- 감쇠진동을 일으킨다.
48. 동적계(Dynamic System)를 전달함수로 표현하는 경우를 옳게 설명한 것은?
- 선형계의 동특성을 전달할 수 없다.
- 비선형계를 선형화하고 전달함수로 표현하면 비선형 동특성을 근사할 수 있다.
- 비선형계를 선형화하고 전달함수로 표현하면 비선형 동특성을 정확히 표현할 수 있다.
- 비선형계의 동특성을 선형화하지 않아도 전달함수로 표현할 수 있다.
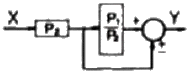
49. 다음 그림과 같은 제어계의 제어게의 전달함수 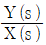 는?
는?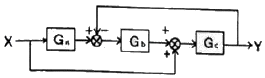
50. 온도 측정장치인 열전대를 반응기 탱크에 삽입한 접점의 온도를 Tm 유체와 접점 사이의 총열전달 계수(overall heat transfer coefficient)를 U, 접점의 표면적을 A, 탱크의 온도를 T, 접점의 질량을 m, 접점의 비열을 Cm이라고 하였을 때 접점의 에너지 d수지식은? (단, 열전대의 시간상우 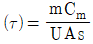 )
)
51. 다음 블록선도의 닫힌 루프 전달함수는?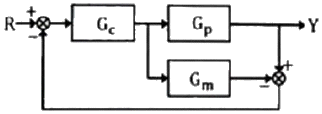
52. 1차계의 단위계단응답에서 시간 t가 2τ일 때 퍼센트 응답은 약 얼마인가? (단, τ는 1차계시간상수이다.)
- 50%
- 63.2%
- 86.5%
- 95%
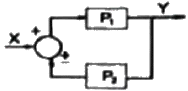
53. Y = P1X± P2X의 블록선도로 옳지 않은 것은?
54. 어떤 2차계의 damping ratio(ξ)가 1.2일 때 unit step response는?
- 무감쇠 진동응답
- 진동응답
- 무진동 감쇠응답
- 입계 감쇠응답
55. 아날로그 계장의 경우 센서 전송기의 출력신호, 제어기의 출력신호는 흔히 4~20mA의 전류로 전송된다. 이에 대한 설명으로 틀린 것은?
- 전류신호는 전압신호에 비하여 장거리 전송시 전자기적 잡음에 덜 민감하다.
- 0%를 4mA로 설정한 이유는 신호선의 단락여부를 쉽게 판단하고, 0% 신호에서도 전자 기적 잡음에 덜 민감하게 하기 위함이다.
- 0~150℃ 범위를 측정하는 전송기의 이득은 20/150mA/℃이다.
- 제어기 출력으로 ATC(Air-To-cloce)밸브를 동작시키는 경우 8mA에서 밸브 열림도(valve position)는 0.75가 된다.
56. 다음 함수를 Laplace 변환할 때 올바른 것은?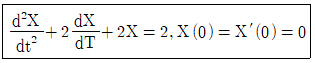
57. 다음과 같은 블록선도에서 정치제어(regulatory control)일 때 옳은 상관식은?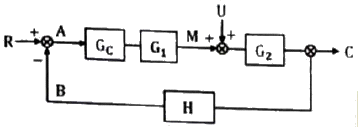
- C=GcG1G2A
- M=(R+B)GcG1
- C=GcG1G2(-B)
- M=GcG1(-B)
58. 다음 중 캐스케이드제어를 적용하기에 가장 적합한 동특성을 가진 경우는?
- 부제어루프 공정:
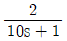 , 주제어루프 공정:
, 주제어루프 공정: 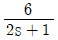
- 부제어루프 공정:
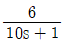 주제어루프 공정:
주제어루프 공정: 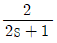
- 부제어루프 공정:
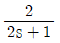 주제어루프 공정:
주제어루프 공정: 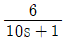
- 부제어루프 공정:
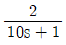 주에어루프 공정:
주에어루프 공정: 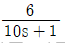
59. 어떤 공정에 대하여 수동모드에서 제어기 출력을 10% 계단 증가시켰을 때 제어변수가 초기에 5%만큼 증가하다가 최종적으로는 원래 값보다 10%만큼 줄어들었다. 이에 대한 설명으로 옳은 것은? (단, 공정입력의 상승이 고정출력의 상승을 초래하면 정동작 공저이고, 공정출력의 상승이 제어출력의 상승을 초래하면 정동작 제어기이다.)
- 공정이 정동작 공저이므로 PlD 제어기는 역동작으로 설정해야한다.
- 공정이 역동작 공정이므로 PlD 제어기는 정동작으로 설정해야한다.
- 공정 이득값은 제어변수 과도응답 변화 폭을 기준하여 -1.5이다.
- 공정 이득값은 과도 응답 최대치를 기준하여 0.5이다.
60. 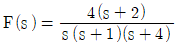 인 신호의 최종값(fimal value)은?
인 신호의 최종값(fimal value)은?
- 2
- ∞
- 0
- 1
4과목: 공업화학
61. NaOH 제조에 사용하는 격박법과 수은법을 옳게 비교한 것은?
- 전류밀도는 수은법이 크고, 제품의 품질은 격막법이 좋다.
- 전류밀도는 격막법이 크고, 제품의 품질은 수은법이 좋다.
- 전류밀도는 격막법이 크고, 제품의 품질의 품질은 격막법이 좋다.
- 전류밀도는 수은법이 크고, 제품의 품질은 수은법이 좋다.
62. 무기화학물과 비교한 유기화합물의 일반적인 특성으로 옳은 것은?
- 가연성이 있고, 물에 쉽게 용해되지 않는다.
- 가연성이 없고, 물에 쉽게 용해되지 않는다.
- 가연성이 없고, 물에 쉽게 용해된다.
- 가연성이 있고, 물에 쉽게 용해된다.
63. 카프로락탐에 관한 설명으로 옳은 것은?
- 나일론 6,6의 원료이다.
- cyclohexanone oxime을 황산처리하면 생성된다.
- cyclohexanone과 암모니아의 반응으로 생성된다.
- cyclohoxanone 및 초산과 아민의 반응으로 생성된다.
64. 석유정제에 사용된느 용제가 갖추어야 하는 조건이 아닌 것은?
- 선택성이 높아야 한다.
- 추출할 성분에 대한 용해도가 높아야 한다.
- 용제의 비점과 추출성분의 비점의 차이가 적어야 한다.
- 독성이나 장치에 대한 부식성이 적어야 한다.
65. 암모니아 산화법에 의하여 질산을 제조하면 상압에서 순도가 약 65% 내외가 되어 공업적으로 사용하기 힘들다. 이럴 경우 순도를 높이기 위한 일반적인 방법으로 옳은 것은?
- H2SO4의 흡수제를 첨가하여 3성분계를 만들어 농축한다.
- 온도를 높여 끓여서 물을 날려 보낸다.
- 촉매를 첨가하여 부가반응을 일으킨다.
- 계면활성제를 사용하여 물을 제거한다.
66. 질소비료 중 이론적으로 질소함유량이 가장 높은 비료는?
- 황산암모늄(황안)
- 염화암모늄(염안)
- 질산암모늄(질안)
- 요소
67. 일반적으로 고분자 합성을 단계 성장 중합(축합중합)과 사슬 성장 중합(부가중합) 반응으로 분리될 수 있다. 이에 대한 설명으로 옳지 않은 것은?
- 단계 성장 중합은 작용기를 가진 분자들 사이의 반응으로 일어난다.
- 단계 성장 중합은 중간에 반응이 중지될 수 없고, 중간체도 사슬 성장 중합과 마찬가지로 분리될 수 없다.
- 사슬 성장 중합은 중합 중에 일시적이지만 분리될 수 없는 중간체를 가진다.
- 사슬 성장 중합은 탄소-탄소 이중 경합을 포함한 단량체를 기본으로 하여 중합이어진다.
68. 가성소다 전해법 중 수은법에 대한 설명으로 틀린 것은?
- 양극은 흑연, 음극은 수은을 사용한다.
- Na+는 수은에 녹아 엷은 아말감을 형성한다.
- 아말감은 물과 반응시켜 NaOH와 H2를 생성한다.
- 아말감 중 Na 함량이 높으면 분해 속도가 느려지므로 전해질 내에서 H2가 제거된다.
69. 분자량이 5000, 10000, 15000, 20000, 25000 g/mol로 이루어진 다섯 개의 고분자가 각각 50, 100, 150, 200, 250kg이 있다. 이 고분자의 다분산도(polydispersity)는?
- 0.8
- 1.0
- 1.2
- 1.4
70. 프로필렌(CH2=CH-CH2)에서 쿠멘( 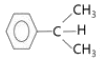 )을 합성 반응으로 옳은 것은?
)을 합성 반응으로 옳은 것은?
- 산화반응
- 알킬화반응
- 수화공정
- 중합공정
71. 감압 종류 공정을 거치지 않고 생산된 석유화학제품으로 옳은 것은?
- 유활유
- 아스팔트
- 나프타
- 벙커C유
72. 부식 전류가 커지는 원인이 아닌 것은?
- 용존 산소 농도가 낮을 때
- 온도가 높을 때
- 금속이 전도성이 큰 전해액과 접촉하고 있을 때
- 금속 표면의 내부 응력의 차가 클 때
73. 황산 제조 방법 중 연실법에서 장치의 능률을 높이고 경제적으로 조업하기 위하여 개량된 방법 또는 설비는?
- 소량응축법
- Pertersen Tower법
- Reynold법
- Monsanto법
74. 에폭시 수지에 대한 설명으로 틀린 것은?
- 접착제, 도료 또는 주형용 수지로 만들어지면 금속 표면에 잘 접착한다.
- 일반적으로 비스페놀A와 에피클로로히드린의 반응으로 제조한다.
- 열에는 안정하지만 강도가 좋지 않은 단점이 있다.
- 에폭시 수지 중 hydroxy기도 epoxy기와 반응하여 가교 결합을 형성할 수 있다.
75. 화학비료를 토양시비 시 토양이 산성화가 되는 주된 원인으로 옳은 것은?
- 암모늄 이온(종)
- 토양콜로이드
- 황산 이온(종)
- 질산화미생물
76. 인 31g을 완전 연소시키기 위한 산소의 부피는 표준상태에서 몇 L인가? (단, P의 원자량은 31이다.)
- 11.2
- 22.4
- 28
- 31
77. 일반적으로 니트로화 반응을 이용하여 벤젠을 니트로벤젠으로 합성할 때 많이 사용하는 것은?
- AICI3+HCI
- H2SO4+HNO3
- (CH3CO)2O2+HNO3
- HCI+HNO3
78. 인광석을 산분해하여 인산을 제조하는 방식 중 습식법에 해당하지 않는 것은?
- 황산 분해법
- 염산 분해법
- 질산 분해법
- 아세트산 분해법
79. 다음 중 III-V 화합물 반도체로만 나열된 것은?
- SiC, SiGe
- AlAs, AISb
- CdS, CdSe
- Pbs, PbTe
80. 일반적인 공정에서 에틸렌으로부터 얻는 제품이 아닌 것은?
- 에틸벤젠
- 아세트알데히드
- 에탄올
- 염화알릴
5과목: 반응공학
81. 다음과 같은 평행반응이 진행되고 있을 때 원하는 생성물이 S라면 반응물의 농도는 어떻게 조절해 주어야 하는가?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)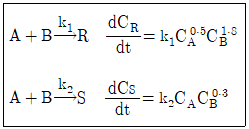
- CA를 높게, CB를 낮게
- CA를 낮게, CB를 높게
- CA와 CB를 높게
- CA와 CB를 낮게
82. 어느 조건에서 Space time이 3초이고, 같은 조건 하에서 원료의 공급률이 초당 300L일 때 반응기의 체적은 몇 L인가?
- 100
- 300
- 600
- 900
83. 평균 체류시간이 같은 관형반응기와 혼합흐름 반응기에서 A→R로 표시되는 화학반응이 일어날 때 전환율이 서로 같다면 이 반응의 차수는?
- 0차
- 1/2차
- 1차
- 2차
84. 회분계에서 반응물 A의 전화율, XA를 옳게 나타낸 것은? (단, NA는 A의 몰수, NAO는 초기 A의 몰수이다.)
85. 촉매 작용의 일반적인 특성에 대한 설명으로 옳지 않은 것은?
- 활성화 에너지가 촉매를 사용하지 않을 경우에 비해 낮아진다.
- 촉매 작용에 의하여 평형 조성을 변화시킬 수 있다.
- 촉매는 여러 반응에 대한 선택성이 높다.
- 비교적 적은 양의 촉매로도 다량의 생성물을 생성시킬 수 있다.
86. A+B→R인 비가역 기상 반응에 대해 다음과 같은 실험 데이터를 얻었다. 반응 속도식으로 옳은 것은? (단, t1/2은 B의 반감기이고, PA 및 PB는 각각 A 및 B의 초기 압력이다.)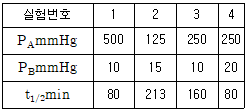
87. 크기가 같은 plug flow 반응기(PFR)와 mixed flow 반응기(MFR)를 서로 연결하여 다음의 2차 반응을 실행하고자 한다. 반응물 A의 전환율이 가장 큰 경우는?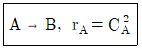
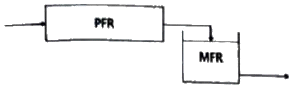
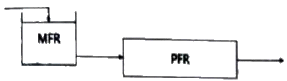
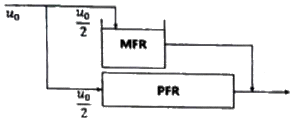
- 전환율은 반응기의 연결 방법, 순서와 상관없이 동일하다.
88. 불균질(heterogeneous) 반응 속도에 대한 설명으로 가장 거리가 먼 것은?
- 불균질 반응에서 일반적으로 반응 속도식은 화학 반응항에 물질 이동항이 포함된다.
- 어떤 단계가 비선형성을 띠면 이를 회피하지 말고 충괄 속도식에 적용하여 문제를 해결해야 한다.
- 여러 과정의 속도를 나타내는 단위가 서로 같으면 총괄 속도식을 유도하기 편리하다.
- 총괄 속도식에는 중간체의 농도항이 제거되어야 한다.
89. 균일계 가역 1차 반응 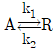 이 회분식 반응기에서 순수한 A로부터 반응이 시작하여 평형에 도달했을 때 A의 전환율이 85%이었다면 이 반응의 평형상수는 KC는?
이 회분식 반응기에서 순수한 A로부터 반응이 시작하여 평형에 도달했을 때 A의 전환율이 85%이었다면 이 반응의 평형상수는 KC는?
- 0.18
- 0.85
- 5.67
- 12.3
90. A+B→ R, rR=1.0CA1.5CB0.3과 A+B→S, rS=1.0CA0.5CB1.3에서 R이 요구하는 물질일 때 A의 전화율이 90%이면 혼합흐름반응기에서 R의 총괄수율(overall fractional yield)은 얼마인가? (단, A와 B의 농도는 각각 20mol/L이며 같은 속도로 들어간다.)
- 0.225
- 0.45
- 0.675
- 0.9
91. 다음 반응이 회분식 반응기에서 일어날 때 반응시간이 t이고 처음에 순수한 A로 시작하는 경우, 가역 1차 반응을 옳게 나타낸 식은? (단, A와 B의 농도는 CA, CB이고, CAeq는 평형상태에서 A의 농도이다.)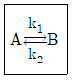
92. 1차 반응인 A→R, 2차 반응(desired)인 A→S, 3차 반응인 A→T에서 S가 요구하는 물질일 경우에 다음 중 옳은 것은?
- 플러그흐름반응기를 쓰고 전화율을 낮게 한다.
- 혼합흐름반응기를 쓰고 전화율을 낮게 한다.
- 중간수준의 A농도에서 혼합흐름반응기를 쓴다.
- 혼합흐름반응기를 쓰고 전화율을 높게 한다.
93. C3H5CH3+H2→C5H6+CH4의 톨루엔과 소수의 반응은 매우 빠른 반응이며 생성물은 평형 상태로 존재한다. 톨루엔의 초기 농도가 2mol/L, 수소의 초기농도가 4mol/L이고 반으을 900K에서 진행시켰을 때 반응 후 수소의 농도는 약 몇 mol/L인가? (단, 900K에서 평형상수 KP=227이다.)
- 1.89
- 1.95
- 2.01
- 4.04
94. 그림에 해당되는 반응 형태는?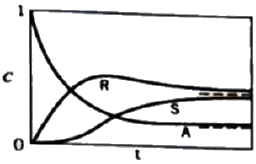
95. 온도가 27℃에서 37℃로 될 때 반응속도가 2배로 빨라진다면 활성화 에너지는 약 몇 cal/mol인가?
- 1281
- 1376
- 12810
- 13760
96. 반응물 A는 1차 반응 A→R에 의해 분해된다. 사로 다른 2개의 플러그흐름반응기에 다음과 같이 반응물의 주입량을 달리하여 분해 실험을 하였다. 두 반응기로부터 동일한 전화율 80%를 얻었을 경우 두 반응기의 부피비 V2/V1은 얼마인가? (단, FA0 공급물 속도이고, CA0는 초기 농도이다.)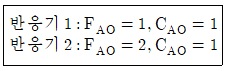
- 0.5
- 1
- 1.5
- 2
97. 플러그흐름반응기를 다음과 같이 연결할 때 D와 같이 연결할 때 D와 E에서 같은 전화율을 얻기 위해서는 D쪽으로의 공급속도 분율 D/T 값은 어떻게 되어야 하는가?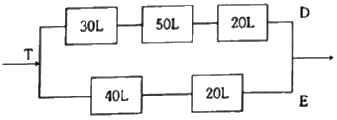
- 2/8
- 1/3
- 5/8
- 2/3
98. Thiele 계수에 대한 설명으로 틀린 것은?
- Thiele 계수는 가속도와 속도의 비를 나타내는 차원수이다.
- Thiele 계수의 클수록 입자 내 농도는 저하된다.
- 촉매입자 내 유효농도는 Thiele 계수의 값에 의존한다.
- Thiele 계수는 촉매표면과 내부의 효율적 이용의 척도이다.
99. 우유를 저온살균할 때 63℃에서 30분이 걸리고, 74℃에서는 15초가 걸렸다. 이 때 활성화 에너지는 약 몇 kJ/mol인가?
- 365
- 401
- 422
- 450
100. 1차 직렬반응이 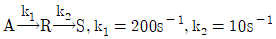 일 경우
일 경우  볼 수 있다. 이 때 k의 값은?
볼 수 있다. 이 때 k의 값은?
- 11.00 s-1
- 9.52 s-1
- 0.11 s-1
- 0.09 s-1








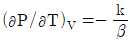
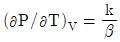
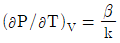
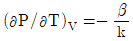
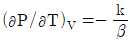
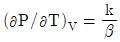
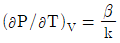
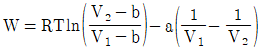
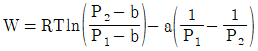
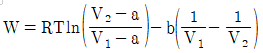
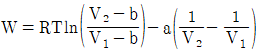
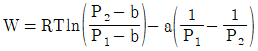
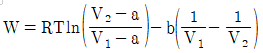
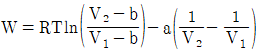
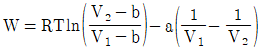 " 이다.
" 이다.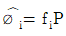
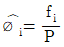
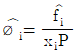
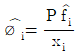
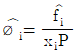 "이다. 이유는 설분의 퓨개시티 계수는 순수한 상태에서의 퓨개시티 계수와 용액 내에서의 몰 분율의 비율로 나타낼 수 있기 때문이다. 따라서, 용액 내에서 한 설분의 퓨개시티 계수는 순수한 상태에서의 퓨개시티 계수와 용액 내에서의 몰 분율의 비율을 곱한 것과 같다. 이를 수식으로 나타내면 øi = fi xi 이다.
"이다. 이유는 설분의 퓨개시티 계수는 순수한 상태에서의 퓨개시티 계수와 용액 내에서의 몰 분율의 비율로 나타낼 수 있기 때문이다. 따라서, 용액 내에서 한 설분의 퓨개시티 계수는 순수한 상태에서의 퓨개시티 계수와 용액 내에서의 몰 분율의 비율을 곱한 것과 같다. 이를 수식으로 나타내면 øi = fi xi 이다.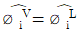 "이 틀린 것은 아니다. 이 조건은 두 성분으로 이루어진 혼합물에서 기체 상태와 액체 상태가 평형을 이루는 경우를 나타내며, 이 때는 두 성분의 활동도 계수와 조성에 따라 평형 압력이 결정된다. 따라서 이 조건은 평형에 대한 올바른 설명이다.
"이 틀린 것은 아니다. 이 조건은 두 성분으로 이루어진 혼합물에서 기체 상태와 액체 상태가 평형을 이루는 경우를 나타내며, 이 때는 두 성분의 활동도 계수와 조성에 따라 평형 압력이 결정된다. 따라서 이 조건은 평형에 대한 올바른 설명이다.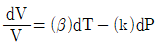
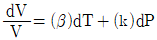
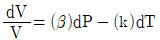
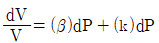
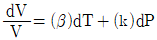 "이다.
"이다.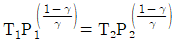
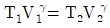
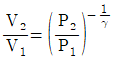
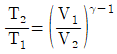
 "이 정답이 된다.
"이 정답이 된다.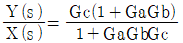
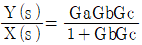
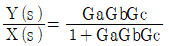
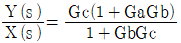
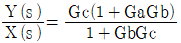 "입니다.
"입니다.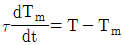
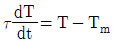
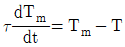
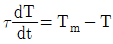
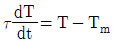 " 이다.
" 이다.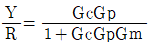
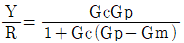
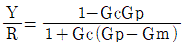
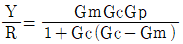
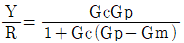 " 이다.
" 이다.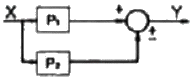

 "이다. 이유는 블록선도에서는 덧셈과 뺄셈을 나타내는 기호로 "+"와 "-"만 사용되기 때문이다. "
"이다. 이유는 블록선도에서는 덧셈과 뺄셈을 나타내는 기호로 "+"와 "-"만 사용되기 때문이다. "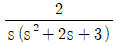
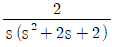
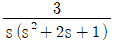
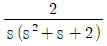
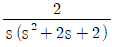 " 이다.
" 이다.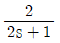 주제어루프 공정:
주제어루프 공정: 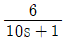 "이 캐스케이드제어를 적용하기에 가장 적합한 동특성을 가진 경우이다.
"이 캐스케이드제어를 적용하기에 가장 적합한 동특성을 가진 경우이다.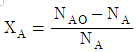
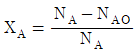
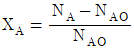
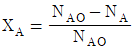
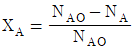 "이다. 이유는 반응속도식에서 전체 반응도수는 k[NA][NB]이므로, A의 전화율은 XA = -d[NA]/dt = k[NA][NB]이다. 따라서, A의 몰수가 감소할수록 전화율이 감소하므로, XA는 시간에 따라 감소하는 함수이다.
"이다. 이유는 반응속도식에서 전체 반응도수는 k[NA][NB]이므로, A의 전화율은 XA = -d[NA]/dt = k[NA][NB]이다. 따라서, A의 몰수가 감소할수록 전화율이 감소하므로, XA는 시간에 따라 감소하는 함수이다.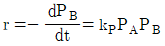
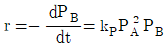
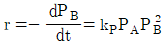
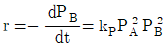
 " 이다. 이유는 반응물 A의 전환율은 반응물 A의 초기 농도와 반응 시간에 의존하며, 반응기의 연결 방법, 순서와는 상관이 없기 때문이다. 따라서 크기가 같은 PFR과 MFR을 연결하여 반응을 실행하더라도, 반응물 A의 전환율은 동일하다.
" 이다. 이유는 반응물 A의 전환율은 반응물 A의 초기 농도와 반응 시간에 의존하며, 반응기의 연결 방법, 순서와는 상관이 없기 때문이다. 따라서 크기가 같은 PFR과 MFR을 연결하여 반응을 실행하더라도, 반응물 A의 전환율은 동일하다.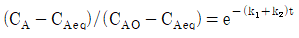
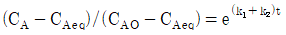
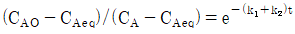
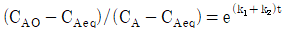
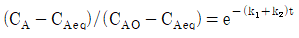 "이 정답이다.
"이 정답이다.

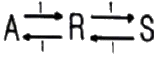
 "이 정답인 이유는 미소와 눈이 반짝이는 표현으로 인해 기쁨을 나타내기 때문입니다. 다른 보기들은 "
"이 정답인 이유는 미소와 눈이 반짝이는 표현으로 인해 기쁨을 나타내기 때문입니다. 다른 보기들은 " "은 무표정, "
"은 무표정, " "은 슬픔, "
"은 슬픔, " "은 분노를 나타내는 표현입니다.
"은 분노를 나타내는 표현입니다.
카르노사이클은 열역학에서 가장 효율적인 열기계 사이클 중 하나로, 열을 일정한 온도에서 흡수하고 방출하는 과정을 반복하여 일정한 열차를 얻는 것을 목표로 합니다. 이 사이클은 네 개의 단계로 이루어져 있습니다.
1. 등온팽창: 열을 흡수하여 온도가 일정한 상태에서 가스가 팽창합니다.
2. 등온압축: 가스를 압축하여 일정한 온도를 유지합니다.
3. 단열팽창: 가스를 팽창시켜 온도가 낮아지게 합니다.
4. 단열압축: 가스를 압축하여 열을 방출합니다.
이 중에서도 등온팽창과 등온압축은 가장 중요한 단계입니다. 이 단계에서 가스는 열을 흡수하거나 방출하면서 일정한 온도를 유지합니다. 이것이 가능한 이유는 열을 흡수하거나 방출하는 과정에서 가스와 주변 환경 사이에 열 전달이 완전히 이루어지기 때문입니다. 이러한 과정을 가역과정이라고 합니다.
따라서, 카르노사이클의 가역 순서는 등온팽창 → 등온압축 → 단열팽창 → 단열압축입니다.