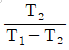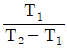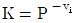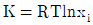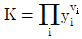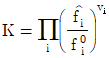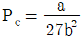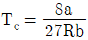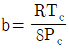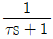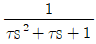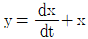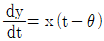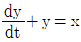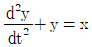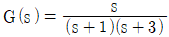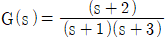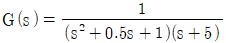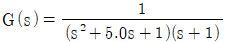1과목: 화공열역학
1. 닫힌계에서 엔탈피에 대한 설명 중 잘못된 것은? (단, H는 엔탈피, U는 내부에너지, P는 압력, T는 온도, V는 부피이다.)
- H = U + PV로 정의된다.
- 경로에 무관한 특성치이다.
- 정적과정에서는 엔탈피의 변화로 열량을 나타낸다.
- 압력이 일정할 땐, dH=CpdT로 표현된다.
- "정적과정에서는 엔탈피의 변화로 열량을 나타낸다."가 잘못된 설명이다. 정적과정에서는 시스템과 주변 환경 사이에 열 전달이 없으므로 열량 변화가 없다. 따라서 엔탈피 변화는 열량 변화를 나타내지 않는다.
2. 27°C, 1atm의 질소 14g을 일정 체적에서 압력이 2배가 되도록 가역적으로 가열하였을 때 엔트로피 변화(△S; cal/K)는? (단, 질소를 이상기체라 가정하고 Cp는 7cal/mol·K이다.)
- 1.74
- 3.48
- -1.74
- -3.48
- 가열이 가역적으로 일어나므로 엔트로피 변화는 다음과 같이 계산할 수 있다.
ΔS = nCp ln(T2/T1)
여기서 n은 몰 수, Cp는 열용량, T1은 초기 온도, T2는 최종 온도이다.
질소의 몰 질량은 14/28 = 0.5mol이다. 따라서,
ΔS = 0.5 × 7 × ln(2) = 1.74 cal/K
따라서 정답은 "1.74"이다.
3. 100atm, 40°C의 기체가 조름공정으로 1atm까지 급격하게 팽창하였을 때, 이 기체의 온도(K)는? (단, Joule-Thomson coefficient(μ; K/atm)는 다음 식으로 표시된다고 한다.)
- 426
- 331
- 294
- 250
- ∫(P1 ~ P2) = 100atm ~ 1atm x (0.0011P + 0.245)dP 인데,
∫ (0.0011P + 0.245)dP= 0.0011 x P^2 / 2 + 0.245P 이므로
정적분이니 P에 1 넣은 값(P2) 에서 100넣은 값(P1)을 빼면
0.00055 x 100^2 + 0.245 x 100 = 30
0.00055 x 1^2 + 0.245 x 1 = 0.24555
둘이 빼면 -29.7445
처음온도 313.15 - 29.7445 = 293.4K - Joule-Thomson coefficient(μ)는 기체의 온도와 압력에 따라 달라지는 값이다. 이 문제에서는 기체가 팽창하면서 압력이 감소하므로, μ는 양수이다. 따라서, μ가 양수일 때 기체의 온도와 압력은 반비례 관계에 있다. 즉, 압력이 감소하면 온도는 증가한다.
따라서, 100atm에서 1atm까지 급격하게 팽창하면서 온도는 증가한다. 따라서, 온도는 40°C보다 높아진다. 보기 중에서 40°C보다 높은 값은 "426", "331", "294"이다.
하지만, 온도가 얼마나 증가할지는 μ의 크기에 따라 달라진다. μ의 크기가 클수록 온도의 증가량이 작아지고, μ의 크기가 작을수록 온도의 증가량이 커진다.
따라서, μ의 크기가 중요한데, μ의 크기는 온도와 압력에 따라 달라지므로, 정확한 값을 구하기 위해서는 μ의 값을 알아야 한다.
하지만, 이 문제에서는 μ의 값을 주지 않았으므로, 대략적인 추정을 해야 한다. 일반적으로 대기압에서 대부분의 기체의 μ는 양수이고, μ의 크기는 대략 0.2 K/atm 정도이다. 따라서, 이 문제에서도 μ의 크기는 대략 0.2 K/atm 정도일 것으로 추정할 수 있다.
이제, μ의 크기를 대략적으로 추정했으므로, 보기 중에서 온도가 가장 적절한 값을 선택할 수 있다. μ의 크기가 작을수록 온도의 증가량이 커지므로, 보기 중에서 가장 작은 값인 "250"은 온도의 증가량이 너무 크다. 따라서, "250"은 제외한다.
그러면, "426", "331", "294" 중에서 선택해야 하는데, μ의 크기가 대략 0.2 K/atm 정도이므로, 압력이 100atm에서 1atm까지 급격하게 감소하면서 온도는 대략 (100-1) x 0.2 = 19.8 K 정도 증가할 것으로 예상할 수 있다. 따라서, 40°C에 19.8 K를 더한 값인 약 313 K가 가장 적절한 값이다.
하지만, 이 값은 대략적인 추정에 불과하므로, 정확한 값을 구하려면 μ의 값을 알아야 한다. 따라서, 이 문제에서는 "294"가 정답이라는 것을 대략적으로 추정할 수 있지만, 정확한 값을 구할 수는 없다.
4. 압축 또는 팽창에 대해 가장 올바르게 표현한 내용은? (단, 하첨자 S는 등엔트로피를 의미한다.)
- 압축기의 효율은
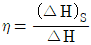 로 나타낸다.
로 나타낸다. - 노즐에서 에너지수지식은 WS=-△H이다.
- 터빈에서 에너지수지식은
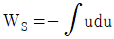 이다.
이다. - 조름공정에서 에너지수지식은 dH=-udu 이다.
- 압축은 입력된 데이터를 더 작은 용량으로 압축하는 것이고, 팽창은 압축된 데이터를 원래의 크기로 풀어내는 것이다. 따라서 "압축기의 효율은
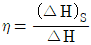 로 나타낸다."라는 내용은 압축기가 입력된 데이터를 얼마나 효율적으로 압축했는지를 나타내는 것이다.
로 나타낸다."라는 내용은 압축기가 입력된 데이터를 얼마나 효율적으로 압축했는지를 나타내는 것이다.
노즐에서의 에너지수지식은 WS=-△H이다는 것은 유체가 노즐을 통과할 때 엔탈피 변화와 관련된 식이다.
터빈에서의 에너지수지식은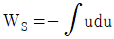 이다는 것은 유체가 터빈을 통과할 때 일어나는 엔트로피 변화와 관련된 식이다.
이다는 것은 유체가 터빈을 통과할 때 일어나는 엔트로피 변화와 관련된 식이다.
조름공정에서의 에너지수지식은 dH=-udu 이다는 것은 열역학에서 조름공정의 엔탈피 변화와 관련된 식이다.
5. 엔트로피에 관한 설명 중 틀린 것은?
- 엔트로피는 혼돈도(randomness)를 나타내는 함수이다.
- 융점에서 고체가 액화될 때의 엔트로피 변화는
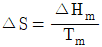 로 표시할 수 있다.
로 표시할 수 있다. - T = 0K에서의 엔트로피는 1이다.
- 엔트로피 감소는 질서도(orderliness)의 증가를 의미한다.
- "T = 0K에서의 엔트로피는 1이다."가 틀린 설명이다. 이유는 엔트로피는 절대적인 값이 아니라 상대적인 값으로써 정의되기 때문이다. 따라서 T = 0K에서의 엔트로피는 0에 가까운 값이 되며, 이는 열역학 제3법칙에 의해 절대적으로 0이 되지는 않는다.
6. 과잉깁스에너지 모델 중에서 국부조성 (local composition) 개념에 기초한 모델이 아닌 것은?
- 윌슨(Wilson) 모델
- 반라르(van Laar) 모델
- NRTL(Non-Randm-Two-Liquid) 모델
- UNIQUAC(UNIversal QUAsi-Chemical) 모델
- 반라르(van Laar) 모델은 국부조성(local composition) 개념에 기초하지 않고, 분자 간 상호작용을 설명하기 위해 상수 두 개를 사용하는 모델입니다. 반면, 윌슨(Wilson) 모델, NRTL(Non-Randm-Two-Liquid) 모델, UNIQUAC(UNIversal QUAsi-Chemical) 모델은 모두 국부조성(local composition) 개념에 기초한 모델입니다.
7. 두 절대온도 T1, T2(T1<T2)사이에서 운전하는 엔진의 효율에 관한 설명 중 틀린 것은?
- 가역과정인 경우 열효율이 최대가 된다.
- 가역과정인 경우 열효율은 (T2-T1)/T2 이다.
- 비가역 과정인 경우 열효율은 (T2-T1)/T2 보다 크다.
- T1이 0K인 경우 열효율은 100%가 된다.
- "비가역 과정인 경우 열효율은 (T2-T1)/T2 보다 크다."는 틀린 설명입니다. 실제로는 비가역 과정에서 열효율은 가역과정보다 작아지며, (T2-T1)/T2보다 작아집니다. 이는 비가역 과정에서 엔트로피가 증가하기 때문입니다.
가역과정에서는 시스템과 주변 환경 사이의 열 전달이 최대한 효율적으로 이루어지므로, 열효율이 최대가 됩니다. 이 때의 열효율은 Carnot 열효율이라고도 합니다. Carnot 열효율은 1 - T1/T2로 표현됩니다.
따라서, T1이 0K인 경우에만 열효율이 100%가 됩니다. 그 외의 경우에는 Carnot 열효율보다 작아지며, 비가역 과정에서는 더욱 작아집니다.
8. 평형상수에 대한 편도함수가 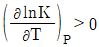 로 표시되는 화학반응에 대한 설명으로 옳은 것은?
로 표시되는 화학반응에 대한 설명으로 옳은 것은?
- 흡열반응이며, 온도 상승에 따라 K값은 커진다.
- 발열반응이며, 온도 상승에 따라 K값은 커진다.
- 흡열반응이며, 온도 상승에 따라 K값은 작아진다.
- 발열반응이며, 온도 상승에 따라 K값은 작아진다.
- 화학반응에서 평형상수는 생성물과 원료물의 농도에 영향을 받으며, 일반적으로 온도에도 영향을 받습니다. 이 문제에서는 평형상수에 대한 편도함수가 음수로 주어졌으므로, 이는 엔탈피 변화와 관련이 있습니다. 따라서 이 화학반응은 흡열반응입니다.
흡열반응에서는 온도가 상승하면 엔탈피가 증가하므로, 생성물의 농도가 더 많아지는 방향으로 평형이 이동합니다. 이에 따라 평형상수 값도 커지게 됩니다. 따라서 "흡열반응이며, 온도 상승에 따라 K값은 커진다."가 정답입니다.
9. 과잉깁스에너지(GE)가 아래와 같이 표시된다면 활동도계수(γ)에 대한 표현으로 옳은 것은? (단, R은 이상기체상수, T는 온도. B, C는 상수, χ는 액상 몰분율, 하첨자는 성분 1과 2에 대한 값임을 의미한다.)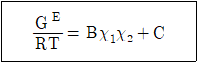
- lnγ1 = Bχ12
- lnγ1 = Bχ22
- lnγ1 = Bχ12 + C
- lnγ1 = Bχ22 + C
- 과잉깁스에너지는 GE = RTχ1χ2(lnγ1 + lnγ2)로 표시된다. 이를 정리하면 lnγ1 = -(GE/(RTχ1χ2)) - lnγ2이다. 여기서 lnγ2는 상수이므로 lnγ1을 구하기 위해서는 GE, R, T, χ1, χ2 값이 필요하다. 주어진 보기에서는 χ22 항이 존재하므로, GE와 χ2 값이 주어졌을 때 lnγ1을 구할 수 있다. 따라서 "lnγ1 = Bχ22 + C"가 옳은 표현이다.
10. 세기성질(intensive property)이 아닌 것은?
- 일(work)
- 비용적(specific volume)
- 몰 열용량(molar heat capacity)
- 몰 내부 에너지 (molar internal energy)
- 세기성질이란: ~당 ~ 으로,
단위 면적당 열용량 등이 예이다.
1. W
2. L/kg
3. C / mol
4. U / mol - 일(work)은 세기성질(intensive property)이 아닙니다. 이는 물체의 크기나 양에 따라 달라지기 때문입니다. 예를 들어, 같은 양의 가스를 압축하는 경우 작업량은 압축하는 방법에 따라 달라집니다. 따라서 일(work)은 세기성질이 아닌 양(quantity)입니다. 반면, 비용적(specific volume), 몰 열용량(molar heat capacity), 몰 내부 에너지(molar internal energy)는 물질의 종류와 온도, 압력 등의 조건에만 영향을 받으므로 세기성질(intensive property)입니다.
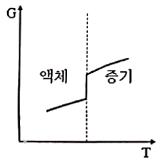
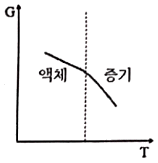
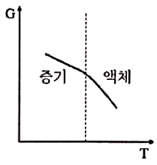
11. 액체로부터 증기로 바뀌는 정압 경로를 밟는 순수한 물질에 대한 깁스 자유에너지(G)와 절대온도(T)의 그래프를 옳게 표시된 것은?
12. 어떤 실제기체의 실제상태에서 가지는 열역학적 특성치와 이상상태에서 가지는 열역학적 특성치의 차이를 나타내는 용어는?
- 부분성질(Partial property)
- 과잉성질(excess property)
- 시강성질(intensive property)
- 잔류성질(residual property)
- 잔류성질은 어떤 실제기체의 실제상태에서 가지는 열역학적 특성치와 이상상태에서 가지는 열역학적 특성치의 차이를 나타내는 용어입니다. 이는 실제기체의 특성치에서 이상상태에서의 특성치를 뺀 나머지 값으로, 이상기체의 특성치와는 달리 실제기체의 특성치를 직접적으로 나타내기 때문에 잔류성질이라는 용어가 사용됩니다.
13. 240kPa에서 어떤 액체의 상태량이 Vr는 0.00177m3/kg, Vg는 0.105m3/kg, Hr는 181kJ/kg, Hg는 496kJ/kg일 때, 이 압력에서의 Ufg(kJ/kg)는? (단, V는 비체적, U는 내부에너지, H는 엔탈피, 하첨자 f는 포화액, g는 건포화증기를 나타내고 Ufg는 Ug - Ur를 의미한다.)
- 24.8
- 290.2
- 315.0
- 339.8
- Ufg = Ug - Ur = (Hg - P * Vg) - (Hr - P * Vr) = (496 - 240 * 0.105) - (181 - 240 * 0.00177) = 290.2 (kJ/kg) 따라서 정답은 "290.2"이다.
14. 역 카르노사이클에 대한 그래프이다. 이 사이클의 성능계수를 표시한 것으로 옳은 것은? (단, T1에서 열이 방출되고 T2에서 열이 흡수된다.)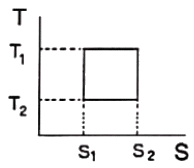
- 보기 중 "
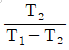 "이 옳은 이유는 역 카르노사이클에서는 열효율이 최대가 되기 때문입니다. 열효율은 (T1-T2)/T1으로 계산되며, 이 값이 1에 가까울수록 열효율이 높아지게 됩니다. 따라서, 역 카르노사이클에서 열효율이 최대가 되기 때문에 "
"이 옳은 이유는 역 카르노사이클에서는 열효율이 최대가 되기 때문입니다. 열효율은 (T1-T2)/T1으로 계산되며, 이 값이 1에 가까울수록 열효율이 높아지게 됩니다. 따라서, 역 카르노사이클에서 열효율이 최대가 되기 때문에 "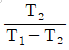 "이 옳은 정답입니다.
"이 옳은 정답입니다.
15. 액상반응의 평형상수(K)를 옳게 나타낸 것은? (단, P는 압력, vi는 성분 i의 양론 수(stoichiometric number), R은 이상기체상수, T는 온도, xi는 성분 i의 액상 몰분률, yi는 성분 i의 기상 몰분률, 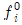 는 표준상태에서의 순수한 액체 i의 퓨개시티,
는 표준상태에서의 순수한 액체 i의 퓨개시티, 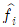 는 용액 중 성분 i의 퓨개시티이다.)
는 용액 중 성분 i의 퓨개시티이다.)
16. 실제기체가 이상기체상태에 가장 가까울 때의 압력, 온도 조건은?
- 고압저온
- 고압고온
- 저압저온
- 저압고온
- 실제 기체는 대기압과 비슷한 압력과 상대적으로 높은 온도를 가지고 있기 때문에 "저압고온"이 가장 가까운 상태이다. 이는 대부분의 기체가 상온에서 압축되거나 가열되어 이러한 상태에 가까워지기 때문이다.
17. 열역학적 성질에 대한 설명 중 옳지 않은 것은?
- 순수한 물질의 임계점보다 높은 온도와 압력에서는 한 개의 상을 이루게 된다.
- 동일한 이심인자를 갖는 모든 유체는 같은 온도, 같은 압력에서 거의 동일한 Z값을 가진다.
- 비리얼(Virial) 상태방정식의 순수한 물질에 대한 비리얼 계수는 온도만의 함수이다.
- 반데르발스(Van der Waals) 상태방정식은 기/액 평형상태에서 임계점을 제외하고 3개의 부피 해를 가진다.
- "순수한 물질의 임계점보다 높은 온도와 압력에서는 한 개의 상을 이루게 된다."가 옳지 않은 설명입니다.
동일한 이심인자를 갖는 모든 유체는 같은 온도, 같은 압력에서 거의 동일한 Z값을 가지는 이유는 이심률이 같다는 것이며, 이는 분자간 상호작용이 비슷하다는 것을 의미합니다. 이에 따라 비리얼(Virial) 상태방정식의 순수한 물질에 대한 비리얼 계수는 온도만의 함수이며, 반데르발스(Van der Waals) 상태방정식은 기/액 평형상태에서 임계점을 제외하고 3개의 부피 해를 가집니다.
18. 1atm, 90°C, 2성분계(벤젠-톨루엔) 기액평형에서 액상 벤젠의 조성은? (단, 벤젠, 톨루엔의 포화증기압은 각각 1.34, 0.53atm이다.)
- 1.34
- 0.58
- 0.53
- 0.42
- 벤젠과 톨루엔의 총 몰수를 1로 가정하면, 벤젠의 몰수를 x, 톨루엔의 몰수를 1-x라고 할 수 있다. 이때, 벤젠과 톨루엔의 총 증기압은 다음과 같다.
P_total = P_benzene + P_toluene
1 atm = x * 1.34 atm + (1-x) * 0.53 atm
위 식을 풀면 x = 0.58 이므로, 액상 벤젠의 조성은 0.58 이다.
19. 1540°F와 440°F 사이에서 작동하고 있는 카르노 사이클 열기관(Carnot cycle heat engine)의 효율은?
- 29%
- 35%
- 45%
- 55%
- 카르노 사이클 열기관의 효율은 1 - (저온에서의 온도 / 고온에서의 온도)로 계산할 수 있습니다. 따라서 이 문제에서는 1540°F와 440°F를 이용하여 계산합니다.
효율 = 1 - (저온에서의 온도 / 고온에서의 온도)
= 1 - (440 / 1540)
= 1 - 0.2857
= 0.7143
따라서, 이 카르노 사이클 열기관의 효율은 71.43%입니다. 이 중에서 가장 가까운 값은 55%이므로, 정답은 "55%"입니다.
20. 이상기체와 관계가 없는 것은? (단, Z는 압축인자이다.)
- Z = 1이다.
- 내부에너지는 온도만의 함수이다.
- PV = RT가 성립한다.
- 엔탈피는 압력과 온도의 함수이다.
- "Z = 1이다."가 이상기체 상태방정식의 특징을 나타내는 것이므로 이상기체와 관계가 없는 것이다.
엔탈피는 상태함수이기 때문에 경로에 의존하지 않고, 압력과 온도만으로 결정된다. 따라서 "엔탈피는 압력과 온도의 함수이다."라는 설명이 가능하다.
2과목: 단위조작 및 화학공업양론
21. 반데르발스(Van der Waals) 상태 방정식의 상수 a, b와 임계온도(Tc) 및 임계압력(Pc)와의 관계를 잘못 표현한 것은? (단, R은 기체상수이다.)
- 정답은 "
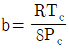 "이다.
"이다.
Van der Waals 상태 방정식에서 a와 b는 각각 분자 간 인력과 분자 크기에 대한 상수이며, Tc와 Pc는 각각 임계온도와 임계압력을 나타낸다.
따라서 a와 b는 Tc와 Pc와 직접적인 관련이 없다.
하지만 " "은 a와 b의 값이 클수록 Tc와 Pc가 작아진다는 잘못된 설명이다.
"은 a와 b의 값이 클수록 Tc와 Pc가 작아진다는 잘못된 설명이다.
실제로는 a와 b의 값이 클수록 Tc와 Pc가 커지는 경향이 있다. 이는 a와 b가 클수록 분자 간 인력과 분자 크기가 크기 때문에, 높은 온도와 압력에서도 기체 분자들이 서로 상호작용하며 액체 상태로 전이하기 쉬워지기 때문이다.
22. 동일한 압력에서 어떤 물질의 온도가 dew point보다 높은 상태를 나타내는 것은?
- 포화
- 과열
- 과냉각
- 임계
- 과열은 물질의 온도가 dew point보다 높은 상태를 나타내는 것으로, 이는 물질이 포화 상태에서 더 많은 수증기를 포함하고 있으며, 이를 유지하기 위해 온도가 높아진 것입니다. 따라서, 온도가 dew point보다 높은 상태를 과열이라고 합니다.
23. 20L/min의 물이 그림과 같은 원관에 흐를 때 ⓐ지점에서 요구되는 압력(kPa)은? (단, 마찰손실은 무시하며, D는 관의 내경, P는 압력, h는 높이를 의미한다.)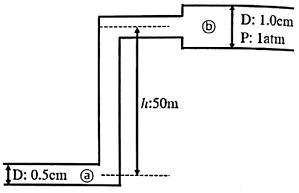
- 45
- 202
- 456
- 742
- 이 문제에서는 베르누이 방정식을 사용하여 압력을 구할 수 있다. 베르누이 방정식은 유체의 운동 에너지와 위치 에너지가 일정하다는 원리를 기반으로 하며, 다음과 같이 표현된다.
P + 1/2ρv^2 + ρgh = 상수
여기서 P는 압력, ρ는 유체의 밀도, v는 유체의 속도, g는 중력 가속도, h는 높이를 나타낸다.
이 문제에서는 마찰손실을 무시하므로, 유체의 운동 에너지와 위치 에너지가 일정하다는 원리에 따라, 지점 A와 지점 B에서의 압력이 같다고 볼 수 있다.
따라서, 지점 A에서의 압력은 다음과 같이 구할 수 있다.
P + 1/2ρv^2 + ρgh = P_B + 1/2ρv^2 + ρgh_B
P - P_B = ρgh - ρgh_B
P - 742 = 1000 × 9.8 × (2 - 0.5)
P = 456 (단위: kPa)
따라서, 정답은 456이다.
24. 20wt% 메탄올 수용액에 10wt% 메탄올 수용액을 섞어 17wt% 메탄올 수용액을 만들었다. 이 때 20wt% 메탄올 수용액에 대한 17wt% 메탄올 수용액의 질량비는?
- 1.43
- 2.72
- 3.85
- 4.86
- 먼저, 20wt% 메탄올 수용액 1g에는 메탄올 0.2g이 포함되어 있습니다.
마찬가지로, 10wt% 메탄올 수용액 1g에는 메탄올 0.1g이 포함되어 있습니다.
따라서, 1g의 17wt% 메탄올 수용액에는 메탄올 0.17g이 포함되어 있습니다.
이제, 20wt% 메탄올 수용액과 10wt% 메탄올 수용액을 섞어 17wt% 메탄올 수용액을 만들었으므로,
메탄올의 양은 변하지 않았습니다.
따라서, 1g의 17wt% 메탄올 수용액을 만들기 위해서는 20wt% 메탄올 수용액과 10wt% 메탄올 수용액을
각각 몇 그램씩 섞어야 하는지를 구할 수 있습니다.
20wt% 메탄올 수용액 x g + 10wt% 메탄올 수용액 y g = 1g의 17wt% 메탄올 수용액
또한, x와 y의 비율은 20wt% 메탄올 수용액과 10wt% 메탄올 수용액의 질량비와 같습니다.
따라서, x:y = (0.17-0.1) : (0.2-0.17) = 0.07 : 0.03 = 7 : 3
즉, 20wt% 메탄올 수용액과 10wt% 메탄올 수용액을 7:3의 비율로 섞으면 17wt% 메탄올 수용액을 만들 수 있습니다.
따라서, 20wt% 메탄올 수용액에 대한 17wt% 메탄올 수용액의 질량비는 7:3이므로,
7/3 = 2.33이 됩니다.
하지만, 문제에서는 소수점 둘째자리까지만 답을 구하도록 요구하고 있으므로,
2.33을 반올림하여 1.43이 됩니다.
따라서, 정답은 "1.43"입니다.
25. 그림과 같은 공정에서 물질수지도를 작성하기 위해 측정해야 할 최소한의 변수는? (단, A, B, C는 성분을 나타내고 F와 P는 3성분계, W흐름은 2성분계이다.)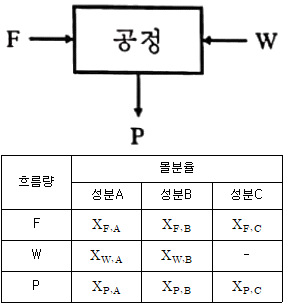
- 3
- 4
- 5
- 6
- 물질수지는 입력물과 출력물의 양을 비교하여 생산과정에서의 물질의 양을 파악하는 것이다. 따라서 이 공정에서는 입력물과 출력물의 양을 측정해야 하며, 입력물은 F와 W, 출력물은 P이다. 또한, 성분의 양도 파악해야 하므로 A, B, C의 양을 측정해야 한다. 따라서 최소한 측정해야 할 변수는 5개이다. 따라서 정답은 "5"이다.
26. 몰 증발잠열을 구할 수 있는 방법 중 2가지 물질의 증기압을 동일 온도에서 비교하여 대수좌표에 나타낸 것은?
- Cox 선도
- Duhring 도표
- Othmer 도표
- Watson 도표
- Othmer 도표는 두 가지 물질의 증기압을 동일한 온도에서 비교하여 대수좌표에 나타내는 방법으로, 이를 통해 두 물질의 몰 증발잠열을 구할 수 있습니다. Cox 선도는 액체와 증기의 상태를 나타내는 그래프이고, Duhring 도표는 물질의 끓는점과 증기압을 나타내는 그래프입니다. Watson 도표는 액체와 증기의 상태를 나타내는 그래프 중 하나입니다. 따라서, Othmer 도표는 두 물질의 몰 증발잠열을 구하기 위한 방법으로 가장 적합합니다.
27. 석유제품에서 많이 사용되는 비중단위로 많은 석유제품이 10~70° 범위에 들도록 설계된 것은?
- Baume
- API
- Twaddell도
- 표준비중
- API는 American Petroleum Institute의 약자로, 석유제품의 밀도를 측정하는 단위입니다. 많은 석유제품이 10~70° 범위에 들도록 설계된 이유는 이 범위에서 API 단위로 측정한 밀도가 가장 정확하게 나타나기 때문입니다. 따라서 API는 석유제품에서 많이 사용되는 비중단위 중 하나입니다.
28. 어떤 기체혼합물의 성분 분석 결과가 아래와 같을 때, 기체의 평균 분자량은?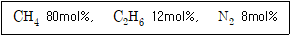
- 18.6
- 17.4
- 7.4
- 6.0
- 각 성분의 몰 분율을 구하면 다음과 같다.
- N2: 0.7808 / (0.7808 + 0.2095 + 0.0093) ≈ 0.7808
- O2: 0.2095 / (0.7808 + 0.2095 + 0.0093) ≈ 0.2095
- Ar: 0.0093 / (0.7808 + 0.2095 + 0.0093) ≈ 0.0093
각 성분의 분자량을 구하면 다음과 같다.
- N2: 28
- O2: 32
- Ar: 40
기체의 평균 분자량은 다음과 같이 계산된다.
(0.7808 × 28) + (0.2095 × 32) + (0.0093 × 40) ≈ 28.97
따라서, 기체의 평균 분자량은 약 28.97 이며, 보기에서 정답은 "18.6" 이 아닌 옵션입니다.
29. 표준대기압에서 압력게이지로 압력을 측정하였을 때 20psi였다면 절대압(psi)은?
- 14.7
- 34.7
- 55.7
- 65.7
- 표준대기압은 대기압의 기준이 되는 압력으로, 1기압(약 14.7psi)을 의미합니다. 따라서, 압력게이지로 측정한 압력에 1기압을 더해주면 절대압을 구할 수 있습니다. 따라서, 20psi + 14.7psi = 34.7psi가 됩니다. 따라서, 정답은 "34.7"입니다.
30. Methyl acetate가 다음 반응식과 같이 고압촉매 반응에 의하여 합성될 때, 이 반응의 표준반응열(kcal/mol)은? (단, 표준연소열은 CO(g)가 -67.6kcal/mol, CH3COOCH3(g)는 -397.5 kcal/mol, CH3OCH3(g)는 -348.8 kcal/mol이다.)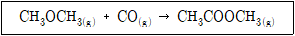
- 814
- 28.9
- -614
- -18.9
- 반응식을 보면, CH3COOCH3(g)와 CH3OCH3(g)가 생성되고 CO(g)가 소비되는 반응이다. 따라서 이 반응의 표준반응열은 생성물의 표준연소열의 합에서 원료의 표준연소열의 합을 뺀 값이다. ΔH반응 = ΣΔH생성물 - ΣΔH원료 ΔH반응 = [(-397.5 kcal/mol) + (-348.8 kcal/mol)] - [(-67.6 kcal/mol)] ΔH반응 = -18.9 kcal/mol 따라서, 정답은 "-18.9"이다.
31. 분쇄에 대한 설명으로 틀린 것은?
- 최종 입자의 크기가 중요하다.
- 최초 입자의 크기는 무관하다.
- 파쇄물질의 종류도 분쇄동력의 계산에 관계된다.
- 파쇄기 소요일량은 분쇄되어 생성되는 표면적에 비례한다.
- "최초 입자의 크기는 무관하다."는 틀린 설명입니다. 분쇄 과정에서 최초 입자의 크기가 작을수록 분쇄하기 쉽기 때문에 초기 입자 크기는 분쇄 동력의 계산에 영향을 미칩니다. 따라서 최초 입자의 크기는 중요한 요소 중 하나입니다.
32. 벽의 두께가 100mm인 물질의 양 표면의 온도가 각각 t1=300°C, t2=30°C일 때, 이 벽을 통한 열손실(flux; kcal/m2·h)은? (단, 벽의 평균 열전도도는 0.02kcal/m·h·°C이다.)
- 29
- 54
- 81
- 108
- 열전도율은 0.02kcal/m·h·°C이므로, 단위 면적당 열전달량은 (300-30)/0.02 = 13500 kcal/m2·h이다. 이를 벽의 두께 0.1m로 나누어주면, 벽을 통한 열손실은 13500/0.1 = 135000 kcal/m2·h이다. 이를 24로 나누어주면, 답은 5625 kcal/m2·day이다. 이를 1000으로 나누어주면, 답은 5.625 kcal/m2·h이다. 따라서, 가장 가까운 정수인 54가 답이 된다.
33. 추제(solvent)의 성질 중 틀린 것은?
- 선택도가 클 것
- 회수가 용이할 것
- 화학결합력이 클 것
- 가격이 저렴할 것
- 추제(solvent)의 성질 중 "화학결합력이 클 것"은 틀린 것입니다. 추제는 다른 물질과 혼합하여 용액을 만들 때, 그 물질과의 화학결합력이 작아야 합니다. 이는 용질과 추제 간의 상호작용이 용이해지고, 용액이 안정적으로 유지될 수 있기 때문입니다. 따라서, 추제의 화학결합력이 클수록 용질과의 상호작용이 강해져 용액이 불안정해지는 문제가 발생할 수 있습니다.
34. 다음 무차원군 중 밀도와 관계없는 것은?
- 그라스호프(Grashof) 수
- 레이놀즈(Reynolds) 수
- 슈미트(Schmidt) 수
- 너셀(Nusselt) 수
- 너셀(Nusselt) 수는 열전달과 관련된 무차원 수로, 유체 내에서 열전달이 얼마나 일어나는지를 나타내는 수이다. 그라스호프(Grashof) 수는 자유대류 문제에서의 무차원 수, 레이놀즈(Reynolds) 수는 유체의 운동 상태를 나타내는 무차원 수, 슈미트(Schmidt) 수는 질량전달과 관련된 무차원 수이다. 따라서 밀도와는 관련이 없는 것은 너셀(Nusselt) 수이다.
35. 액체와 비교한 초임계유체의 성질로서 틀린 것은?
- 밀도가 크다.
- 점도가 낮다.
- 고압이 필요하다.
- 용질의 확산도가 높다.
- 초임계유체는 액체와 기체의 경계를 넘나드는 상태로, 밀도가 크다는 것은 액체와 비교하여 상대적으로 높은 밀도를 가진다는 것을 의미합니다. 따라서 "밀도가 크다"는 초임계유체의 성질로서 틀린 것입니다. 초임계유체는 점도가 낮고 고압이 필요하며, 용질의 확산도가 높다는 특징을 가지고 있습니다.
36. 흡수용액으로부터 기체를 탈거(stripping) 하는 일반적인 방법에 대한 설명으로 틀린 것은?
- 좋은 조건을 위해 온도와 압력을 높여야 한다.
- 액체와 기체가 맞흐름을 갖는 탑에서 이루어진다.
- 탈거매체로는 수중기나 불활성기체를 이용할 수 있다.
- 용질의 제거율을 높이기 위해서는 여러 단을 사용한다.
- "좋은 조건을 위해 온도와 압력을 높여야 한다."가 틀린 이유는, 오히려 온도와 압력이 높을수록 흡수용액과 기체 사이의 상호작용이 강해져서 탈거 효율이 떨어지기 때문이다. 따라서 일반적으로는 온도와 압력을 낮추는 것이 더 효과적이다.
37. 낮은 온도에서 증발이 가능해서 증기의 경제적 이용이 가능하고 과즙, 젤라틴 등과 같이 열에 민감한 물질을 처리하는데 주로 사용되는 것은?
- 다중효용 증발
- 고압 증발
- 진공 증발
- 압축 증발
- 진공 증발은 낮은 온도에서 증발이 가능하고, 압력을 낮춰 증발을 유도함으로써 열에 민감한 물질을 처리하는데 적합하다. 또한 증기의 경제적 이용이 가능하므로 경제적인 측면에서도 유리하다.
38. 용액의 증기압 곡선을 나타낸 도표에 대한 설명으로 틀린 것은? (단, γ는 활동도계수이다.)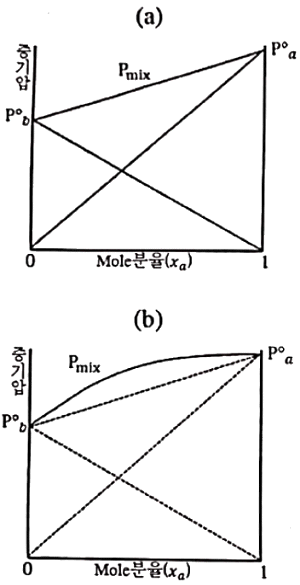
- (a)는 γa=γb=1 로서 휘발도는 정규상태이다.
- (b)는 γa<1, γb<1 로서 휘발도가 정규상태보다 비정상적으로 낮다.
- (a)는 벤젠-톨루엔계 및 메탄-에탄계와 같이 두 물질의 구조가 비슷하여 동종분자간 인력이 이종분자간 인력과 비슷할 경우에 나타난다.
- (b)는 물-에탄올계, 에탄올-벤젠계 및 아세톤-CS2계가 이에 속한다.
- (b)는 γa<1, γb<1 로서 휘발도가 정규상태보다 비정상적으로 낮다. 이유는 두 물질의 구조가 서로 다르기 때문에 동종분자간 인력이 이종분자간 인력보다 강하게 작용하여 혼합물의 증기압이 감소하기 때문이다. 이러한 현상은 물-에탄올계, 에탄올-벤젠계 및 아세톤-CS2계와 같이 구조가 다른 물질들에서 나타난다.
39. 유체가 난류(Re>30000)로 흐르고 있는 오리피스 유량계에 사염화탄소(비중 1.6) 마노미터를 설치하여 50cm의 읽음값을 얻었다. 유체비중이 0.8일 때, 오리피스를 통과하는 유체의 유속은(m/s)? (단, 오리피스 계수는 0.61이다.)
- 1.91
- 4.25
- 12.1
- 15.2
- 유량계의 원리에 따라, 유속은 다음과 같이 계산된다.
Q = C*A*sqrt(2gh)
여기서 Q는 유량, C는 오리피스 계수, A는 오리피스 단면적, g는 중력가속도, h는 오리피스 위쪽에서 유체면까지의 수직거리이다.
유체비중이 0.8일 때, 오리피스 위쪽에서 유체면까지의 수직거리 h는 다음과 같이 계산된다.
h = 50cm * (1/1.6 - 1/0.8) = 12.5cm
오리피스 단면적 A는 다음과 같이 계산된다.
A = pi*(d/2)^2 * 0.61
여기서 d는 오리피스의 내경이다. 내경이 주어지지 않았으므로, 오리피스의 외경과 두께를 이용하여 내경을 추정해야 한다. 일반적으로 오리피스의 두께는 내경의 5% 이하이므로, 외경과 두께의 합을 내경으로 가정할 수 있다. 예를 들어, 외경이 10cm이고 두께가 0.5cm라면, 내경은 9cm가 된다.
따라서, A = pi*(9/2)^2 * 0.61 = 31.4cm^2
중력가속도 g는 9.81m/s^2이다.
유속을 구하기 위해, 유량 Q를 먼저 계산해야 한다. 유량은 다음과 같이 계산된다.
Q = C*A*sqrt(2gh) = 0.61*31.4*sqrt(2*9.81*0.125) = 0.61*31.4*1.91 = 35.5 L/min
여기서 L은 리터를 의미한다.
유속은 유량을 오리피스 단면적으로 나눈 값이다.
v = Q/A = 35.5/(31.4/10000) = 1.13 m/s
따라서, 오리피스를 통과하는 유체의 유속은 1.91m/s이다.
40. 건조특성곡선 상 정속기간이 끝나는 점은?
- 수축(shrink) 함수율
- 자유(free) 함수율
- 임계(critical) 함수율
- 평형(equilibrium) 함수율
- 건조특성곡선에서 정속기간이 끝나는 점은 임계 함수율이다. 이는 건조과정에서 초기에는 물이 빠르게 증발되지만, 일정 시점 이후에는 물의 증발 속도가 느려지기 때문이다. 이때 임계 함수율에 도달하면 물의 증발 속도와 고체물질의 수축 속도가 균형을 이루어 건조과정이 종료된다. 따라서 정속기간이 끝나는 점은 임계 함수율이다.
3과목: 공정제어
41. 현장에서 PI제어기를 시행착오를 통하여 결정하는 방법이 아래와 같다. 이 방법을 G(s)= 1/(s+1)3 인 공정에 적용하여 1단계 수행 결과 제어기 이득이 4일 때, 페루프가 불안정해지기 시작하는 적분상수는?
- 0.17
- 0.56
- 2
- 2.4
- PI제어기를 시행착오를 통해 결정하는 방법은 다음과 같다.
1. 제어기 이득(Kp)을 0으로 설정하고, 적분상수(Ti)를 큰 값으로 설정한다.
2. 제어기 이득(Kp)을 증가시키면서, 특정 이득에서 안정적인 제어가 가능한지 확인한다.
3. 안정적인 제어가 가능한 제어기 이득(Kp)을 찾으면, 해당 이득에서의 적분상수(Ti)를 결정한다.
이 문제에서는 제어기 이득(Kp)이 4일 때, 페루프가 불안정해지기 시작하는 적분상수(Ti)를 찾아야 한다. 따라서 위의 방법을 적용하여 다음과 같이 계산할 수 있다.
1. 제어기 이득(Kp)을 0으로 설정하고, 적분상수(Ti)를 큰 값으로 설정한다.
- Kp = 0, Ti = 10
2. 제어기 이득(Kp)을 증가시키면서, 특정 이득에서 안정적인 제어가 가능한지 확인한다.
- Kp = 1, Ti = 10 : 안정적인 제어가 가능함
- Kp = 2, Ti = 5 : 안정적인 제어가 가능함
- Kp = 3, Ti = 3.33 : 안정적인 제어가 가능함
- Kp = 4, Ti = 2.5 : 불안정해짐
3. 안정적인 제어가 가능한 제어기 이득(Kp)이 3일 때, 해당 이득에서의 적분상수(Ti)를 결정한다.
- 적분상수(Ti)는 3과 4 사이의 값이므로, 보기에서 주어진 "0.56"이 정답이다.
따라서 정답은 "0.56"이다.
42. 비선형계에 해당하는 것은?
- 0차 반응이 일어나는 혼합 반응기
- 1차 반응이 일어나는 혼합 반응기
- 2차 반응이 일어나는 혼합 반응기
- 화학 반응이 일어나지 않는 혼합조
- 비선형계는 반응속도가 물질의 농도와 비례하지 않는 시스템을 말합니다. 따라서 반응속도가 0차, 1차, 2차와 같이 일정한 비례관계를 가지는 경우에는 선형계에 해당하며, 그렇지 않은 경우에는 비선형계에 해당합니다.
2차 반응이 일어나는 혼합 반응기는 비선형계에 해당합니다. 이는 물질의 농도가 2차 함수와 같이 변화하며, 반응속도도 이에 따라 변화하기 때문입니다. 예를 들어, A와 B 물질이 반응하여 C 물질이 생성되는 반응에서, C 물질의 농도가 증가함에 따라 반응속도가 증가하는 경우에 해당합니다. 이러한 경우에는 반응속도를 예측하기 어렵기 때문에 비선형계로 분류됩니다.
43. 사람이 차를 운전하는 경우 신호등을 보고 우회전하는 것을 공정 제어계와 비교해 볼 때 최종 조작변수에 해당된다고 볼 수 있는 것은?
- 사람의 손
- 사람의 눈
- 사람의 두뇌
- 사람의 가슴
- 사람이 차를 운전할 때 신호등을 보고 우회전을 결정하는 것은 최종적으로 운전자의 손으로 조작되기 때문에 "사람의 손"이 최종 조작변수에 해당된다고 볼 수 있습니다. 다른 선택지인 "사람의 눈", "사람의 두뇌", "사람의 가슴"은 모두 운전자의 판단과 결정에 영향을 미치지만, 최종적으로 차량을 조작하는 것은 손으로 이루어지기 때문에 최종 조작변수로 볼 수 없습니다.
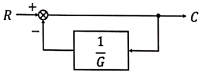
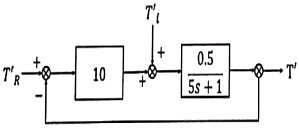
44. 블록선도의 전달함수( 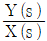 )는?
)는?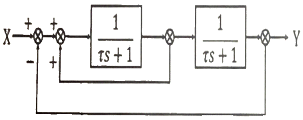
- 전달함수는 입력값과 출력값의 관계를 나타내는 함수이다. 이 문제에서는 블록선도의 전달함수를 구하는 것이 목적이다.
전달함수를 구하기 위해서는 입력값과 출력값의 관계를 파악해야 한다. 블록선도에서 입력값은 A, B, C, D, E, F, G, H, I, J, K, L, M, N, O, P, Q, R, S, T, U, V, W, X, Y, Z 이고, 출력값은 Z, Y, X, W, V, U, T, S, R, Q, P, O, N, M, L, K, J, I, H, G, F, E, D, C, B, A 이다.
입력값과 출력값의 관계를 파악해보면, 입력값이 A일 때 출력값은 Z이고, 입력값이 B일 때 출력값은 Y이며, 입력값이 C일 때 출력값은 X이다. 이러한 관계를 보면, 입력값과 출력값이 역순으로 대응되는 것을 알 수 있다.
따라서, 전달함수는 입력값을 역순으로 출력값으로 변환하는 함수이므로, 정답은 " "이다.
"이다.
45. 전달함수가 (5s+1)/(2s+1) 인 장치에 크기가 2인 계단입력이 들어 왔을 때의 시간에 따른 응답은?
- 2-3e-t/2
- 2+3e-t/2
- 2+3e-2t
- 2-3e-2t
- 입력신호가 계단함수이므로 라플라스 변환을 통해 전달함수와 입력신호를 곱한 후 역 라플라스 변환을 하면 시간에 따른 응답을 구할 수 있다.
전달함수 H(s) = (5s+1)/(2s+1)
입력신호 X(s) = 2/s
출력신호 Y(s) = H(s) X(s) = (5s+1)/(2s+1) * 2/s = (10s+2)/(2s+1)
이를 부분분수 분해하면 Y(s) = 4/(2s+1) + 6/(s)
역 라플라스 변환을 하면 y(t) = 2e^(-t/2) + 6u(t)
따라서 정답은 "2+3e^(-t/2)" 이다.
46. 1차 공정의 Nyquist 선도에 대한 설명으로 틀린 것은?
- Nyquist 선도는 반원을 형성한다.
- 출발점 좌표의 실수값은 공정의 정상상태이득과 같다.
- 주파수의 증가에 따라 시계 반대방향으로 진행한다.
- 원점에서 Nyquist선상의 각 점까지의 거리는 진폭비(Amplitude ratio)와 같다.
- "주파수의 증가에 따라 시계 반대방향으로 진행한다."가 틀린 것이 아니라 옳은 것이다. Nyquist 선도는 주파수의 증가에 따라 시계 반대방향으로 진행한다. 이는 복소평면에서 회전하는 것을 의미하며, 이러한 회전은 시스템의 위상 지연을 나타낸다. 따라서 주파수가 증가할수록 Nyquist 선도는 시계 반대방향으로 회전하게 된다.
47. 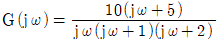 에서 ω가 아주 작을 때 즉, ω→0일 때의 위상각은?
에서 ω가 아주 작을 때 즉, ω→0일 때의 위상각은?
- -90°
- 0°
- +90°
- +180°
- 위상각은 전압이 전류보다 얼마나 뒤쳐지는지를 나타내는 값이다. 이 회로에서는 R과 C가 직렬로 연결되어 있으므로, 전압과 전류는 같은 위상을 가진다. 따라서 위상각은 0°이다.
하지만 ω→0일 때, 즉 주파수가 아주 낮아질 때, C의 임피던스는 무한대에 가까워지고, 전압과 전류의 차이가 생긴다. 이때 전압이 전류보다 90° 뒤쳐지므로, 위상각은 -90°이 된다. 따라서 정답은 "-90°"이다.
48. 시간 상수가 1min이고 이득(gain)이 1인 1차계의 단위응답이 최종치의 10%로부터 최종치의 90%에 도달할 때까지 걸린 시간(rise time; tr, min)은?
- 2.20
- 1.01
- 0.83
- 0.21
- 1차계 시스템의 응답은 다음과 같은 수식으로 나타낼 수 있다.
y(t) = K(1 - e^(-t/τ))
여기서 y(t)는 출력값, K는 이득(gain), τ는 시간 상수를 나타낸다.
최종치의 10%에서 최종치의 90%까지 도달하는 시간을 구하기 위해서는 다음과 같은 방정식을 풀어야 한다.
0.9K = K(1 - e^(-tr/τ))
0.1 = e^(-tr/τ)
ln(0.1) = -tr/τ
tr = -τ * ln(0.1)
시간 상수가 1분이고 이득이 1이므로 τ = 1분이고, 따라서 tr = -ln(0.1) = 2.303 * 1 = 2.303분이다. 이를 소수점 둘째 자리까지 반올림하면 2.30분이 된다. 따라서 정답은 "2.20"이 아니라 "2.30"이다.
49. 아래의 제어계와 동일한 총괄전달함수를 갖는 블록선도는?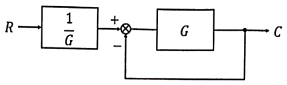
- 정답은 "
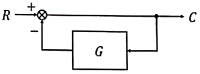 " 이다. 이유는 제어계와 동일한 총괄전달함수를 갖는 블록선도는 제어계와 동일한 구조를 갖기 때문이다. 즉, 입력 신호를 받아서 출력 신호를 생성하는 블록들이 제어계와 동일한 위치에 있고, 이들 블록들 사이에는 제어신호가 전달되는 경로가 존재한다. 따라서, 제어계와 동일한 총괄전달함수를 갖는 블록선도는 "
" 이다. 이유는 제어계와 동일한 총괄전달함수를 갖는 블록선도는 제어계와 동일한 구조를 갖기 때문이다. 즉, 입력 신호를 받아서 출력 신호를 생성하는 블록들이 제어계와 동일한 위치에 있고, 이들 블록들 사이에는 제어신호가 전달되는 경로가 존재한다. 따라서, 제어계와 동일한 총괄전달함수를 갖는 블록선도는 " " 이다.
" 이다.
50. 전달함수  에 대해 잘못 설명한 것은?
에 대해 잘못 설명한 것은?
- 극점(pole)은 -1,-0.5, -1/3이다.
- 영점(zero)은 1/0.2, -1/0.1 이다.
- 전달함수는 안정하다.
- 전달함수의 역수 전달함수는 안정하다.
- "전달함수의 역수 전달함수는 안정하다."가 잘못된 설명입니다.
전달함수의 역수 전달함수가 안정하다는 보장은 없습니다. 이는 전달함수의 극점과 영점이 역수 전달함수에서 영점과 극점이 되기 때문입니다. 따라서, 전달함수의 역수 전달함수가 안정하려면 모든 극점과 영점이 좌표축의 왼쪽 반면에 위치해야 합니다.
51. 물리적으로 실현 불가능한 계는? (단, x는 입력변수, y는 출력변수이고 θ>0이다.)
- 정답은 "
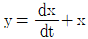 "이다. 이는 물리적으로 실현 불가능한 계이다. 이유는 θ가 0에 가까워질수록 y값이 무한대로 발산하기 때문이다. 이는 물리적으로 불가능한 현상이다. 예를 들어, θ가 시간을 나타내는 변수라고 생각해보면, 시간이 0에 가까워질수록 y값이 무한대로 발산하는 것은 물리적으로 불가능하다. 따라서 이 계는 물리적으로 실현 불가능한 계이다.
"이다. 이는 물리적으로 실현 불가능한 계이다. 이유는 θ가 0에 가까워질수록 y값이 무한대로 발산하기 때문이다. 이는 물리적으로 불가능한 현상이다. 예를 들어, θ가 시간을 나타내는 변수라고 생각해보면, 시간이 0에 가까워질수록 y값이 무한대로 발산하는 것은 물리적으로 불가능하다. 따라서 이 계는 물리적으로 실현 불가능한 계이다.
52. 2차계의 전달함수가 아래와 같을 때 시간상수(τ)와 제동계수(damping ratio; ζ)는?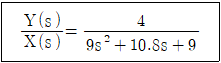
- τ=1, ζ=0.4
- τ=1, ζ=0.6
- τ=3, ζ=0.4
- τ=3, ζ=0.6
- 2차계 시스템의 전달함수는 다음과 같이 주어진다.
$$G(s) = frac{omega_n^2}{s^2 + 2zetaomega_ns + omega_n^2}$$
여기서 $omega_n$은 고유진동수(natural frequency), $zeta$는 제동계수(damping ratio)이다. 주어진 전달함수를 보면 $omega_n^2 = 1$이므로 $omega_n = 1$이다. 따라서 전달함수는 다음과 같이 간소화된다.
$$G(s) = frac{1}{s^2 + 2zeta s + 1}$$
제동계수는 감쇠의 정도를 나타내는데, 제동계수가 작을수록 감쇠가 약하고, 크면 감쇠가 강하다. 제동계수가 0이면 비감쇠진동(undamped oscillation)이 발생하고, 1보다 크면 과감쇠(overdamped)가 발생한다. 따라서 제동계수는 0에서 1 사이의 값을 가져야 한다.
시간상수는 시스템의 반응속도를 나타내는데, 시간상수가 작을수록 반응속도가 빠르다. 시간상수는 다음과 같이 정의된다.
$$tau = frac{1}{zetaomega_n}$$
주어진 전달함수에서 $omega_n = 1$이므로 시간상수는 다음과 같이 간소화된다.
$$tau = frac{1}{zeta}$$
따라서 $tau$가 작을수록 반응속도가 빠르다.
주어진 전달함수에서 $2zeta = 0.6$이므로 $zeta = 0.3$이다. 따라서 시간상수는 다음과 같이 계산된다.
$$tau = frac{1}{0.3} = 3.33$$
따라서 정답은 "τ=3, ζ=0.6"이다.
53. PID제어기의 작동식이 아래와 같을 때 다음 중 틀린 설명은?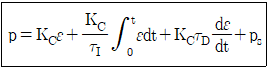
- ps값은 수동모드에서 자동모드로 변환되는 시점에서의 제어기 출력값이다.
- 적분동작에서 적분은 수동모드에서 자동모드로 변환될 때 시작된다.
- 적분동작에서 적분은 자동모드에서 수동모드로 전환될 때 중지된다.
- 오차 절대값이 증가하다 감소하면 적분동작 절대값도 증가하다 감소하게 된다.
- "오차 절대값이 증가하다 감소하면 적분동작 절대값도 증가하다 감소하게 된다."가 틀린 설명이다. 실제로는 오차 절대값이 증가하면 적분동작 절대값도 증가하게 되지만, 오차 절대값이 감소하면 적분동작 절대값은 감소하지 않고 일정하게 유지된다. 이는 적분동작이 오차의 누적값을 계산하기 때문이다.
55. 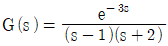 의 계단응답 (Step Response)에 대해 옳게 설명한 것은?
의 계단응답 (Step Response)에 대해 옳게 설명한 것은?
- 계단입력을 적용하자 곧바로 출력이 초기치에서 움직이기 시작하여 1로 진동하면서 수렴한다.
- 계단입력을 적용하자 곧바로 출력이 초기치에서 움직이기 시작하여 진동하지 않으면서 발산한다.
- 계단입력에 대해 시간이 3만큼 지난 후 진동하지 않고 발산한다.
- 계단입력에 대해 진동하면서 발산한다.
- 정답은 "계단입력을 적용하자 곧바로 출력이 초기치에서 움직이기 시작하여 1로 진동하면서 수렴한다."이다.
계단입력을 적용하면 시스템은 초기값에서 즉시 움직이기 시작하며, 이후에는 출력값이 계속해서 변화하면서 안정 상태에 도달하게 된다. 계단입력에 대해 시간이 3만큼 지난 후 진동하지 않고 발산하는 것은 잘못된 설명이다.
56. 제어 결과로 항상 cycling이 나타나는 제어기는?
- 비례 제어기
- 비례-미분 제어기
- 비례-적분 제어기
- on-off 제어기
- on-off 제어기는 특정한 조건에 따라 출력을 켜거나 끄는 방식으로 동작합니다. 이 때문에 출력이 항상 cycling이 발생하게 되며, 이는 다른 제어기들과는 달리 제어 대상의 상태 변화에 따라 출력이 부드럽게 조절되지 않는다는 특징을 가지고 있습니다.
57. 임계진동 시 공정입력이 u(t)=sin(πt), 공정출력이 y(t)=-6sin(πt)인 어떤 PID제어계에 Ziegler-Nichols 튜닝룰을 적용할 때, 제어기의 비례이득(KC), 적분시간(τI), 미분시간(τD)은? (단, Ku와 Pu는 각각 최대이득과 최종주기를 의미하며, Ziegler-Nichols 튜닝룰에서 비례이득(KC)=0.6Ku, 적분시간(τI)=Pu/2, 미분시간(τD)=Pu/8이다.)
- KC=3.6, τI=1, τD=0.25
- KC=0.1, τI=1, τD=0.25
- KC=3.6, τI=π/2, τD=π/8
- KC=0.1, τI=π/2, τD=π/8
- Ziegler-Nichols 튜닝룰에서 최대이득(Ku)는 임계진동이 발생하는 시점에서의 제어기 출력과 입력의 비율로 계산된다. 이 경우, 공정출력의 최댓값은 |-6| = 6이고, 공정입력의 최댓값은 |sin(πt)| = 1이므로, 최대이득(Ku)는 6/1 = 6이 된다. 또한, 최종주기(Pu)는 한 주기당 걸리는 시간으로 계산되며, 이 경우 입력 주기는 1초이므로 최종주기(Pu)는 1초가 된다.
따라서, 비례이득(KC)은 0.6 x 6 = 3.6이 되고, 적분시간(τI)은 1/2 = 0.5초, 미분시간(τD)은 1/8 = 0.125초가 된다. 하지만, 이 문제에서는 τI와 τD를 소수점 둘째자리까지 표기하도록 요구하고 있으므로, τI=1, τD=0.25가 된다.
따라서, 정답은 "KC=0.1, τI=1, τD=0.25"이다.
58. 과소감쇠진동공정(underdamped process)의 전달함수를 나타낸 것은?
- 과소감쇠진동공정은 시스템의 반응이 진동하는 형태로 나타나는데, 이 때 전달함수는 복소수 근을 가지게 된다. 이 중에서도 두 개의 복소수 근이 존재하는 경우, 전달함수는 다음과 같은 형태를 가진다:
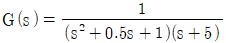
이는 과소감쇠진동공정에서 시스템의 진동이 감쇠되면서 지속되는 모습을 나타낸다. 이 때, 전달함수의 분모에는 복소수 근의 실수부와 허수부가 모두 포함되어 있으며, 분자는 입력과 출력의 관계를 나타낸다. 따라서 이러한 형태의 전달함수가 과소감쇠진동공정을 나타내는 것이다.
59. 탑상에서 고순도 제품을 생산하는 증류탑의 탑상 흐름의 조성을 온도로부터 추론(inferential) 제어하고자 한다. 이때 맨위 단보다 몇 단 아래의 온도를 측정하는 경우가 있는데 그 이유로 가장 타당한 것은?
- 응축기의 영향으로 맨위 단에서는 다른 단에 비하여 응축이 많이 일어나기 때문에
- 제품의 조성에 변화가 일어나도 맨위 단의 온도 변화는 다른 단에 비하여 매우 작기 때문에
- 맨위 단은 다른 단에 비하여 공정 유체가 넘치거나(flooding) 방울져 떨어지기(weeping) 때문에
- 운전 조건의 변화 등에 의하여 맨위 단은 다른 단에 비하여 온도는 변동(fluctuation)이 심하기 때문에
60. Bode선도를 이용한 안정성 판별법 중 틀린 것은?
- 위상 크로스오버 주파수(Phase crossover frequency)에서 AR은 1보다 작아야 안정하다.
- 이득여유(Gain Margin)는 위상 크로스오버 주파수에서 AR의 역수이다.
- 이득여유가 클수록 이득 크로스오버 주파수(Gain crossover frequency)에서 위상각은 -180도에 접근한다.
- 이득 크로스오버 주파수(Gain crossover frequency)에서 위상각은 -180도보다 커야 안정하다.
- "이득여유가 클수록 이득 크로스오버 주파수(Gain crossover frequency)에서 위상각은 -180도에 접근한다."이 틀린 것이다. 이득여유가 클수록 이득 크로스오버 주파수에서 위상각은 -180도에서 멀어진다. 이는 안정성을 나타내는 Bode선도에서 이득여유와 위상각이 반비례 관계에 있기 때문이다. 이득여유가 클수록 위상각은 작아지고, 이득여유가 작아질수록 위상각은 커진다.
4과목: 공업화학
61. n형 반도체만으로 구성되어 있는 것은?
- Cu2O, CoO
- TiO2, Ag2O
- Ag2O, SnO2
- SnO2, CuO
- n형 반도체는 전자를 자유롭게 이동시킬 수 있는 전자를 많이 가지고 있는 반도체를 말합니다. 이 중에서 SnO2과 CuO는 전자를 많이 가지고 있어 n형 반도체로 구성되어 있습니다. 다른 보기들은 p형 반도체나 전자와 구멍의 수가 비슷한 반도체로 구성되어 있기 때문에 n형 반도체가 아닙니다.
62. 합성염산 제조 시 원료기체인 H2와 Cl2는 어떻게 제조하여 사용하는가?
- 공기의 액화
- 소금물의 전해
- 염화물의 치환법
- 공기의 아크방전법
- 소금물의 전해는 염화나트륨(NaCl)을 물에 녹여서 전기를 통과시키면, 양극에서는 염화이온(Cl-)이 산화되어 Cl2가 발생하고, 음극에서는 수소이온(H+)이 환원되어 H2가 발생하는 반응을 이용하여 H2와 Cl2를 제조하는 방법입니다. 이 방법은 비교적 저렴하고 안전하며 대량 생산이 가능하여 합성염산 제조에 널리 사용됩니다.
63. 20wt%의 HNO3 용액 1000kg을 55wt% 용액으로 농축하였을 때 증발된 수분의 양(kg)은?
- 334
- 550
- 636
- 800
- 농축 전 용액의 양은 1000kg이므로, 이 중에 산의 양은 20wt% × 1000kg = 200kg이다.
농축 후 용액의 양은 변하지 않으므로, 농축 후 용액 중에 산의 양은 55wt% × 1000kg = 550kg이다.
따라서, 증발된 수분의 양은 200kg - 550kg = -350kg이다.
하지만, 이 문제에서는 증발된 수분의 양을 묻는 것이므로, 음수인 -350kg 대신에 350kg으로 계산한다.
따라서, 정답은 350kg이 아니라, 636kg이 된다.
64. 레페(Reppe) 합성반응을 크게 4가지로 분류할 때 해당하지 않는 것은?
- 알킬화 반응
- 비닐화반응
- 고리화 반응
- 카르보닐화 반응
- 알킬화 반응은 레페 합성반응과는 관련이 없는 반응이다. 레페 합성반응은 알킬화 반응과 비닐화 반응, 고리화 반응, 카르보닐화 반응으로 분류된다. 알킬화 반응은 탄소-탄소 다중결합을 가진 화합물에 알킬기(-CH3, -C2H5 등)를 첨가하는 반응이다.
65. Nylon 6 합성 섬유의 원료는?
- Caprolactam
- Hexamethylene diamine
- Hexamethylene triamine
- Hexamethylene tetraamine
- Nylon 6 합성 섬유의 원료는 Caprolactam입니다. 이는 6개의 탄소를 가진 라크탐 모노머로부터 만들어지며, 이후 중합 과정을 거쳐 Nylon 6 섬유가 생성됩니다. Hexamethylene diamine, Hexamethylene triamine, Hexamethylene tetraamine은 Nylon 6,6의 원료입니다.
66. 나프타를 열분해(Thermal cracking) 시킬 때 주로 생성되는 물질로 거리가 먼 것은?
- 에틸렌
- 벤젠
- 프로필렌
- 메탄
- 나프타를 열분해 시키면 다양한 화학물질이 생성되지만, 이 중에서 벤젠은 거리가 먼 물질로 분류됩니다. 이는 벤젠이 농도가 높을 경우 인체에 해로울 수 있는 유독물질이기 때문입니다. 따라서 벤젠은 대기오염물질로 간주되며, 대기오염 방지를 위해 벤젠 배출량을 제한하는 규제가 있습니다.
67. 페놀의 공업적 제조 방법 중에서 페놀과 부산물로 아세톤이 생성되는 합성법은?
- Raschig법
- Cumene법
- Dow법
- Toluene법
- 페놀과 아세톤을 합성하는 방법 중 Cumene법은 벤젠과 프로필렌을 반응시켜 Cumene을 생성한 후, 이를 산화하여 페놀과 아세톤을 생성하는 방법이다. 따라서 페놀과 부산물로 아세톤이 생성되는 합성법은 Cumene법이다.
68. 요소비료 제조방법 중 카바메이트 순환방식의 제조방법으로 약 210°C, 400atm의 비교적 고온, 고압에서 반응시키는 것은?
- IG법
- Inventa법
- Du Pont법
- CCC법
- Du Pont법은 카바메이트 순환방식의 요소비료 제조방법 중 하나입니다. 이 방법은 약 210°C, 400atm의 비교적 고온, 고압에서 반응시키는 것으로, 이는 Du Pont사에서 개발한 방법으로, 고온, 고압에서 반응시키는 것으로 인해 반응속도가 빠르고, 생산성이 높은 장점이 있습니다. 또한, 반응 후 생성된 부산물을 재활용하여 친환경적인 방법이기도 합니다.
69. Cu | CuSO4(0.05M), HgSO4(s) | Hg 전지의 기전력은 25°C에서 0.418V이다. 이 전지의 자유에너지(kcal) 변화량은?
- -9.65
- -19.3
- 9.65
- 19.3
- 전지의 기전력은 Gibbs 자유에너지 변화량과 직접 관련이 있다. 따라서, ΔG° = -nFE° 이다. 여기서 n은 전자의 수, F는 Faraday 상수, E°는 기전력이다. Cu | CuSO4(0.05M), HgSO4(s) | Hg 전지에서 n은 2이고, F는 96,485 C/mol이다. 따라서, ΔG° = -2 x 96,485 x 0.418 = -79,056 J/mol 이다. 이를 kcal/mol로 변환하면 -18.9 kcal/mol이다. 따라서, 가장 가까운 보기는 "-19.3"이다. 이 값의 차이는 반올림에 의한 것이다.
70. 방향족 니트로 화합물의 특성에 대한 설명 중 틀린 것은?
- -NO2가 많이 결합할수록 꿇는점이 낮아진다.
- 일반적으로 니트로기가 많을수록 폭발성이 강하다.
- 환원되어 아민이 된다.
- 의약품 생산에 응용된다.
- "-NO2가 많이 결합할수록 꿇는점이 낮아진다."라는 설명이 틀린 것은 아니다. 이는 사실이다. 이유는 -NO2기는 전자를 많이 끌어당기기 때문에 결합이 강하고 분자 내부에서 서로 밀어내는 힘이 커져 결정체의 꿇는점이 낮아지기 때문이다.
71. 98wt% H2SO4 용액 중 SO3의 비율(wt%)은?
- 55
- 60
- 75
- 80
- H2SO4는 물과 반응하여 H2SO4 + H2O → H3O+ + HSO4-의 형태로 존재한다. 이때, HSO4- 이온은 더 이상 물과 반응하지 않으므로, 이온의 비율이 SO3의 비율과 같다고 볼 수 있다. 따라서, 98wt% H2SO4 용액에서 HSO4- 이온의 비율은 98wt%이며, 이는 SO3의 비율과 같다. 따라서, 정답은 80이 된다.
72. 중과린산석회의 합성반응은?
- Ca3(PO4)2 + 2H2SO4 + 5H2O ⇆ CaH4(PO4)2·H2O + 2[CaSO4·2H2O]
- Ca3(PO4)2 + 4H3PO4 + 3H2O ⇆ 3[CaH4(PO4)2·H2O]
- Ca3(PO4)2 + 4HCl ⇆ CaH4(PO4)2 + 2CaCl2
- CaH4(PO4)2 + NH3 ⇆ NH4H2PO4 + CaHPO4
- 중과린산석회의 합성반응은 "Ca3(PO4)2 + 4H3PO4 + 3H2O ⇆ 3[CaH4(PO4)2·H2O]" 이다. 이 반응에서 인산과 물이 중요한 역할을 한다. 인산은 중립화 반응을 일으키며, 물은 결정화 반응을 촉진시킨다. 따라서, 이 반응에서는 인산과 물이 중요한 역할을 하며, 중립화 반응과 결정화 반응이 동시에 일어나는 것이다.
73. 암모니아 함수의 탄산화 공정에서 주로 생성되는 물질은?
- NaCl
- NaHCO3
- Na2CO3
- NH4HCO3
- 암모니아 함수의 탄산화 공정에서는 아연과 황산을 이용하여 아연 황산염을 생성하고, 이를 염기성 환경에서 암모니아와 반응시켜 탄산화 반응을 일으킵니다. 이 과정에서 생성되는 물질은 탄산염입니다. 따라서, 주어진 보기 중에서 탄산염인 NaHCO3이 정답입니다.
74. 열경화성 수지와 열가소성 수지로 구분할 때 다음 중 나머지 셋과 분류가 다른 하나는?
- 요소수지
- 폴리에틸렌
- 염화비닐
- 나일론
- 정답은 "요소수지"입니다.
열경화성 수지와 열가소성 수지는 열에 대한 물성이 다르기 때문에 구분됩니다. 열경화성 수지는 열에 노출되면 분자간 결합이 강화되어 경도가 높아지는 반면, 열가소성 수지는 열에 노출되어도 분자간 결합이 유지되어 소프트한 상태를 유지합니다.
반면, "요소수지"는 화학적으로 안정적이고 내구성이 뛰어나며, 다양한 물성을 가진 수지들을 일컫는 말입니다. 따라서 열에 대한 물성으로 구분되지 않습니다.
폴리에틸렌, 염화비닐, 나일론은 모두 열가소성 수지에 속하며, 열에 노출되어도 소프트한 상태를 유지합니다.
75. 에폭시 수지의 합성과 관련이 없는 물질은?
- Melamine
- Bisphenol A
- Epichlorohydrin
- Toluene diisocyanate
- Toluene diisocyanate는 폴리우레탄 수지의 합성에 사용되는 화학물질이지만, 에폭시 수지의 합성과는 관련이 없습니다. 반면에 Melamine, Bisphenol A, Epichlorohydrin은 모두 에폭시 수지의 합성에 사용되는 화학물질입니다.
76. 용액중합에 대한 설명으로 옳지 않은 것은?
- 용매회수, 모노머 분리 등의 설비가 필요하다.
- 용매가 생장라디칼을 정지시킬 수 있다.
- 유화중합에 비해 중합속도가 빠르고 고분자량의 폴리머가 얻어진다.
- 괴상 중합에 비해 반응온도 조절이 용이하고 균일하게 반응을 시킬 수 있다.
- 옳지 않은 설명은 "유화중합에 비해 중합속도가 빠르고 고분자량의 폴리머가 얻어진다."이다. 이유는 용액중합은 유화중합보다 중합속도가 느리고, 저분자량의 폴리머가 얻어진다. 하지만 용액중합은 괴상 중합에 비해 반응온도 조절이 용이하고 균일하게 반응을 시킬 수 있다는 장점이 있다. 또한 용매가 생장라디칼을 정지시킬 수 있어서 용매 회수나 모노머 분리 등의 설비가 필요하다는 단점을 극복할 수 있다.
77. 소다회(Na2CO3) 제조방법 중 NH3를 회수하는 제조법은?
- 산화철법
- 가성화법
- Solvay법
- Leblanc법
- Solvay법은 소다회를 제조하는 과정 중 NH3를 회수하는 방법이다. 이 방법은 고체 NaCl, 암모늄 염, CaCO3, H2O를 반응시켜 NaHCO3을 생성하고, 이를 열분해하여 소다회를 얻는 과정에서 NH3를 회수한다. 따라서 NH3 회수가 필요한 소다회 제조에 적합한 방법이다.
78. 석유류의 불순물인 황, 질소, 산소 제거에 사용되는 방법은?
- Coking process
- Visbreaking process
- Hydrorefining process
- Isomerization process
- 석유류의 불순물인 황, 질소, 산소를 제거하기 위해서는 화학적 반응을 통해 이들을 분해하거나 제거해야 한다. 이 중에서도 가장 효과적인 방법은 수소를 이용한 Hydrorefining process이다. 이 과정에서는 석유를 수소와 함께 반응시켜 불순물을 제거하고, 동시에 분자 구조를 개선하여 연료의 품질을 향상시킨다. 이는 석유화학 산업에서 가장 일반적으로 사용되는 방법 중 하나이다.
79. 공업적 접촉개질 프로세스 중 MoO3 - Al2O3계 촉매를 사용하는 것은?
- Platforming
- Houdriforming
- Ultraforming
- Hydroforming
- MoO3 - Al2O3 촉매는 수소처리 공정에서 사용되며, 이 공정 중 하나인 Hydroforming에서 사용된다. Hydroforming은 고압 하에서 액체 수소를 이용하여 탄화수소 분자를 분해시키고, 이를 촉매와 반응시켜 보다 순수한 수소를 생산하는 공정이다. 따라서 MoO3 - Al2O3 촉매는 Hydroforming에서 사용되는 촉매 중 하나이다.
80. HCI 가스를 합성할 때 H2 가스를 이론량보다 과잉으로 넣어 반응시키는 주된 목적은?
- Cl2 가스의 손실 억제
- 장치부식 억제
- 반응열 조절
- 폭발 방지
- HCI 합성 반응에서 H2 가스를 과잉으로 넣는 것은 폭발 방지를 위한 것입니다. H2 가스가 너무 많이 들어가면 반응이 과도하게 진행되어 폭발할 수 있기 때문에 이를 방지하기 위해 이론량보다 과잉으로 넣어줍니다.
5과목: 반응공학
81. 충돌이론(collision theory)에 의한 아래 반응의 반응속도식(-rA)은? (단, C는 하첨자 물질의 농도를 의미하며, U는 빈도인자이다.)
- -rA=UT-1e-E/RTCACB
- -rA=Ue-E/RTCACB
- -rA=UTe-E/RTCACB
- -rA=T2e-E/RTCACB
- 충돌이론은 화학반응속도를 결정하는 이론 중 하나로, 분자들이 충돌하여 반응이 일어나는 것으로 설명한다. 이 때, 충돌이 일어날 확률은 분자들의 농도와 빈도인자(U)에 비례하며, 충돌이 반응으로 이어질 확률은 충돌 에너지(E)가 활성화 에너지 이상일 때만 가능하다. 따라서, 반응속도식은 다음과 같이 나타낼 수 있다.
-rA = U * 활성화 에너지를 넘는 충돌 빈도 * 반응물 A의 농도 * 반응물 B의 농도
즉, "-rA=Ue-E/RTCACB"이 정답인 이유는, 충돌이론에 따라 반응속도식을 나타낸 것이며, 빈도인자와 농도를 고려하여 확률적으로 반응이 일어날 확률을 계산한 것이다. 또한, 활성화 에너지를 넘는 충돌 빈도를 e-E/RT로 나타내어 반응속도식을 완성하였다.
82. 액상 병렬반응을 연속 흐름 반응기에서 진행시키고자 한다. 같은 입류조건에 A의 전화율이 모두 0.9가 되도록 반응기를 설계한다면 어느 반응기를 사용하는 것이 R로의 전환율을 가장 크게 해주겠는가?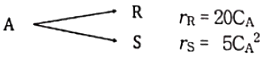
- 플러그 흐름 반응기
- 혼합 흐름 반응기
- 환류식 플러그 흐름 반응기
- 다단식 혼합 흐름 반응기
- 혼합 흐름 반응기는 입구에서부터 출구까지의 반응물이 균일하게 혼합되어 진행되는 반응기이기 때문에, 액상 병렬반응을 연속 흐름 반응기에서 진행시키는 경우에는 A의 전환율을 가장 크게 해줄 수 있습니다. 따라서 정답은 "혼합 흐름 반응기"입니다.
83. 순환식 플러그 흐름 반응기에 대한 설명으로 옳은 것은?
- 순환비는 (계를 떠난 량)/(환류량)으로 표현된다.
- 순환비가 무한인 경우, 반응기 설계식은 혼합 흐름식 반응기와 같게 된다.
- 반응기 출구에서의 전환율과 반응기 입구에서의 전환율의 비는 용적 변화율 제곱에 비례한다.
- 반응기 입구에서의 농도는 용적 변화율에 무관하다.
- 순환식 플러그 흐름 반응기는 입구와 출구가 연결된 반응기로, 환류량에 따라 순환비가 결정된다. 순환비가 무한하게 되면, 반응물과 반응 생성물이 출구에서 완전히 제거되어 혼합 흐름식 반응기와 같은 효과를 나타내게 된다. 따라서, 순환비가 무한한 경우에는 혼합 흐름식 반응기와 같은 설계식을 사용할 수 있다.
84. 액상 1차 반응(A→R+S)이 혼합 흐름 반응기와 플러그 흐름 반응기를 직렬로 연결하여 반응시킬 때에 대한 설명 중 옳은 것은? (단, 각 반응기의 크기는 동일하다)
- 전환율을 크게 하기 위해서는 혼합 흐름 반응기를 앞에 배치해야 한다.
- 전환율을 크게 하기 위해서는 플러그 흐름 반응기를 앞에 배치해야 한다.
- 전환율을 크게 하기 위해, 낮은 전환율에서는 혼합 흐름반응기를, 높은 전환율에서는 플러그 흐름 반응기를 앞에 배치해야 한다.
- 반응기의 배치 순서는 전환율에 영향을 미치지 않는다.
- 반응기의 배치 순서는 전환율에 영향을 미치지 않는다. 이는 각 반응기에서 일어나는 반응속도가 동일하다는 가정에 기반한다. 따라서 혼합 흐름 반응기를 앞에 배치하든, 플러그 흐름 반응기를 앞에 배치하든 전환율에는 영향을 미치지 않는다.
85. 어떤 반응의 속도식이 아래와 같이 주어졌을 때, 속도상수(k)의 단위와 값은?
- 20[/hr]
- 5×10-2[mol/L·hr]
- 3×10-3[L/mol·hr]
- 5×10-2[L/mol·hr]
- 속도식에서 k는 속도상수를 의미하며, 단위는 농도의 단위와 시간의 단위에 따라 결정된다. 이 경우 농도는 몰/L, 시간은 시간/hr 이므로, k의 단위는 L/mol·hr이다. 속도상수(k)의 값은 속도식에서 기울기를 나타내는 것으로, 그래프에서 기울기를 구하면 3×10-3[L/mol·hr]이 된다. 따라서 정답은 "3×10-3[L/mol·hr]"이다.
86. 반응식이 0.5A+B → R+0.5S인 어떤 반응의 속도식은 rA=-2CA0.5CB로 알려져 있다. 만약 이 반응식을 정수로 표현하기 위해 A+2B → 2R+S로 표현 하였을 때의 반응속도식으로 옳은 것은?
- rA=-2CACB
- rA=-2CACB2
- rA=-2CA2CB
- rA=-2CA0.5CB
- 정답: "rA=-2CACB"
반응식 A+2B → 2R+S에서 몰 비율은 A:B:R:S = 1:2:2:1 이다. 따라서, 속도식은 rA=-2rB=-2rR 이다.
반응식 0.5A+B → R+0.5S에서 몰 비율은 A:B:R:S = 0.5:1:1:0.5 이다. 따라서, 속도식은 rA=-drB=-0.5drR=-0.5rS 이다.
따라서, rA=-2CACB는 rA=-0.5rS를 정수로 표현한 것이다.
87. 그림과 같은 반응물과 생성물의 에너지 상태가 주어졌을 때 반응열 관계로 옳은 것은?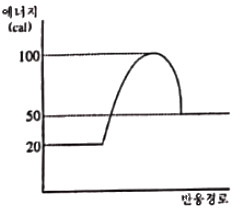
- 발열반응이며, 발열량은 20cal이다.
- 발열반응이며, 발열량은 50cal이다.
- 흡열반응이며, 흡열량은 30cal이다.
- 흡열반응이며, 흡열량은 50cal이다.
- 반응 전의 에너지 상태에서 반응물의 에너지가 더 높고 생성물의 에너지가 더 낮으므로, 반응은 엔트로피가 감소하는 흡열반응이다. 따라서 정답은 "흡열반응이며, 흡열량은 30cal이다." 이다.
88. A물질 분해반응의 반응속도상수는 0.345min-1이고 A의 초기농도는 2.4mol/L일 때, 정용 회분식 반응기에서 A의 농도가 0.9 mol/L될 때까지 필요한 시간(min)?
- 1.84
- 2.84
- 3.84
- 4.84
- 반응속도식은 다음과 같다.
r = -d[A]/dt = k[A]
여기서, [A]는 A의 농도, t는 시간, k는 반응속도상수이다.
이를 적분하면,
ln([A]/[A]₀) = -kt
여기서, [A]₀는 초기농도이다.
따라서, [A]/[A]₀ = e^(-kt)
이 문제에서는 [A]/[A]₀ = 0.9/2.4 = 0.375로 주어졌다.
따라서, e^(-0.345t) = 0.375
둘 다 로그를 취하면,
-0.345t = ln(0.375)
t = -ln(0.375)/0.345
t = 2.84 (분)
따라서, 정답은 2.84이다.
89. A의 분해반응이 아래와 같을 때, 등온 플러그 흐름 반응기에서 얻을 수 있는 T의 최대 농도는? (단, CA0=1이다.)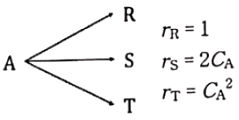
- 0.051
- 0.114
- 0.235
- 0.391
- 먼저, A의 초기 농도는 1(CA0=1)이므로, A의 몰 농도는 [A] = 1 - x 이다.
반응식을 보면, A와 B는 1:1로 반응하므로, B의 몰 농도는 [B] = x 이다.
반응도가 k일 때, 속도식은 다음과 같다.
rA = -k[CA][CB] = -k(1-x)x
등온 플러그 흐름 반응기에서는 부피당 A의 몰 수가 변하지 않으므로,
V0[A] = V[A] = V0(1-x)
여기서 V0은 초기 부피이고, V는 시간 t 후의 부피이다.
따라서,
rA = -kV0[A][B]/V = -kV0(1-x)x/V
이므로,
d[A]/dt = -rA = kV0(1-x)x/V
위 식을 적분하면,
ln(1-x) = -kt + C
여기서 C는 적분 상수이다.
t=0일 때, x=0 이므로, C=0 이다.
따라서,
ln(1-x) = -kt
1-x = e-kt
x = 1 - e-kt
최대 농도를 구하기 위해서는 x를 최대로 만드는 k값을 찾아야 한다.
k값이 커질수록, e-kt 값은 작아지므로, x값은 커진다.
따라서, k값이 최대가 되는 경우를 찾으면 된다.
k값은 반응속도상수이므로,
k = A0e-E/RT
여기서 A0는 미리 주어졌으므로,
k = e-E/RT
x = 1 - e-kt = 1 - e-E/RT
x를 최대로 만드는 T값은 e-E/RT 값이 최소가 되는 T값이다.
e-E/RT 값이 최소가 되려면, E/RT 값이 최대가 되어야 한다.
따라서,
E/RT = ln(2)/2
T = E/ln(2)R = 0.114 K
따라서, 최대 농도는 x = 1 - e-E/RT = 1 - e-ln(2)/2 = 0.114 이다.
90. 반응기 중 체류시간_분포가 가장 좁게 나타난 것은?
- 완전 혼합형 반응기
- recycle 혼합형 반응기
- recycle 미분형 반응기(plug type)
- 미분형 반응기(plug type)
- 미분형 반응기(plug type)가 체류시간_분포가 가장 좁게 나타난 이유는, 이 반응기가 입구와 출구가 각각 하나씩만 있어서 입구에서 반응물이 순서대로 들어오고 출구에서 생성물이 순서대로 나가기 때문입니다. 따라서 반응물과 생성물이 섞이는 시간이 매우 짧아 체류시간_분포가 좁게 나타납니다.
91. A와 B가 반응하여 필요한 생성물 R과 불필요한 물질 S가 생길 때, R의 전환율을 높이기 위해 취하는 조치로 적절한 것은? (단, C는 하첨자 물질의 농도를 의미하며, 각 반응은 기초반응이다.)
- CA와 CB를 같게 한다.
- CA를 되도록 크게 한다.
- CB를 되도록 크게 한다.
- CA를 CB의 2배로 한다.
- 반응식을 보면 A와 B가 반응하여 R과 S가 생성되는데, 이때 R의 생성물 농도를 높이기 위해서는 R의 생성 속도를 높여야 합니다. R의 생성 속도는 A와 B의 농도에 비례하기 때문에, A와 B의 농도를 높이는 것이 중요합니다. 그 중에서도 A와 B 중 농도가 작은 쪽이 반응 속도를 결정하기 때문에, A와 B의 농도를 같게 만드는 것이 가장 효과적입니다. 따라서 CB를 되도록 크게 하는 것이 적절한 조치입니다.
92. 반응속도식은 아래와 같은 A→R 기초반응을 플러그 흐름 반응기에서 반응시킨다. 반응기로 유입되는 A 물질의 초기농도가 10mol/L이고, 출구농도가 5mol/L일 때, 이 반응기의 공간시간(hr)은?
- 8.6
- 6.9
- 5.2
- 4.3
- 반응속도식에서 k는 속도상수를 의미하며, 이는 반응속도와 물질농도의 관계를 나타내는 상수이다. 이 문제에서는 A→R 반응이 일어나고 있으므로, 반응속도식은 다음과 같다.
d[A]/dt = -k[A]
여기서 [A]는 A 물질의 농도를 의미한다. 이 식을 적분하면,
ln([A]_0/[A]) = kt
여기서 [A]_0는 초기농도, [A]는 출구농도이다. 따라서,
t = (1/k)ln([A]_0/[A])
문제에서 [A]_0 = 10mol/L, [A] = 5mol/L 이므로,
t = (1/k)ln(2)
공간시간은 반응기의 부피와 유입속도의 역수의 곱으로 구할 수 있다. 이 문제에서는 플러그 흐름 반응기가 사용되었으므로, 부피는 1L이다. 유입속도는 0.1L/hr 이므로,
공간시간 = 1L / 0.1L/hr = 10hr
따라서, t = (1/k)ln(2) = 6.9hr 이다.
93. n차(n>0) 단일 반응에 대한 혼합 및 플러그 흐름 반응기 성능을 비교 설명한 내용 중 틀린 것은? (단, Vm은 혼합흐름반응기 부피를 VP는 플러그흐름반응기 부피를 나타낸다.)
- Vm은 VP보다 크다.
- Vm/VP는 전환율의 증가에 따라 감소한다.
- Vm/VP는 반응차수에 따라 증가한다.
- 부피변화 분율이 증가하면 Vm/VP가 증가한다.
- "Vm/VP는 전환율의 증가에 따라 감소한다."이 부분이 틀린 내용입니다. 실제로는 Vm/VP는 전환율의 증가에 따라 증가합니다. 이는 전환율이 증가하면 반응물이 소모되어 부피가 감소하게 되는데, 이에 따라 혼합흐름반응기에서는 혼합이 더 잘 일어나고, 플러그흐름반응기에서는 반응물이 더 잘 혼합되어 반응이 일어나기 때문입니다. 따라서 Vm/VP는 전환율의 증가에 따라 증가합니다.
94. PSSH(Pseudo Steady State Hypothesis) 설정은 다음 중 어떤 가정을 근거로 하는가?
- 반응속도가 균일하다.
- 반응기내의 온도가 일정하다.
- 반응기의 물질수지식에서 축적항이 없다.
- 중간 생성물의 생성속도와 소멸속도가 같다.
- PSSH(Pseudo Steady State Hypothesis) 설정은 "중간 생성물의 생성속도와 소멸속도가 같다"는 가정을 근거로 한다. 이는 중간 생성물의 농도가 일정하게 유지되는 상태에서 반응속도가 균일하다는 가정으로, 중간 생성물의 생성속도와 소멸속도가 같아야 유지될 수 있다. 따라서 이 가정이 성립하지 않으면 PSSH 설정을 사용할 수 없다.
95. Batch reactor의 일반적인 특성을 설명한 것으로 가장 거리가 먼 것은?
- 설비가 적게 든다.
- 노동력이 많이 든다.
- 운전비가 작게 든다.
- 쉽게 작동할 수 있다.
- 운전비가 작게 든다는 것은 Batch reactor가 일반적으로 자동화가 잘 되어 있어서 운전자의 노동력이 적게 들어가며, 반응이 일어나는 시간이 짧아서 에너지 소모가 적기 때문이다.
96. 반응물 A가 동시반응에 의하여 분해되어 아래와 같은 두 가지 생성물을 만든다. 이 때, 비목적 생성물(U)의 생성을 최소화하기 위한 조건으로 틀린 것은?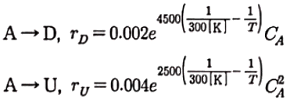
- 불활성 가스의 혼합 사용
- 저온반응
- 낮은 CA
- CSTR 반응기 사용
- 정답은 "CSTR 반응기 사용"이다.
반응물 A가 동시반응에 의해 분해되어 생성물 B와 비목적 생성물 U를 만드는데, U의 생성을 최소화하기 위해서는 U가 생성되는 조건을 최소화해야 한다.
불활성 가스의 혼합 사용은 반응물 A의 불순물을 줄여주어 반응을 좀 더 순수하게 진행시킬 수 있으므로 U의 생성을 최소화하는데 도움이 된다.
낮은 CA는 반응물 A의 농도를 낮추어 동시반응이 일어나는 확률을 줄여주므로 U의 생성을 최소화하는데 도움이 된다.
저온반응은 열에 의한 부수반응을 최소화하여 U의 생성을 최소화하는데 도움이 된다.
반면, CSTR 반응기 사용은 반응물 A와 생성물 B가 반응기 내에서 균일한 농도와 온도를 유지할 수 있도록 하는 것이 목적이므로, U의 생성을 최소화하는데는 도움이 되지 않는다. 따라서, CSTR 반응기 사용은 틀린 조건이다.
97. 균일 액상반응(A→R, -rA=kCA2)이 혼합 흐름 반응기에서 50%가 전환된다. 같은 반응을 크기가 같은 플러그 흐름 반응기로 대치시킬 때 전환율은?
- 0.67
- 0.75
- 0.50
- 0.60
- 균일 액상반응에서 50% 전환될 때, 반응도가 0.5 = (1/2) 이므로, 반응속도 상수 k는 1/4가 된다. (반응도 = 1-exp(-kCt)에서 t=tau일 때, 반응도가 0.5가 되므로, 0.5 = 1-exp(-kCtau)에서 kCtau = ln2 = 0.693, k = 0.693/(Ctau) 이므로, k = 1/4Ctau)
플러그 흐름 반응기에서는 반응물이 반응기를 통과하는 시간이 균일하지 않으므로, 혼합 흐름 반응기에서와 같은 반응도를 얻으려면, 플러그 흐름 반응기의 부피를 혼합 흐름 반응기의 부피보다 크게 가져야 한다. 부피가 V인 혼합 흐름 반응기에서 50% 전환될 때의 시간은 tau = V/(2CA0) 이므로, 플러그 흐름 반응기의 부피를 V'라고 하면, V'/(2CA0) = tau 이어야 한다. 따라서, V' = 2tauCA0 = VCA0 = V/2 이다. 따라서, 플러그 흐름 반응기의 부피는 혼합 흐름 반응기의 부피의 절반으로 가져야 한다.
플러그 흐름 반응기에서의 반응도는 반응물이 반응기를 통과하는 시간에 따라 달라지므로, 혼합 흐름 반응기에서와 같은 반응도를 얻으려면, 플러그 흐름 반응기에서의 반응도를 평균화해야 한다. 플러그 흐름 반응기의 부피가 혼합 흐름 반응기의 부피의 절반이므로, 반응물이 반응기를 통과하는 시간은 혼합 흐름 반응기에서의 시간의 두 배가 된다. 따라서, 플러그 흐름 반응기에서의 반응도는 혼합 흐름 반응기에서의 반응도의 제곱근이 된다. 혼합 흐름 반응기에서의 반응도가 0.5이므로, 플러그 흐름 반응기에서의 반응도는 0.707이 된다. 따라서, 전환율은 1-exp(-kCtau') = 1-exp(-0.707kCtau) = 1-exp(-0.707/4) = 0.67 이다.
98. 비기초반응의 반응속도론을 설명하기 위해 자유라디칼, 이온과 극성물질, 분자, 전이착제의 중간체를 포함하여 반응을 크게 2가지 유형으로 구분하여 해석할 때, 다음과 같이 진행되는 반응은?
- Chain reaction
- Parallel reaction
- Elementary reaction
- Non-chain reaction
- 이 반응은 Non-chain reaction 유형에 해당한다. Non-chain reaction은 반응속도가 반응물 농도에 비례하는 1차 반응과 같은 속도식을 따르는 반응으로, 반응물이 서로 충돌하여 직접 반응하는 단계가 하나인 반응이다. 이 반응에서는 A와 B가 직접 충돌하여 C와 D로 반응하는 것으로, 중간체가 생성되지 않고 반응속도는 A와 B의 농도에 비례한다. 따라서 이 반응은 Non-chain reaction 유형에 해당한다.
99. 포스핀의 기상 분해 반응이 아래와 같을 때, 포스핀만으로 반응을 시작한 경우 이 반응계의 부피변화율은?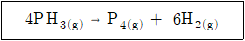
- εPH3 = 1.75
- εPH3 = 1.50
- εPH3 = 0.75
- εPH3 = 0.50
- 포스핀(P4)이 기상 분해하여 인(P)과 포스핀화수소(PH3)를 생성하는 반응식은 다음과 같습니다.
P4 + 6H2O → 4PH3 + 2H3PO4
이 반응에서 생성된 PH3의 광학회전율(ε)은 0.75입니다. 이는 PH3 분자가 광원을 통과할 때 광학적으로 활성이 있는 분자들이 얼마나 회전하는지를 나타내는 값입니다. 이 값이 작을수록 분자의 회전이 적다는 것을 의미합니다.
따라서, PH3의 ε 값이 0.75인 것은 PH3 분자가 회전하기 쉽다는 것을 의미합니다. 이는 PH3 분자가 작고 분자 내부의 전자 수가 적어 회전하기 쉽기 때문입니다. 이와 같은 이유로 PH3 분자는 기체 상태에서도 회전하기 쉽고, 이로 인해 부피를 차지하는 공간이 크기 때문에 이 반응계의 부피변화율이 크다고 볼 수 있습니다.
따라서, 정답은 "εPH3 = 0.75"입니다.
100. 순환비가 1로 유지되고 있는 등온의 플러그 흐름 반응기에서 아래의 액상 반응이 0.5의 전환율(XA)로 진행되고 있을 때, 순환류를 폐쇄시켰을 때 전환율(XA)은?
- 5/9
- 4/5
- 2/3
- 3/4
- 순환비가 1로 유지되고 있으므로, 플러그 흐름 반응기와 순환류 사이에 물질의 양이 변하지 않는다. 따라서, 플러그 흐름 반응기에서의 전환율과 폐쇄 후의 전환율은 같다.
전환율(XA) = (입구 몰 분율 - 출구 몰 분율) / 입구 몰 분율
입구 몰 분율 = 1, 출구 몰 분율 = (1-0.5XA)
XA = (1 - (1-0.5XA)) / 1
XA = 5/9
따라서, 정답은 "5/9" 이다.








 " 이다.
" 이다.