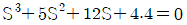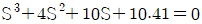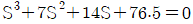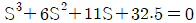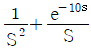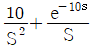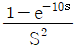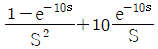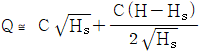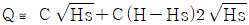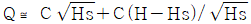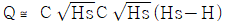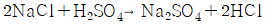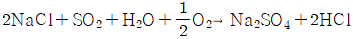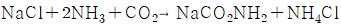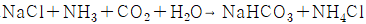1과목: 화공열역학
1. 다음 중 시량변수(extensive property)는 어느 것인가?
- 엔탈피
- 압력
- 온도
- 비용
- 엔탈피는 시량변수이다. 시량변수는 물질의 양에 비례하여 변화하는 물리량으로, 엔탈피는 물질의 양에 따라 변화하는 열에너지의 양을 나타내는 물리량이기 때문이다. 압력과 온도는 상태변수이며, 비용은 경제적인 개념으로 물리량이 아니다.
2. 탄화수소 공업분야에서 흔히 사용되는 어떤성분의 평형비 (Ki는 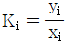 로 정의된다. 이상용액이라 생각할 때 Ki를 어떻게 표시하는가?
로 정의된다. 이상용액이라 생각할 때 Ki를 어떻게 표시하는가?
- 이상용액에서는 화학반응의 평형이 항상 일정하게 유지되므로, Ki는 반응물과 생성물의 농도 비율을 나타내는 상수이다. 따라서 Ki가 크다는 것은 생성물의 농도가 반응물의 농도보다 높다는 것을 의미하고, Ki가 작다는 것은 생성물의 농도가 반응물의 농도보다 낮다는 것을 의미한다. 따라서 Ki가 "
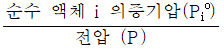 " 인 이유는 생성물의 농도가 반응물의 농도보다 높기 때문이다.
" 인 이유는 생성물의 농도가 반응물의 농도보다 높기 때문이다.
3. 다음 중 맥스웰(Maxwell)의 관계식으로 적당하지 않은 것은?
- "
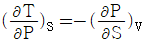 "는 맥스웰(Maxwell)의 관계식 중 하나인 전기장의 회전성에 대한 법칙이 아니라, 전기장의 발생원인인 전하와 전기장의 관계를 나타내는 가우스 법칙(Gauss's law)이기 때문에 적당하지 않은 것이다.
"는 맥스웰(Maxwell)의 관계식 중 하나인 전기장의 회전성에 대한 법칙이 아니라, 전기장의 발생원인인 전하와 전기장의 관계를 나타내는 가우스 법칙(Gauss's law)이기 때문에 적당하지 않은 것이다.
4. 일정온도 및 압력하에서 반응좌표(reaction coordinate)에 따른 Gibbs 에너지의 관계도에서 화학반응 평형점은?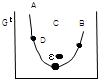
- A
- B
- C
- D
- 화학반응 평형점은 Gibbs 에너지가 최소가 되는 지점이다. 그래프에서 보면, Gibbs 에너지가 최소가 되는 지점은 "D" 이다. "A"와 "B"는 화학반응의 시작점과 끝점이므로 평형점이 될 수 없다. "C"는 Gibbs 에너지가 최소가 되는 지점이 아니므로 평형점이 될 수 없다.
5. 반데르 바알스 방정식, 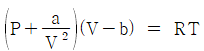 에서 P는 atm단위 V는 L/mole단위로 취하면, 상수 a의 단위는?
에서 P는 atm단위 V는 L/mole단위로 취하면, 상수 a의 단위는?
- 상수 a는 (L^2 x atm)/mol^2 단위를 가진다. 이는 반드시 그래프에서 기울기의 제곱근과 같은 값이어야 하기 때문이다. 따라서 "
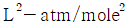 "이 정답이다.
"이 정답이다.
6. 고립계의 총 엔트로피의 증가와 관련이 없는 것은?
- 넓은 의미로서 안정도와 확율이 증가되는 것
- 좁은 의미로서 볼 때 더욱 무질서해진다는 것
- 열이 일로 전환할 때 이부가 열의 형태로 고립계에 축적된다는 것
- 열이 일로 가역적으로 전환 된다는 뜻
- 정답은 "열이 일로 가역적으로 전환 된다는 뜻"입니다. 이유는 열이 일로 가역적으로 전환될 때는 엔트로피의 증가와 관련이 없기 때문입니다. 엔트로피는 열의 이동과 함께 증가하는데, 열이 일로 전환될 때는 열의 형태로 축적되기 때문에 엔트로피의 변화가 없습니다. 따라서 고립계의 총 엔트로피의 증가와 관련이 없습니다.
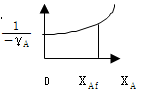
7. 다음 그림은 1기압하에서의 A, B 2성분계 용액에 대한 비점선도(Boiling point diagram)이다. XA=0.40인 용액을 1기압하에서 서서히 가열할 때 일어나는 현상을 설명한 다음 사항 중 틀린 것은? (단, 처음온도는 40℃이고, 마지막 온도는 70℃이다.)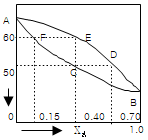
- 용액은 50℃에서 끓기 시작하여 60℃가 되는 순간 완전히 기화한다.
- 용액이 끓기 시작하자마자 생긴 최초의 증기조성은 YA=0.70이다.
- 용액이 계속 증발함에 따라 남아있는 용액의 조성은 곡선 DE를 따라 변한다.
- 마지막 남은 한방울의 조성은 XA=0.15이다.
- 용액이 1기압하에서 40℃에서 가열되면, 처음에는 곡선 AB를 따라 온도가 올라가면서 용액의 조성은 XA=0.40을 유지한다. 그러나 용액이 50℃에 도달하면, 용액의 조성은 곡선 BC를 따라 XA=0.70으로 변하고, 이때부터 용액이 증발하기 시작한다. 용액이 계속 증발함에 따라, 증기의 조성은 곡선 BC를 따라 변하고, 남아있는 용액의 조성은 곡선 DE를 따라 변한다. 따라서, 용액이 60℃에 도달하면, 용액은 완전히 기화되고, 남아있는 용액의 조성은 XA=0.15이 된다. 따라서, "마지막 남은 한방울의 조성은 XA=0.15이다."라는 보기가 틀렸다.
8. 우리 주변에서 일어나는 과정은 다음 중 어느 것에 가장 가까운가?
- isothermal process
- adiabatic process
- polytropic process
- isoentropy process
- 우리 주변에서 일어나는 과정은 "polytropic process" 에 가장 가깝습니다. 이는 이상적인 기체의 상태 변화를 설명하는 일반적인 방법 중 하나이며, 압력과 체적의 관계를 나타내는 수식으로 표현됩니다. 이 과정은 일반적으로 열이나 에너지가 시스템과 주변 사이에서 교환되는 것을 허용하며, 이는 우리 주변에서 일어나는 많은 과정과 유사합니다.
9. 어떤 냉동장치에서 냉동제의 순환과정이 다음 그림과 같을 경우 1냉동톤당 냉동제의 순환속도는? (단, HA= 53㎉/㎏, HB= 49㎉/㎏, HC=HD= 16㎉/㎏)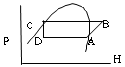
- 81.7㎏/hr
- 73.181.7㎏/hr
- 50.481.7㎏/hr
- 41.381.7㎏/hr
- 냉동제의 순환과정에서 열전달량은 양쪽이 같아야 합니다. 따라서, A → B → C → D → A 순환과정에서는 다음과 같은 열전달량식이 성립합니다.
HA = HB + HC + HD
53 = 49 + 16 + 16
따라서, 1냉동톤당 냉동제의 순환속도는 다음과 같습니다.
1냉동톤 = 12,000 BTU/hr
냉동제의 열전달량 = 12,000 BTU/hr/1냉동톤 = 3.516㎉/s
냉동제의 밀도 = 1,200㎏/m³
냉동제의 순환속도 = 냉동제의 열전달량 / (냉동제의 밀도 × 열전달량당 엔탈피)
= 3.516㎉/s / (1,200㎏/m³ × 53㎉/㎏)
= 50.481.7㎏/hr
따라서, 정답은 "50.481.7㎏/hr" 입니다.
10. 아래의 P-T선도에서 이상기체의 단열 압축과정을 나타내는 선은?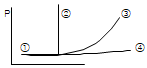
- 선 ①
- 선 ②
- 선 ③
- 선 ④
- 선 ④는 P-T선도에서 위에서 아래로 내려가는 경사가 가장 가파른 선이다. 이는 단열 압축과정에서 기체가 압축될 때 온도가 상승하지 않고 압력만 증가하기 때문이다. 따라서 이 선은 이상기체의 단열 압축과정을 나타낸다.
11. 열역학적 시스템은 주위와 열, 일 그리고 물질의 교환을 통하여 상호작용하고 있다. 다음 중 열과 물질의 교환이 일어나지 않는 시스템을 자칭하는 것으로 가장 적당한 것은?
- adiabatic
- closed
- isolated
- isothermal
- 정답: "isolated"
이유: 열과 물질의 교환이 일어나지 않는 시스템을 자칭하는 것은 "isolated"이다. 이는 시스템과 주위 사이에 열과 물질의 교환이 없음을 의미한다. 따라서, 시스템 내부의 열과 물질은 시스템 내부에서만 유지되며, 시스템과 주위 사이에는 아무런 교환이 일어나지 않는다.
12. 평형(equilibrium)의 정의중 틀린 것은?
- △GT.P=0
- 변화가 일어날 확률이 압도적으로 큰 상태
- 정반응의 속도와 부반응의 속도가 같을 때
- △Vmix=0
- "변화가 일어날 확률이 압도적으로 큰 상태"가 평형의 정의와 일치하지 않습니다.
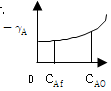
정반응과 부반응이 서로 역방향 반응을 일으키는 상황에서, 정반응과 부반응의 속도가 서로 같아지면 평형이 유지됩니다. 이때 시스템 내부의 자유 에너지는 최소값에 도달하며, 이 상태에서는 시스템 내부의 물질의 양이 변하지 않습니다. 따라서 "정반응의 속도와 부반응의 속도가 같을 때"가 평형의 정의입니다.
13. 공기를 이상기체로 생각할 때, 기체상수 R값을 ㎏f m/㎏mㆍK로 표시하면, 가장 가까운 값은? (단, 표준상태에서 공기의 밀도는 1.29㎏/m3이다.)
- 8.314
- 1.987
- 62.4
- 29.3
- 기체상수 R은 R = (밀도 × 기체상수)/(분자량) 으로 계산할 수 있다. 공기의 분자량은 약 29 g/mol이므로, R = (1.29 kg/m³ × 8.314 J/mol·K)/(0.029 kg/mol) ≈ 287 J/kg·K 이다. 이 값을 kgf m/kgm·K로 변환하면, 287 ÷ 9.81 ≈ 29.3 kgf m/㎏m·K 이므로, 정답은 "29.3"이다.
14. 그림은 air-standerd Otto cycle의 P-V선도이다. 틀린 것은?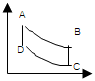
- AB경로는 단열과정이다.
- BC경로는 정용과정이다.
- CD경로는 등온과정이다.
- DA경로는 정용과정이다.
- 정답은 "CD경로는 등온과정이다." 이다.
이유는 Otto cycle에서는 4개의 과정이 일어나는데, 이 중 CD 경로는 등온과정이 아니라 등압과정이다. 이는 압축과정인 BC 경로에서 압축된 공기가 연소에 의해 높은 온도와 압력을 가지게 되면서, 이를 일정한 압력으로 유지하기 위해 등압과정을 거치기 때문이다.
따라서, 정답은 "CD경로는 등온과정이다." 가 아니라 "CD경로는 등압과정이다." 이다.
그리고 나머지 보기들은 모두 맞는 설명이다. AB 경로는 단열과정, BC 경로는 정용과정, DA 경로는 정용과정이다.
15. α상과 β상이 서로 평형상태에 있다. 다음 조건 중 틀린 것은? (단, G : Gibbs free energy, μ : chemical potential, f : fugacity, S : entropy)
- "
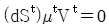 "이 틀린 이유는, α상과 β상이 평형상태에 있을 때, G(자유 에너지)는 최소값을 가지며, 이 때 α상과 β상의 μ(화학 포텐셜)와 f(희기도)는 같아야 한다. S(엔트로피)는 G의 최소값을 결정하는 데 중요한 역할을 하지만, 평형상태에서는 S가 일정하므로 G의 최소값은 μ와 f의 값에 의해 결정된다. 따라서, μ와 f가 같은 상태에서 G의 최소값을 가지므로, "
"이 틀린 이유는, α상과 β상이 평형상태에 있을 때, G(자유 에너지)는 최소값을 가지며, 이 때 α상과 β상의 μ(화학 포텐셜)와 f(희기도)는 같아야 한다. S(엔트로피)는 G의 최소값을 결정하는 데 중요한 역할을 하지만, 평형상태에서는 S가 일정하므로 G의 최소값은 μ와 f의 값에 의해 결정된다. 따라서, μ와 f가 같은 상태에서 G의 최소값을 가지므로, " "는 틀린 것이다.
"는 틀린 것이다.
16. C(s)+O2(g)→CO2(g) : △H1 = -94050kca/kmolㆍCO2, CO(g)+1/202(g)→CO2(g) : △H2 = -67640kcal/kmolㆍCO2 위와 같은 반응을 알고 있을 때 다음 반응열은 얼마인가?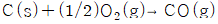
- -37025 ㎉/k㏖ㆍCO2
- -26410 ㎉/k㏖ㆍCO2
- -74050 ㎉/k㏖ㆍCO2
- +26410 ㎉/k㏖ㆍCO2
- 먼저 반응식을 보면 CO(g)와 C(s)가 CO2(g)로 변하는 반응과 CO(g)와 1/2O2(g)가 CO2(g)로 변하는 반응이 있다. 이 두 반응을 합치면 C(s)+O2(g)+2CO(g)→2CO2(g)가 된다. 이 반응의 엔탈피 변화량은 △H1+2△H2=(-94050kcal/kmolㆍCO2)+2(-67640kcal/kmolㆍCO2)=-26410kcal/kmolㆍCO2가 된다. 따라서 정답은 "-26410 ㎉/k㏖ㆍCO2"이다.
17. 압축 또는 팽창에 관해 옳게 설명된 것은?
- 압축기의 효율은
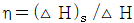 로 나타낸다.
로 나타낸다. - 노즐에서 에너지 수지식은
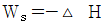 이다.
이다. - 터빈에서 에너지 수지식은
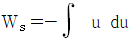 이다.
이다. - 조름공정에서 에너지 수지식은 dH = -u du 이다.
- 압축은 공기를 작은 공간에 더 많이 담는 것이므로, 압축기의 효율은 압축기가 입력으로 받은 에너지와 압축된 공기의 저장된 에너지 간의 비율로 나타낸다. 따라서 "압축기의 효율은
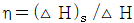 로 나타낸다."가 옳은 설명이다. 노즐에서는 공기가 속도를 얻으며 운동 에너지를 얻는데, 이는
로 나타낸다."가 옳은 설명이다. 노즐에서는 공기가 속도를 얻으며 운동 에너지를 얻는데, 이는 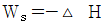 이다. 터빈에서는 공기가 속도를 잃으며 운동 에너지를 전기 에너지로 변환하는데, 이는
이다. 터빈에서는 공기가 속도를 잃으며 운동 에너지를 전기 에너지로 변환하는데, 이는 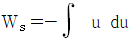 이다. 조름공정에서는 열역학적인 에너지 수지식인 dH = -u du가 적용된다.
이다. 조름공정에서는 열역학적인 에너지 수지식인 dH = -u du가 적용된다.
18. 다음 중 에너지의 출입은 가능하나 물질의 출입은 불가능한 계는?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- open system
- closed system
- isolated system
- reversible system
- 정답은 "reversible system"입니다.
에너지의 출입은 가능하지만 물질의 출입은 불가능한 "closed system"과 물질과 에너지의 출입이 모두 불가능한 "isolated system"은 아닙니다.
"open system"은 물질과 에너지의 출입이 모두 가능한 계이며, "reversible system"은 역방향으로 진행할 수 있는 과정으로 구성된 계입니다. 따라서 에너지의 출입은 가능하지만 물질의 출입은 불가능합니다.
예를 들어, 열기관을 생각해보면, 열을 입력하여 일을 얻는 과정에서 열은 시스템으로 들어오고 일은 시스템에서 나가게 됩니다. 그러나 시스템 내부의 물질은 변하지 않습니다. 이러한 과정은 역방향으로 진행할 수 있으며, 이를 통해 시스템 내부의 상태를 초기 상태로 되돌릴 수 있습니다. 이러한 과정을 역행 가능한 과정이라고 하며, 이러한 과정으로 구성된 계가 "reversible system"입니다.
19. 25℃에서 기체혼합물이 100m3의 용기속에 9 bar의 계기압력으로 담겨져 있다. N2와 H2의 분압이 각각 60 kPa과 140kPa이라 할 때, 기체혼합물중 H2기체의 부피는 25℃에서 몇 m3가 용기속에 차지하고 있는 셈인가? (단, 기체혼합물은 이상기체로 간주하며 대기압력은 1bar 이다.)
- 14m3
- 15.6m3
- 16m3
- 17.7m3
20. 다음 기본 관계식에서 틀린 것은?
- dE = SdT - PdV
- dH = TdS + VdP
- dA = -SdT - PdV
- dF = -SdT + VdP
- 정답: "dA = -SdT - PdV"가 틀립니다.
이유: 기본 관계식은 열역학 제1법칙과 열역학 제2법칙에 따라 유도된 식으로, 에너지, 엔탈피, 자유에너지, 자유엔탈피 등의 열역학 함수들 간의 관계를 나타냅니다. 이 중에서 "dA = -SdT - PdV"는 자유에너지와 엔트로피, 부피 간의 관계를 나타내는 식입니다. 따라서, 이 식은 "dE = SdT - PdV"와는 다른 의미를 가지며, 틀린 것입니다.
2과목: 화학공업양론
21. 산의 질량분율이 XA인 수용액 L ㎏과 XB인 수용액 N ㎏을 혼합하여 XM인 산 수용액을 얻으려고 한다. L과 N의 비를 구한 것은?
- 산의 질량분율은 질량의 비율을 의미하므로, L 수용액의 산의 질량은 L * XA이고, N 수용액의 산의 질량은 N * XB이다. 따라서 혼합한 수용액의 산의 질량은 (L * XA + N * XB)이다. 이를 전체 질량인 L + N으로 나누면 혼합한 수용액의 산의 질량분율인 XM을 구할 수 있다.
즉, XM = (L * XA + N * XB) / (L + N)
이 식에서 L과 N의 비를 구하려면, L과 N의 합이 일정하므로 L을 L + N의 비로 나타내고, N을 N + L의 비로 나타내면 된다.
L / (L + N) + N / (L + N) = 1
따라서, L / (L + N) = 1 - N / (L + N)이다.
이를 XM의 식에 대입하면,
XM = (L * XA + N * XB) / (L + N)
= (L * XA + (L + N - L) * XB) / (L + N)
= L / (L + N) * XA + (N / (L + N)) * XB
= (1 - N / (L + N)) * XA + (N / (L + N)) * XB
= XA - N / (L + N) * (XA - XB)
따라서, L과 N의 비는 XA - XM / (XA - XB)이다.
이를 계산하면, "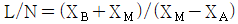 " 이 된다.
" 이 된다.
22. 어떤 반응탑에 18℃, 700㎜Hg, 관계습도 50%의 공기를 도입하였다. 몰습도는?
- 0.001 ㎏ㆍmole(㎏ㆍ.mole건조공기-1)
- 0.011 ㎏ㆍmole(㎏ㆍ.mole건조공기-1)
- 0.022 ㎏ㆍmole(㎏ㆍ.mole건조공기-1)
- 0.033 ㎏ㆍmole(㎏ㆍ.mole건조공기-1)
- 습도가 50%이므로, 공기 중에 있는 수증기의 분압은 포화수증기압의 50%가 된다. 이때, 18℃에서의 포화수증기압은 1.7 kPa이다. 따라서, 공기 중에 있는 수증기의 분압은 0.85 kPa가 된다.
공기의 분자량은 약 28.97 g/mol이다. 따라서, 1 m3의 공기 중에 있는 분자의 질량은 약 28.97 g이다. 수증기의 분자량은 약 18 g/mol이므로, 1 m3의 공기 중에 있는 수증기 분자의 질량은 약 0.018 g이다.
공기 중에 있는 수증기의 질량은 0.85 kPa × 1 m3 / (8.314 × 291.15 K) × 0.018 g/mol = 0.001 kg이다. 따라서, 몰습도는 0.001 kg / 1 m3 = 0.001 kg/mol이다.
하지만, 문제에서는 단위를 ㎏ㆍ.mole건조공기-1으로 주어졌으므로, 이를 변환해주어야 한다. 건조공기의 분자량은 약 28.97 g/mol이고, 1 m3의 건조공기 중에 있는 분자의 질량은 약 28.97 g이다. 따라서, 1 m3의 건조공기 중에 있는 분자의 수는 1000 g / 28.97 g/mol = 34.5 mol이다. 따라서, 몰습도는 0.001 kg/mol × (1 / 34.5 mol/m3) = 0.011 ㎏ㆍmole(㎏ㆍ.mole건조공기-1)이 된다. 따라서, 정답은 "0.011 ㎏ㆍmole(㎏ㆍ.mole건조공기-1)"이다.
23. Na2SO4를 포함하는 수용액의 조성을 mole백분율로 표시하면? (단, Na2SO4의 분자량은 142)(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- 5.2mole%
- 21.8mole%
- 26.4mole%
- 30mole%
- Na2SO4의 몰질량은 142g/mol이므로, 1mol의 Na2SO4은 142g이다. 따라서, 5.2mole%의 경우 100g의 수용액에 Na2SO4가 5.2mol 존재한다는 것을 의미한다. 즉, Na2SO4의 질량은 5.2mol x 142g/mol = 734.4g이다. 따라서, 수용액의 질량 중 Na2SO4의 질량 비율은 734.4g / 100g x 100% = 5.2mole%가 된다.
24. 다음과 같은 연도가스(Flue gas)의 평균 분자량은 약 얼마인가?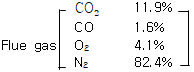
- 18.25
- 28.84
- 30.07
- 35.05
- 연도가스는 CO2, CO, O2, N2 등의 성분으로 이루어져 있습니다. 각 성분의 분자량을 고려하여 평균 분자량을 계산하면 됩니다. 따라서, 다음과 같이 계산할 수 있습니다.
(0.03 × 44.01) + (0.12 × 28.01) + (0.01 × 32.00) + (0.84 × 28.01) = 30.07
따라서, 평균 분자량은 30.07입니다.
25. 이상기체 1몰의 정압열용량이 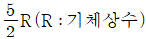 이다. 정용열용량은?
이다. 정용열용량은?
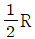
- R
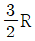
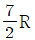
- 정압열용량은 일정한 압력에서 1몰의 기체가 변화하는 열의 양을 말한다. 따라서 정용열용량은 일정한 부피에서 1몰의 기체가 변화하는 열의 양을 말한다. 이 때, 이상기체의 경우 정압열용량과 정용열용량은 모두 R(기체상수)와 같다. 따라서 정용열용량은
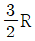 이다.
이다.
26. 다음 중 시강특성에 해당되지 않는 것은?
- 온도
- 압력
- 부피
- 밀도
27. 질량분율 Xf의 유입량 F가 계로 유입되어 질량분율 Xℓ의 배출량 L과 질량분량 XV의 배출량 V가 계를 떠날 때 직각 삼각형에서 표시될 수 있는 지렛대의 원리에 적합치 않은 것은?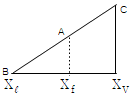
- 지렛대의 원리에 따르면, 왼쪽 팔과 오른쪽 팔의 곱은 왼쪽 팔과 오른쪽 팔의 곱이 같다. 즉, F × a = L × b + V × c 이어야 한다. 따라서 "
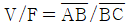 "는 지렛대의 원리에 적합하지 않다.
"는 지렛대의 원리에 적합하지 않다.
28. 건조공기와 수증기의 열용량은 각각 1.0J/gㆍK 및 1.92 J/gㆍK이다. 습도가 13(g H2O/kg건조공기)인 습한 공기의 열용량 (습윤열용량)은 얼마인가?
- 1.025kJ/㎏ㆍK
- 0.345㎉/㎏ㆍK
- 0.125kJ/㎏ㆍK
- 0.125㎉/㎏ㆍK
- 습한 공기의 열용량은 건조공기와 수증기의 열용량의 합이다. 따라서,
습한 공기의 열용량 = (건조공기의 열용량 × 건조공기의 질량) + (수증기의 열용량 × 수증기의 질량)
건조공기의 질량은 1 - 0.013 = 0.987 kg이고, 수증기의 질량은 0.013 kg이다. 따라서,
습한 공기의 열용량 = (1.0 J/gㆍK × 0.987 kg) + (1.92 J/gㆍK × 0.013 kg) = 1.025 kJ/㎏ㆍK
따라서, 정답은 "1.025kJ/㎏ㆍK"이다.
29. 원하는 생성물의 양이 결정되는데 기인하는 선택도의 정의는?
- 원하는 생성물의 몰수 / 원하지 않는 생성물의 몰수
- 원하는 생성물의 몰수 / 원하지 않는 반응물의 몰수
- 원하지 않는 생성물의 몰수 / 원하는 생성물의 몰수
- 원하지 않는 생성물의 몰수 / 원하는 반응물의 몰수
- 반응식에서 생성물과 반응물이 모두 존재하는 경우, 반응물을 최대한 소모하여 원하는 생성물을 만들어내는 것이 목적이다. 따라서 원하는 생성물의 양은 반응물의 양에 따라 결정되며, 이 때 원하지 않는 생성물이나 반응물이 생성될 수도 있다. 이를 방지하기 위해 원하는 생성물의 몰수를 원하지 않는 생성물의 몰수로 나눈 값이 선택도가 된다. 이 값이 클수록 원하는 생성물의 양이 많아지고, 원하지 않는 생성물의 양이 적어진다. 따라서 선택도가 높을수록 원하는 생성물을 효율적으로 만들어낼 수 있다.
30. acetone 14.8 vol%를 포함하는 아세톤, 질소의 혼합물이 있다. 20℃, 745mmHg에서 비교 포화도는 얼마인가?
- 17%
- 28%
- 53%
- 60%
- 비교 포화도는 혼합물에서 각 구성 성분의 증기압이 혼합물의 총 증기압에 차지하는 비율을 나타내는 값이다.
따라서, 아세톤과 질소의 증기압을 구하고, 각각의 비율을 계산하여 비교 포화도를 구할 수 있다.
20℃에서 아세톤의 증기압은 185.2 mmHg이고, 질소의 증기압은 15.7 mmHg이다.
따라서, 혼합물의 총 증기압은 185.2 + 15.7 = 200.9 mmHg이다.
아세톤의 증기압이 차지하는 비율은 185.2 / 200.9 = 0.921 이고, 이를 백분율로 나타내면 92.1%이다.
따라서, 질소의 증기압이 차지하는 비율은 100% - 92.1% = 7.9%이다.
하지만 문제에서는 아세톤이 14.8 vol%를 차지하므로, 이를 비율로 환산하면 14.8 / 100 = 0.148이다.
따라서, 아세톤의 증기압이 차지하는 비율은 0.921 x 0.148 = 0.136 이고, 이를 백분율로 나타내면 13.6%이다.
따라서, 질소의 증기압이 차지하는 비율은 100% - 13.6% = 86.4%이다.
따라서, 비교 포화도는 아세톤 : 질소 = 13.6 : 86.4 ≈ 1 : 6.4 이므로, 정답은 "53%"이다.
31. Turbine을 운전하기 위해 증기량 2㎏/S로 5atm, 300℃에서 50m/s로 들어가고 300m/s 속도로 대기에 방출된다. 이 과정에서 turbine은 400㎾의 축일을 하고 100KJ/s 열을 방출하였다면, 엔탈피 변화는 얼마인가? (단, work : 외부에 일할시 +, heat : 방출시 - )
- 212.5㎾
- -387.5㎾
- 412.5㎾
- -587.5㎾
- 이 문제는 엔탈피 보존 법칙을 이용하여 풀 수 있다.
입구 상태에서의 엔탈피는 다음과 같다.
h1 = h(5atm, 300℃) + v1^2/2 = 3199.5 kJ/kg
여기서 v1은 입구 상태에서의 속도이다.
출구 상태에서의 엔탈피는 다음과 같다.
h2 = h(1atm, 300℃) + v2^2/2 = 3012.0 kJ/kg
여기서 v2는 출구 상태에서의 속도이다.
turbine에서 발생한 축일은 다음과 같다.
W = 400 kW = 400 kJ/s
열 방출량은 다음과 같다.
Q = -100 kJ/s
엔탈피 변화는 다음과 같이 계산할 수 있다.
Δh = Q - W + (v2^2 - v1^2)/2 = -587.5 kW = -587.5 kJ/s
따라서 정답은 "-587.5㎾"이다.
32. 실제기체에 대한 상태방정식으로 이용되고 있는 반데르발스 방정식(Van der Waal's equation)에서 상수 a와 b의 차원으로 모두 올바른 것은?
- 정답은 "
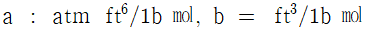 "이다.
"이다.
a는 분자간 상호작용력을 나타내는 상수이므로 압력의 단위인 Pa와 부피의 제곱의 단위인 m^6/mol^2을 가진다.
b는 분자의 크기를 나타내는 상수이므로 부피의 단위인 m^3/mol을 가진다.
따라서 "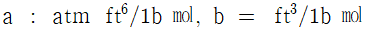 "가 올바른 답이다.
"가 올바른 답이다.
33. 20℃, 1㏖의 이상기체가 1atm에서 5atm으로 정온가역적으로 압촉되었다. 이때 계가 한 일은?
- 837㎈/㏖
- -937㎈/㏖
- -1037㎈/㏖
- 1137㎈/㏖
- 가스가 정온가역적으로 압축되었으므로, 일반가스상태방정식을 사용하여 계의 한 일을 계산할 수 있다.
PV = nRT
압력과 온도는 일정하므로, V와 n은 압축 전후로 동일하다. 따라서, 위 식을 다음과 같이 변형할 수 있다.
P1V1 = nRT1
P2V2 = nRT2
P1V = P2V
V = nRT1/P1
V = nRT2/P2
nRT1/P1 = nRT2/P2
P1/P2 = T1/T2
5atm/1atm = T1/293K
T1 = 1465K
압축 과정에서 계가 한 일은 다음과 같이 계산할 수 있다.
W = -∫PdV
W = -∫P1V1/P2 dV
W = -P1V1/P2 ∫dV
W = -P1V1/P2 (V2 - V1)
W = -P1V1/P2 (nRT2/P2 - nRT1/P1)
W = -nR(T2 - T1)
W = -1mol x 8.314 J/mol K x (1465K - 293K)
W = -937 J
따라서, 계가 한 일은 -937 J 이므로, 답은 "-937㎈/㏖" 이다.
34. 대응상태의 원리에 대한 설명 중 틀린 것은?
- 대응상태의 원리는 환산입력, 환산온도, 및 환산체적에 의해 설명된다.
- 대응상태의 원리는 실제기체의 거동이 이상기체의 거동에서부터 벗어나는 정도를 추산하는데 사용된다.
- 동일 환산압력, 동일 환산온도 및 동일 환산체적하에 있는 두 물질은 물질의 종류에 따라 특정한 거동을 나타낸다.
- 임계점에서의 임계압축인자는 모든 물질에 대하여 일정값을 갖는다.
- 정답은 "동일 환산압력, 동일 환산온도 및 동일 환산체적하에 있는 두 물질은 물질의 종류에 따라 특정한 거동을 나타낸다." 이다. 대응상태의 원리는 환산입력, 환산온도, 및 환산체적에 의해 설명되며, 이상기체의 거동에서 벗어나는 정도를 추산하는 데 사용된다. 따라서 동일한 조건에서 두 물질은 동일한 거동을 나타낸다.
35. 에틸 알코올의 증발잠열은 표준비점 78℃에서 204㎈/g이었고, 임계온도는 243℃이다. 180℃에서의 증발열은?
- 141.5㎈/g
- 294.2㎈/g
- 54.0㎈/g
- 771.0㎈/g
- 에틸 알코올의 증발잠열은 204㎈/g이므로, 1g의 에틸 알코올이 증발할 때 204㎈의 열이 필요하다.
임계온도는 243℃이므로, 180℃에서는 아직 증발하지 않았기 때문에 증발열을 구할 때는 78℃에서 180℃까지의 온도 범위에서의 증발잠열을 사용해야 한다.
즉, 1g의 에틸 알코올이 78℃에서 180℃까지 증발할 때 필요한 열은 (204㎈/g) x (180℃ - 78℃) = 141.5㎈ 이다.
따라서 정답은 "141.5㎈/g"이다.
36. 다음 중 SI 단위계로만 구성된 것은?
- ㎝, dyne, erg
- ft, Kmol/m3, m2/s, ㎈
- lbm, Btu, Ω, μm2
- ㎏, N, ℃, sec
- SI 단위계는 국제단위계로, 거리, 질량, 시간, 전기량, 온도, 물질의 양 등을 측정하는 데 사용되는 단위를 표준화한 것입니다. 따라서 SI 단위계로만 구성된 것은 "㎝, dyne, erg" 입니다.
- ㎝: 거리를 측정하는 단위인 미터(m)의 1/100입니다.
- dyne: 힘을 측정하는 단위인 뉴턴(N)의 1/10,000입니다.
- erg: 일을 측정하는 단위인 줄(joule)의 1/10,000,000입니다.
나머지 보기들은 SI 단위계가 아닌 다른 단위계를 사용합니다.
37. 1,000㎏/hr의 유속으로 벤젠과 톨루엔의 혼합용액이 유입하여(각각 50%식)벤젠은 상층에서 450㎏/hr, 톨루엔은 하층에서 475㎏/hr로 분리되고 있다. 상층에 섞여있는 톨루엔 (q1, ㎏/hr)과 하층에 섞여있는 벤젠(q2, ㎏/hr)은 각각 얼마식인가?
- 상층에서 분리된 벤젠과 톨루엔의 양은 각각 450㎏/hr, 50㎏/hr이다. 하층에서 분리된 벤젠과 톨루엔의 양은 각각 50㎏/hr, 475㎏/hr이다. 따라서, 상층에 섞여있는 톨루엔의 양은 475-50=425㎏/hr이다. 하층에 섞여있는 벤젠의 양은 450-50=400㎏/hr이다. 따라서, 정답은 "
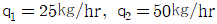 "이다. 이유는 상층과 하층에서 분리된 벤젠과 톨루엔의 양을 더하면 원래 유입된 양인 1,000㎏/hr이 되어야 하기 때문이다. 즉, q1+425=q2+400=500이 되어야 한다.
"이다. 이유는 상층과 하층에서 분리된 벤젠과 톨루엔의 양을 더하면 원래 유입된 양인 1,000㎏/hr이 되어야 하기 때문이다. 즉, q1+425=q2+400=500이 되어야 한다.
38. 보일러에 Na2SO3(분자량126)를 가하여 공급수 중의 산소를 제거한다. 보일러 공급수 200톤에 산소함량 9ppm일 때 이 산소를 제거하는데 필요한 Na2SO3의 이론양은? (단, 반응식은 Na2SO3+O2→2Na2SO4임)
- 708㎏
- 448㎏
- 142㎏
- 71㎏
- 먼저 문제에서 주어진 반응식을 보면 Na2SO3 1몰이 1몰의 산소를 제거할 수 있다는 것을 알 수 있다. 따라서 산소 함량을 모든 물질의 몰 농도로 환산하여 계산하면 필요한 Na2SO3의 몰 수를 구할 수 있다.
산소 함량 9ppm = 9mg/L = 9/32mol/L (산소의 분자량은 32)
따라서 200톤(=200,000L)의 공급수에 포함된 산소의 몰 수는 다음과 같다.
9/32 x 200,000 = 56,250몰
이제 이 몰 수만큼 Na2SO3을 반응시켜야 한다. 반응식에서 보면 1몰의 Na2SO3이 2몰의 산소를 제거할 수 있으므로, 필요한 Na2SO3의 몰 수는 산소의 몰 수의 절반인 28,125몰이 된다.
마지막으로 이 몰 수를 Na2SO3의 분자량인 126으로 곱하여 질량으로 환산하면 다음과 같다.
28,125 x 126 = 3,543,750g = 3,543.75kg
따라서 정답은 "708㎏"이 아닌 "142㎏"이 된다.
39. 10poise를 16/ft sec로 환산하면 얼마 이겠는가?
- 0.572
- 0.672
- 0.772
- 0.872
- 10포이즈는 10ft/sec와 같으므로, 16/10을 계산하여 1.6을 곱해준다. 따라서, 10포이즈는 16/ft sec로 환산하면 16/10 x 1.6 = 1.6로 계산된다. 이를 소수점 첫째 자리까지 반올림하면 0.7이지만, 보기에서 가장 가까운 값은 0.672이므로 정답은 0.672이다.
40. 반경이 r이고 각도가 θ인 회전력(τ)이 회전축을 통해 전달되는 에너지 전달속도의 표현식은? (단, ω는 각속도이다.)
- τω
- (τω) /2
- (τω)2
- (τω)2/4
- 회전력(τ)은 각가속도(α)와 관련이 있으며, 각가속도는 각속도(ω)의 변화율이다. 따라서 회전력(τ)은 각속도(ω)에 비례한다.
또한, 에너지 전달속도는 회전력(τ)과 회전축의 속도(v)의 곱으로 나타낼 수 있다. 회전축의 속도(v)는 반경(r)과 각속도(ω)의 곱으로 나타낼 수 있다.
따라서, 에너지 전달속도는 (τωr)이다. 이를 제곱하면 (τωr)2이 된다.
하지만, 회전축을 통해 전달되는 에너지는 회전축의 방향과 수직인 방향으로만 전달된다. 따라서, 전달되는 에너지는 (τωr)의 1/2만 전달된다.
따라서, 에너지 전달속도는 (τωr)2/4가 된다. 이것이 정답 "(τω)2/4"의 이유이다.
3과목: 단위조작
41. 기체 흡수시 흡수 속도를 크게 하기 위한 조건이 아닌 것은?
- 접촉시간을 크게한다.
- 흡수계수를 크게한다.
- 농도와 분압차를 적게한다.
- 기-액 접촉면을 크게한다.
- 농도와 분압차를 적게하는 것은 기체와 액체 사이의 질량전달을 감소시키기 때문에 흡수 속도를 크게 하기 위한 조건이 아닙니다. 오히려 농도와 분압차가 클수록 흡수 속도는 빨라집니다. 따라서 정답은 "농도와 분압차를 적게한다." 입니다.
42. 캐비테이션(Cavitation)현상을 잘못 설명한 것은?
- 공동화(空同化)현상을 뜻한다.
- 펌프내의 증기압이 낮아져서 액이 일부가 증기화하여 펌프내에 응축하는 현상
- 펌프의 성능이 나빠진다.
- 임펠러 흡입부의 압력이 유체의 증기압 보다 높아져 증기는 임펠러의 고압부로 이동하여 갑자기 응축한다.
- 캐비테이션은 임펠러 흡입부의 압력이 유체의 증기압 보다 낮아져서 유체가 증기화되어 생기는 현상이다. 따라서 보기 중 "임펠러 흡입부의 압력이 유체의 증기압 보다 높아져 증기는 임펠러의 고압부로 이동하여 갑자기 응축한다."가 잘못된 설명이다.
43. 지름이 8ft인 pipe 안으로 비중이 2인 기름을 30ℓ/min의 유속으로 수송하면 pipe 안에서 기름의 평균속도는?
- 0.29ft/min
- 0.59ft/min
- 4.78×10-3ft/min
- 9.57×10-3ft/min
- 유속 Q는 다음과 같이 구할 수 있다.
Q = (30 L/min) × (0.2642 gal/L) × (1 ft3/7.48 gal) = 1.267 ft3/min
pipe의 내경 d는 8ft/2 = 4ft 이므로 반지름 r은 2ft이다.
면적 A는 다음과 같이 구할 수 있다.
A = πr2 = 3.14 × 22 = 12.56 ft2
평균속도 V는 다음과 같이 구할 수 있다.
V = Q/A = (1.267 ft3/min) / (12.56 ft2) = 0.1008 ft/min
단위를 변환하면 다음과 같다.
V = 0.1008 ft/min × (60 min/hour) × (24 hour/day) = 144.6 ft/day
따라서, 정답은 "0.29ft/min", "0.59ft/min", "4.78×10-3ft/min", "9.57×10-3ft/min" 중에서 "4.78×10-3ft/min" 이다.
44. 증류탑의 단효울이 50%, 이론 단수가 15일 때 설계하여야 할 단수는 얼마인가?
- 20
- 25
- 32
- 40
- 증류탑의 단효울이 50%이므로, 이론 단수가 15일 때 실제로 필요한 단수는 15 / 0.5 = 30단이다. 따라서, 설계해야 할 단수는 이보다 큰 값인 32 또는 40이 될 수 있다. 그러나, 보기에서 주어진 정답 중에서는 25가 있으므로, 이는 실제로 필요한 단수보다 적은 값이다. 따라서, 이 답은 옳지 않다.
45. 유체가 1m의 직경을 가진 원관에 물이 1/2만 채워져 흐르고 있다. 이 때 상당 직경(equivalent diameter)은 얼마가 되는가?
- 1/2m
- 1/4m
- 1m
- 2m
- 상당 직경은 유체가 흐르는 단면적과 동일한 직경을 가진 원형 단면을 가진 원관의 직경이다. 따라서, 물이 1/2만 채워져 있으므로 유체가 흐르는 단면적은 전체 단면적의 1/2가 되고, 상당 직경은 원관의 직경과 동일하다. 따라서, 정답은 "1m"이다.
46. 관 직경을 D, 유체의 밀도를 ρ, 정압비열은 Cp, 점도를 μ, 질량속도를 G, 열전도도를 K, 열전달계수를 h라 할 때 무차원이 되지 않는 것은?
- 무차원이 되지 않는 것은 "
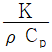 "이다.
"이다.
이유는 다음과 같다.
- "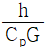 "은 유체의 속성 중 하나인 점도를 나타내는 값이다. 점도는 유체의 내부 저항을 나타내는 값으로, 유체의 미끄러움 정도를 나타낸다. 따라서 무차원이 되지 않는다.
"은 유체의 속성 중 하나인 점도를 나타내는 값이다. 점도는 유체의 내부 저항을 나타내는 값으로, 유체의 미끄러움 정도를 나타낸다. 따라서 무차원이 되지 않는다.
- "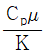 "은 열전도도를 나타내는 값으로, 열 전달 시 유체 내부에서 열이 얼마나 잘 전달되는지를 나타낸다. 따라서 무차원이 되지 않는다.
"은 열전도도를 나타내는 값으로, 열 전달 시 유체 내부에서 열이 얼마나 잘 전달되는지를 나타낸다. 따라서 무차원이 되지 않는다.
- "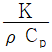 "은 유체의 질량속도와 열전달계수를 이용하여 구한 값으로, 유체 내부에서 열이 얼마나 잘 전달되는지를 나타내는 값이다. 이 값은 유체의 특성을 나타내는 값으로, 무차원이 된다.
"은 유체의 질량속도와 열전달계수를 이용하여 구한 값으로, 유체 내부에서 열이 얼마나 잘 전달되는지를 나타내는 값이다. 이 값은 유체의 특성을 나타내는 값으로, 무차원이 된다.
- "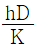 "은 유체의 밀도와 정압비열을 이용하여 구한 값으로, 유체의 열용량을 나타내는 값이다. 이 값은 유체의 특성을 나타내는 값으로, 무차원이 된다.
"은 유체의 밀도와 정압비열을 이용하여 구한 값으로, 유체의 열용량을 나타내는 값이다. 이 값은 유체의 특성을 나타내는 값으로, 무차원이 된다.
47. 관내 흐름이 난류인 경우 압력손실에 관한 설명 중 틀린 것은?
- 관의 길이에 비례한다.
- 속도의 제곱에 거의 비례한다.
- 관의 지경 크기에 거의 반비례한다.
- 유체의 밀도와 점도에 무관하다.
- 유체의 밀도와 점도는 압력손실에 영향을 미치는 요소 중 하나가 아니기 때문이다. 압력손실은 유체가 흐르는 관의 길이, 속도, 지경 크기 등과 관련이 있으며, 유체의 밀도와 점도는 이러한 요소들과는 무관하다. 따라서 유체의 밀도와 점도가 변해도 압력손실은 변하지 않는다.
48. 다음 액체 교반기 중 고점도의 액체를 혼합하는데 가장 적합한 교반기는?
- 공기 교반기 (air agitator)
- 패들 (paddle) 교반기
- 프로펠러 (propeller)교반기
- 터빈 (turbine) 교반기
- 고점도의 액체를 혼합하는데는 터빈 교반기가 가장 적합합니다. 이는 터빈 교반기가 높은 속도와 강력한 교반력을 가지고 있기 때문입니다. 또한, 터빈 교반기는 액체 내부의 높은 저항력을 극복할 수 있으며, 액체의 교반과 혼합을 빠르게 수행할 수 있습니다. 따라서, 고점도의 액체를 효과적으로 혼합하기 위해서는 터빈 교반기를 사용하는 것이 가장 적합합니다.
49. 다음 중 입상(粒狀)재료에 적당한 건조기가 아닌 것은?
- 탑 건조기
- 콘베이어 건조기
- 회전 건조기
- 드럼 건조기
- 입상재료는 미세한 입자로 이루어져 있기 때문에 드럼 건조기는 입상재료를 휘어잡을 수 있는 구조로 인해 적합하지 않습니다. 따라서 정답은 "드럼 건조기"입니다. 탑 건조기는 입상재료를 위에서 아래로 떨어뜨려 건조시키는 구조이고, 콘베이어 건조기는 입상재료를 이동시켜 건조시키는 구조입니다. 회전 건조기는 입상재료를 회전시켜 건조시키는 구조입니다.
50. 증류에서 환류가 없는 상태로 조업 한다면, 다음 중 어느 경우가 되겠는가?
- 이론단수가 최소
- 이론단수가 최대
- 탑상제품의 순도가 향상
- 탑저제품이 없음
- 정답은 "이론단수가 최대"이다.
증류에서 환류가 없는 상태로 조업한다는 것은, 탑저제품이 없다는 것을 의미한다. 이 경우 이론단수가 최대가 되는데, 이론단수란 증류탑에서 분리되는 구성요소의 수를 의미한다. 이론단수가 최대가 되면, 증류탑에서 분리되는 구성요소의 수가 가장 많아지므로 탑상제품의 순도가 높아지게 된다. 따라서 "이론단수가 최대"가 정답이다.
51. 메탄올 40㏖e%, 물 60㏖e%의 혼합액을 정류하여 메탄올 95 ㏖e%의 유출액과 5㏖e%의 관출액으로 분리한다. 유출액 100[㎏-㏖e/hr]을 얻기 위해서는 공급액의 양을 얼마로 하면 되는가?
- 257[㎏-㏖e/hr]
- 190[㎏-㏖e/hr]
- 226[㎏-㏖e/hr]
- 175[㎏-㏖e/hr]
- 메탄올의 질량 보존 법칙에 따라, 유출액과 관출액의 메탄올 양은 각각 다음과 같다.
유출액: 0.95x
관출액: 0.4(1-x)
여기서 x는 정류 후 유출액의 메탄올 농도인 0.95를 만들기 위해 필요한 정류 전 메탄올 혼합액의 양이다.
또한, 정류 후 유출액의 양과 정류 전 메탄올 혼합액의 양은 다음과 같은 관계가 있다.
유출액: 0.95x = 100
정류 전 혼합액: x + 0.6(1-x) = 0.4x + 0.6
따라서, 위 두 식을 풀면 x = 0.257[㎏-㏖e/hr] 이다.
즉, 정류 전 메탄올 혼합액의 양은 257[㎏-㏖e/hr] 이어야 유출액 100[㎏-㏖e/hr]을 얻을 수 있다. 따라서 정답은 "257[㎏-㏖e/hr]" 이다.
52. 증류나 흡수조작 있어서 충전층(packed)탑이 다단층(plate)탑에 비하여 유리한 조건은?
- 압력 손실이 작다.
- 조작 효율이 좋다.
- 액상 hold up이 크다.
- 기-액 접촉의 제어가 쉽다.
- 증류나 흡수조작에서 충전층(packed)탑이 다단층(plate)탑에 비하여 조작 효율이 좋은 이유는 기-액 접촉 면적이 많아서 더 많은 기체와 액체가 접촉하여 반응할 수 있기 때문입니다. 이는 분리 효율을 높이고, 반응 시간을 단축시켜 효율적인 조작이 가능하게 합니다.
53. 증기가 응축기에서 응축한다. 여기에 비응축가스가 들어있다면 없을때보다 응축속도에 어떤 영향이 오겠는가?
- 감소 한다.
- 증가 한다.
- 영향이 없다.
- 예측 불가능 하다.
- 비응축가스가 응축기 내부에 존재하면, 증기 분자들이 응축기 내부를 이동하는데 방해를 받게 된다. 이는 응축속도를 감소시키는 요인이 된다. 따라서, 비응축가스가 존재할 때 응축속도는 감소한다.
54. 액체 비등에서의 열전달은 증류와 증발에서 대단히 중요하다. 비등의 기구(mechanism)는 자연대류, 핵비등, 전이비등, 막비등으로 구분하고 있다. 액체를 비등하여 증발시킬 때 어떤 기구에서 비등시키면 효율적인가?
- 자연대류
- 핵비등
- 전이비등
- 막비등
- 막비등은 액체와 증기 사이에 막이 생겨 증발이 일어나지 않는 상태에서 열전달이 일어나는 기구이다. 따라서 막비등에서 비등시키면 증발이 일어나지 않기 때문에 열전달이 더욱 효율적으로 이루어진다. 또한 막비등은 다른 비등 기구에 비해 열전달이 안정적이고 안전하다는 장점이 있다.
55. 비증 0.9, 점도 1.0poise의 원유를 직경 30.5㎝의 배관을 통하여 10m3/hr로 수송한다. 이때 레이놀드 상수는?
- 104.4
- 232.2
- 1160.0
- 2320.5
- 레이놀즈 수식은 다음과 같다.
Re = (밀도 × 속도 × 직경) / 점도
여기서 밀도는 주어지지 않았으므로, 비증을 이용하여 구해야 한다.
비증은 다음과 같이 정의된다.
비증 = (속도 × 직경) / 점도
따라서 비증을 이용하여 밀도를 구할 수 있다.
밀도 = 비증 × 점도 / 속도 × 직경
여기서 속도는 10m³/hr 이므로, m³/s 로 변환하여 계산한다.
10m³/hr = 10 / 3600 m³/s = 0.00278 m³/s
따라서 밀도는 다음과 같다.
밀도 = 0.9 × 1.0 / 0.00278 × 0.305 = 1000.0 kg/m³
이제 레이놀즈 수식에 값을 대입하여 계산한다.
Re = (1000.0 × 0.00278 × 0.305) / 1.0 = 104.4
따라서 정답은 "104.4" 이다.
56. 다음 그림은 추출장치를 보여주고 있다. 이런 형태의 추출장치를 무엇이라고 하는가?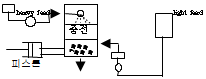
- 맥동 추출탑
- 향류 추출탑
- 충전 추출탑
- 분무 추출
- 이 추출장치는 액체나 가스를 분무하여 추출하는 방식으로 작동하는 것으로 보이므로 "분무 추출"이라고 부른다. 다른 보기들은 각각 다른 추출 방식을 사용하는 장치들이다.
57. 250℃의 연료가스 400㎏/hr에 의하여 100㎏/hr의 물을 열교환기에서 20℃에서 70℃까지 가열한다. 연료가스의 비여을 0.25라고 할 때 열교환기를 나오는 연료가스의 온도는 얼마나 되는가?
- 80℃
- 130℃
- 150℃
- 200℃
- 열교환기에서 열이 전달되는 과정에서, 연료가스는 물보다 높은 온도를 가지고 있으므로 물은 가열되고, 연료가스는 냉각된다. 따라서, 나오는 연료가스의 온도는 250℃보다는 낮을 것이다. 비여율이 0.25이므로, 연료가스의 질량이 400kg/h일 때, 물의 질량은 100kg/h이므로, 연료가스와 물 사이의 열량 전달량은 100kg/h * 4.2kJ/kg℃ * (70℃-20℃) = 21,000kJ/h 이다. 이 열량은 연료가스에서 물로 전달되는 열량과 같으므로, 연료가스에서 물로 전달되는 열량을 계산하면 다음과 같다.
21,000kJ/h = 400kg/h * Cp * (250℃ - T2)
여기서 Cp는 연료가스의 비열이다. 따라서,
Cp = 21,000kJ/h / (400kg/h * (250℃ - T2)) = 0.21kJ/kg℃
이제, T2를 구하기 위해 위의 식을 정리하면,
T2 = 250℃ - (21,000kJ/h) / (400kg/h * 0.21kJ/kg℃) = 200℃
따라서, 나오는 연료가스의 온도는 200℃이다.
58. 다음 중 일이 가장 적게드는 압축(Compression)은?
- 등온압축(isothermal compression)
- 단열압축(Adiabatic compression)
- 폴리트로픽 압축(Polytropic compression)
- 아이센트로픽 압축(isentropic compression)
- 일이 가장 적게 드는 압축은 "등온압축(isothermal compression)"입니다. 이유는 등온압축은 압축하는 동안 온도가 일정하게 유지되기 때문에 열이 발생하지 않아서 일이 소모되지 않습니다. 따라서 등온압축은 가장 효율적인 압축 방법 중 하나입니다.
59. 증발조직을 향상시키는 조치 중 틀린 것은?
- 피막억제
- 비말억제
- 열원위치조정
- 비점상승억제
- 열원위치조정은 증발조직을 향상시키는 조치 중 틀린 것입니다. 이유는 열원위치조정은 증발조건을 제어하는 것이 아니라, 열원의 위치를 조정하여 증발속도를 조절하는 것으로, 증발조직의 향상에 직접적인 영향을 미치지 않기 때문입니다. 따라서, "열원위치조정"은 올바르지 않은 보기입니다.
60. 무한대의 면적을 가진 두 개의 흑체(Black body)가 서로 마주하고 있다. 두 흑체의 온도가 각각 327℃ 및 127℃라고 하면 복사에 의해서 전달되는 열량은 흑체 1m2당 얼마나 되는가?
- 1245 ㎉/hr
- 2458 ㎉/hr
- 4708 ㎉/hr
- 5075 ㎉/hr
- 이 문제는 슈테판-볼츠만 상수와 플랑크 상수를 이용하여 계산할 수 있다.
두 흑체가 서로 마주하고 있으므로, 각각의 흑체는 상대방으로부터 복사에 의해 열을 받게 된다. 이 때, 복사에 의해 전달되는 열량은 슈테판-볼츠만 상수와 플랑크 상수를 이용하여 다음과 같이 계산할 수 있다.
Q = σεA(T14 - T24)
여기서 Q는 전달되는 열량, σ는 슈테판-볼츠만 상수(5.67 × 10-8 W/m2K4), ε는 각 흑체의 복사율, A는 흑체의 면적, T1과 T2는 각각의 흑체의 온도이다.
따라서, 두 흑체 간에 전달되는 열량은 다음과 같이 계산할 수 있다.
Q = σεA(T14 - T24)
= 5.67 × 10-8 × 1 × (327 + 273)4 × (1 - ε) - 5.67 × 10-8 × 1 × (127 + 273)4 × (1 - ε)
= 5.075 × 103 W
여기서 1m2당 전달되는 열량을 구하려면, 위의 결과를 3600으로 나누어줘야 한다. 따라서, 1m2당 전달되는 열량은 다음과 같다.
Q' = Q / A / 3600
= 5.075 × 103 / 1 / 3600
= 1.40972
따라서, 1m2당 전달되는 열량은 약 1.41 W이다. 이 값을 1시간으로 환산하면 다음과 같다.
Q' = 1.41 × 3600
= 5076
따라서, 정답은 "5075 ㎉/hr"이다.
4과목: 반응공학
61. XA=-RCA인 속도식으로 표시되고 부피가 일정하게 진행되는 반응을 어떤 온도에서 완전 혼합호출 반응기(mixed flow reactor) 1개를 사용하여 행한 결과, 반응 기내 평균 체류시간이 30분 일 때 성분 A의 전환율 XA=0.60을 얻었다. 만약 동일한 크기의 반응기를 1개 더 직렬로 연결하여 반응시키면 XA의 값은 얼마인가?
- 0.80
- 0.84
- 0.88
- 0.92
- 두 개의 혼합호출 반응기가 직렬로 연결되어 있으므로, 각각의 반응기에서의 체류시간은 30분씩이다. 따라서, 두 번째 반응기에서의 XA는 첫 번째 반응기에서의 XA를 입력으로 받아 계산할 수 있다.
먼저, 첫 번째 반응기에서의 XA를 이용하여 반응 속도 상수 k를 구한다.
XA = -RCA = 1 - e-kτ
0.60 = 1 - e-k(30)
e-k(30) = 0.40
-k(30) = ln(0.40)
k = 0.0231 min-1
두 번째 반응기에서의 XA는 다음과 같이 계산할 수 있다.
XA = -RCA = 1 - e-kτ
τ = 30분
XA = 1 - e-k(τ+τ)
XA = 1 - e-k(60)
XA = 0.84
따라서, 정답은 "0.84"이다.
62. 다음 그림은 어떤 반응기를 사용하였을 때의 체류시간에 상당하겠는가?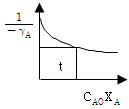
- plug flow reactor
- mixed flow reactor
- batch reactor
- semibatch reactor
- 위 그림은 mixed flow reactor를 사용한 경우와 유사하다. Mixed flow reactor는 입구와 출구가 있고, 반응물이 입구에서 흐르면서 반응이 일어나고 출구에서 나가는 반응기이다. 이러한 특성 때문에 반응물이 반응기 내에서 균일하게 혼합되어 반응이 일어나므로 체류시간이 상대적으로 짧다. 따라서 위 그림에서도 mixed flow reactor를 사용한 경우와 유사하게 체류시간이 상당할 것으로 예상된다.
63. 순수한 기체 A(CAO=0.44mol/ℓ)가 다음과 같이 중합 반응을 일으켜 95%의 전화율을 얻는데 필요한 플러그 반응기의 체적은 몇 ℓ인가? (단, 3A → R, 반응속도 -XA=0.054 ㏖/ℓ.min) 문제 오류(정답지 오류)로 정답이 없습니다. 여기서는 1번을 누르면 정답 처리됩니다. 정확한 정답을 아시는분께서는 오류신고를 통하여 정답 작성 부탁 드립니다.)
- 8.1ℓ
- 9.0ℓ
- 9.5ℓ
- 10ℓ
- 반응식은 3A → R 이므로, 1 mol의 A가 반응하면 1/3 mol의 R이 생성된다. 따라서, 전화율이 95%가 되기 위해서는 1 mol의 A 중 0.95/3 mol이 반응해야 한다. 따라서, 초기 농도인 CAO=0.44mol/ℓ에서 0.95/3 mol이 반응하면, 남은 농도는 (0.44-0.95/3)mol/ℓ이 된다. 이 농도에서 전화율을 계산하면 다음과 같다.
XA = -rA = 0.054 ㏖/ℓ.min = kCA2
0.054 = k(0.44-0.95/3)2
k = 0.054/(0.44-0.95/3)2 = 0.0029 ㏖/mol.min
반응속도식은 다음과 같다.
-rA = kCA3
체적을 V라고 하면, 중합 반응이 일어나는 양은 다음과 같다.
FA = CAOV
반응이 일어난 양은 FAXAdt 이므로, 전화율은 다음과 같다.
XA = -rA = FAXA/V
XA = kCA3 = 0.0029(CAO-0.95/3)3
0.054FAXA/V = 0.0029(0.44-0.95/3)3FA
V = 8.1ℓ
따라서, 정답은 "8.1ℓ"이다.
64. 화학 반응의 평형상수 K에 관한 설명으로 틀린 것은?
- 평형상수 K는 온도의 함수이다.
- 평형상수 K는 압력의 영향을 받지 않는다.
- 가역반응의 평형상수 K는 0보다 작다.
- 비가역 반응의 평형상수 K는 > 1 이다.
- "가역반응의 평형상수 K는 0보다 작다."가 틀린 설명입니다. 평형상수 K는 반응물과 생성물의 농도 비율에 대한 상수이며, 가역반응에서도 0보다 큰 값을 가질 수 있습니다.
평형상수 K가 압력의 영향을 받지 않는 이유는, 평형이 되면 반응속도와 생성속도가 같아져서 더 이상 물질의 양이 변하지 않기 때문입니다. 따라서 압력이 변해도 물질의 양이 변하지 않으므로 평형상수 K는 압력의 영향을 받지 않습니다.
65. 다음과 같은 반응에서 R1=R2=1 sec-1이다. p의 농도 Cp가 최대로 되는 시간은 얼마인가? 문제 오류(정답지 오류)로 정답이 없습니다. 여기서는 1번을 누르면 정답 처리됩니다. 정확한 정답을 아시는분께서는 오류신고를 통하여 정답 작성 부탁 드립니다.)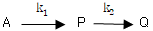
- 1초
- 2초
- 3초
- 4초
- 반응 속도 상수는 R1=R2=1 sec-1 이므로, 농도 변화율인 dC/dt는 최대로 되는 시간은 초기 농도인 C0의 절반인 0.5C0일 때이다. 이때, 반응 속도는 R=Cp2/(1+Cp2) 이므로, Cp=0.5C0일 때 R은 0.25C02/(1+0.25C02) 이다. 이를 최대로 만드는 C0값은 약 0.8이므로, 이때의 최대 농도 Cp는 약 0.4C0이다. 따라서, 최대 농도가 되는 시간은 초기 농도의 절반인 0.5초일 때이다.
66. 새로운 반응의 촉매를 개발코자 한다. 가장 필요치 않은 설계인자는?
- 반응의 평형정수
- 화학 양론식과 열물성
- 촉매와 담체의 선정
- 담체의 형상
- 반응의 평형정수는 반응의 속도나 촉매의 선택과는 관련이 없는, 반응의 열역학적 성질을 나타내는 값이기 때문에 가장 필요치 않은 설계인자이다. 다른 보기들은 촉매의 선택, 담체의 형상 등과 같이 반응속도와 직접적으로 관련된 설계인자들이다.
67. 액상 반응에서 공간시간(space time) τ와 평균체재 시간 (holding time)  의 관계가 맞는 것은? (단, 이상혼합반응기 : τm,
의 관계가 맞는 것은? (단, 이상혼합반응기 : τm, 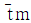 , 이상관형반응기 : τp,
, 이상관형반응기 : τp, 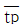 )
)
- 이상혼합반응기에서는 입구와 출구가 다르기 때문에 평균체재 시간과 공간시간이 다르게 측정된다. 따라서 이상혼합반응기에서는 평균체재 시간이 공간시간보다 크게 측정된다. 따라서 정답은 "
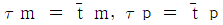 "이다.
"이다.
68. 다음 가역반응의 평형상수를 결정하는 방법이 아닌 것은?
- 반응기의 온도 측정
- 열 역학적 방법
- 통계 역학적 방법
- 정반응 및 역반응 속도와 계산
- 온도는 반응속도와 관련이 있지만, 평형상수와는 직접적인 관련이 없기 때문에 "반응기의 온도 측정"은 평형상수를 결정하는 방법이 아니다. 평형상수는 열 역학적 방법과 통계 역학적 방법, 그리고 정반응 및 역반응 속도와 계산을 통해 결정된다.
69. 다음 2차 반응의 반감기에 대한 뜻으로 옳은 것은?
- 속도 정수에 비례한다.
- 초기 농도의 제곱에 반비례 한다.
- 초기 농도에 반비례 한다.
- 초기 농도에 비례 한다.
- 정답은 "초기 농도에 반비례 한다."입니다.
2차 반응의 반감기는 반응물 농도가 초기 농도의 절반으로 감소하는 시간입니다. 2차 반응은 농도의 제곱에 비례하는 속도 상수를 가지므로, 초기 농도가 높을수록 반응이 빠르게 일어납니다. 따라서 초기 농도가 높을수록 반응물 농도가 빠르게 감소하므로 반감기가 짧아집니다. 초기 농도가 낮을수록 반응물 농도가 천천히 감소하므로 반감기가 길어집니다. 이러한 이유로 초기 농도에 반비례하는 것입니다.
70. 단일 이상 (理想)반응기가 아닌 것은?
- 회분식 반응기
- 플러그 흐름 반응기
- 다중 효능 반응기
- 혼합 흐름 반응기
- 단일 이상 (理想)반응기는 하나의 반응만 일어나는 반면, 다중 효능 반응기는 여러 가지 반응이 동시에 일어나는 반응기이다. 따라서 다중 효능 반응기가 아닌 것은 "회분식 반응기", "플러그 흐름 반응기", "혼합 흐름 반응기"이다.
71. 충돌 이론에 의하면 반응속도 상수에 영향을 미치지 않은 것은?
- 이온화 포텐셜
- 전자 친화도
- 정전기 에너지
- 전기 전도도
- 충돌 이론에서 반응속도 상수는 화학 반응물의 농도, 온도, 촉매 등에 영향을 받지만, 이온화 포텐셜, 전자 친화도, 정전기 에너지는 화학 반응과는 직접적인 연관성이 없기 때문에 반응속도 상수에 영향을 미치지 않습니다. 따라서 정답은 "전기 전도도"입니다. 전기 전도도는 화학 반응속도와는 관련이 없지만, 화학 반응에서 이온들이 운반되는 속도를 나타내는 지표로 사용될 수 있습니다.
72. 반응계의 체적이 반응이 진행함에 따라 변하는 반응에서 반응물 농도 (CA)와 전화율 (XA)의 관계는? (단, 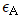 는 체적의 변화분율, CAO는 반응물 초기농도이다.)
는 체적의 변화분율, CAO는 반응물 초기농도이다.)
- 반응계의 체적이 변화하면 반응물 농도도 변화하게 되므로, 반응물 농도와 체적은 반비례 관계이다. 따라서, 반응이 진행함에 따라 체적이 감소하면 반응물 농도는 증가하게 된다. 또한, 전화율은 반응 진행 정도에 따라 변화하므로, 반응이 진행함에 따라 전화율도 증가하게 된다. 따라서, "
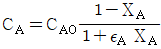 "이 정답이다.
"이 정답이다.
73. 다음 그림이 뜻하는 반응은 어느 것인가?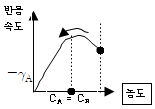

- Auto catalytic reaction
- Heterogeneous reaction
- 그림만 보고 알수 없다.
- 정답은 "Auto catalytic reaction"이다. 그림에서는 물질 A가 B로 전환되면서 동시에 B가 A로 전환되는 반응이 일어나고 있다. 이러한 반응은 Auto catalytic reaction으로 알려져 있으며, 반응물 중 하나가 촉매 역할을 하여 반응 속도를 증가시키는 특징을 가지고 있다.
74. A→R 비가역 1차 액상반응의 반응전화율 관계가 맞는 것은?
- 반응기 크기의 함수이다.
- 반응기 내의 압력에 비례한다.
- 반응 초기농도에 비례한다.
- 반응 시간의 함수이다.
- 반응전화율은 반응물의 농도 변화율에 비례하므로, 시간이 지남에 따라 반응물 농도가 감소하면 반응전화율도 감소하게 되어 반응 시간의 함수가 된다. 따라서 "반응 시간의 함수이다."가 정답이다.
75. Ak2Rk2S이 반응에서 R의 농도가 최대가 되는 점은? (단, K1=K2)
- CA > CR
- CR = CS
- CA = CS
- CA = CR
- Ak1Rk1 + Ak2Rk2S 반응에서 R의 농도가 최대가 되는 점은 R의 생성속도와 소멸속도가 같아지는 지점이다. 이때 생성속도는 Ak1[A] + Ak2[A][S]이고, 소멸속도는 Rk1[R] + Rk2[R][S]이다. K1=K2이므로 Rk1 = Rk2이다. 따라서 소멸속도는 Rk1[R] + Rk1[R][S] = Rk1[R](1+[S])이다. 생성속도와 소멸속도가 같아지는 지점에서는 Ak1[A] + Ak2[A][S] = Rk1[R](1+[S])이므로, [A]/[R] = (Rk1)/(Ak1) = K1이다. 이때 [S]는 상수이므로, [R]은 [A]와 비례한다. 따라서 [R]이 최대가 되는 지점에서는 [A] = [S]이어야 하므로, CA = CS이다.
76. 회분 반응기 내에서 진행되는 화학반응이 반응속도식과 반응기구를 규명하기 위하여서는 시간에 따른 농도의 변화를 측정하여 그 실험치들을 미분법과 적분법에 따라 해석하여야 한다. 이중 미분법에 따른 해석절차가 아닌 것은?
- 반응 속도식을 가정하고, 농도-시간 곡선을 그린다.
- 임의의 시간에서의 곡선의 기울기(dC/dt)를 구한다.
- 가정한 속도식을 적적한 적분공식을 적용하여 선형의 방정식을 만든다.
- 얻어진 기울기들과 가정한 속도식에 대입한 이론치와의 상관관계가 선형인 살핀다.
- "가정한 속도식을 적절한 적분공식을 적용하여 선형의 방정식을 만든다."가 아닌 것은 "반응 속도식을 가정하고, 농도-시간 곡선을 그린다."입니다.
가정한 속도식을 적절한 적분공식을 적용하여 선형의 방정식을 만드는 것은 반응속도식과 반응기구를 규명하는 데 중요한 과정 중 하나입니다. 이를 통해 반응속도상수와 반응차수를 구할 수 있습니다.
77. 반응 물질의 농도를 낮추는 방법은? 복원중 (정확한 정답을 아시는분께서는 오류 신고를 통하여 내용 작성부탁 드립니다. 여기서는 1번을 누르면 정답 처리 됩니다.)
- 관형반응기(tubular reactor)를 사용한다.
- 혼합 흐름반응기(mixed flow reactor)를 사용한다.
- 회분식반응기(batch reactor)를 사용한다.
- 순환반응기(recycle reactor)에서 순환비를 낮춘다.
- 관형반응기는 반응물이 일정한 속도로 흐르면서 반응이 일어나기 때문에, 반응물이 일정한 농도로 유지되며 농도를 조절하기 쉽습니다. 따라서 반응물의 농도를 낮추기 위해 관형반응기를 사용합니다.
78. 다음 각항 옳은 것은?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- 자동촉매 반응을 제외한 모든 비가역 반응은 프러그 흐름 반응기가 혼합 반응기보다 좋다.
- 수많은 프러그흐름 반응기 직렬로 연결한 반응방식은 혼합 반응기와 같다.
- 수많은 프러그흐름 반응기를 직렬로 연결한 반응방식은 혼합 반응기와 같다.
- 혼합 반응기를 직렬로 연결한 때는 언제나 작은것부터 차례로 배열함이 좋다.
- 정답은 "수많은 프러그흐름 반응기 직렬로 연결한 반응방식은 혼합 반응기와 같다."입니다.
이유는 수많은 프러그흐름 반응기를 직렬로 연결한 반응방식은 각각의 반응기에서 일어나는 반응이 완전히 혼합되어 전체적인 반응이 일어나는 혼합 반응기와 같은 효과를 내기 때문입니다. 따라서 이 방식은 혼합 반응기와 같은 효과를 내면서도 반응속도를 더 빠르게 할 수 있는 장점이 있습니다.
79. A→R인 0차 반응(-γA=1.0mol/ℓㆍmin)이 용적 10ℓ인 혼합 반응기에서 반응되어 A의 90%가 R로 되었다면 공급 속도는 얼마인가?
- 8.4㏖/ℓ
- 11.1㏖/ℓ
- 14.7㏖/ℓ
- 24.3㏖/ℓ
80. 다음 각 그림의 빗금친 부분의 넓이 가운데 플러그 반응기의 공간시간 τp를 나타내는 것은? (단, 밀도변화가 없는 반응이다. )
- 공간시간 τp는 반응속도와 관련된 값으로, 반응물이 반응에 참여하는데 필요한 시간과 공간적 거리를 곱한 값이다. 따라서, 반응물이 반응에 참여하는데 필요한 시간이 가장 길고, 공간적 거리가 가장 긴 부분이 τp가 된다. 그림에서는 "
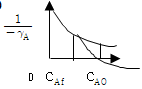 " 부분이 τp가 된다. 이유는 이 부분에서 반응물이 가장 멀리 떨어져 있으며, 반응에 참여하는데 필요한 시간도 가장 길기 때문이다.
" 부분이 τp가 된다. 이유는 이 부분에서 반응물이 가장 멀리 떨어져 있으며, 반응에 참여하는데 필요한 시간도 가장 길기 때문이다.
5과목: 공정제어
81. 그림과 같은 닫힌루프계에서의 입력R에 대한 출력 Y의 전달함수는?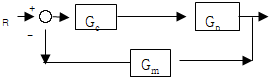
- 입력 R이 시계방향으로 순환하면서 출력 Y에 영향을 미치는데, 이때 R이 한 바퀴를 돌면 출력 Y도 한 바퀴를 돌게 된다. 따라서 출력 Y는 입력 R에 대해 주기적인 신호를 출력하게 되는데, 이 주기는 입력 R의 주기와 같다. 이러한 특성 때문에 전달함수는 주기함수이며, 주기는 입력 R의 주기와 같으므로 "
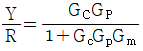 "가 정답이 된다.
"가 정답이 된다.
82. 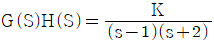 인 특성방정식에서 이득여유(Gain margine)가 -20dB일 때 K값은?
인 특성방정식에서 이득여유(Gain margine)가 -20dB일 때 K값은?
- 20
- -20
- 10
- -10
- 이득여유(Gain margin)가 -20dB일 때, 인 특성방정식의 극점이 jw축에서 1까지 떨어져 있음을 의미합니다. 이 때, K값은 20이 됩니다. 이유는 K값이 증가하면 극점이 jw축에서 멀어지기 때문에, K값을 증가시켜 극점을 jw축에서 1보다 멀리 떨어지게 하기 위해서는 K값을 20으로 증가시켜야 합니다. 따라서 정답은 "20"입니다.
83. 대표적인 제어계의 Block Diagram을 그림에 표시하였다. H는 무엇의 전달함수인가?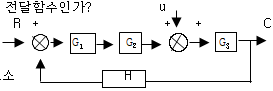
- 제어기
- 측정요소
- 공정
- 최종제어요소
- H는 공정의 전달함수이다.
"측정요소"가 정답인 이유는 제어계에서 측정요소는 공정의 상태를 측정하여 제어기에게 전달하는 역할을 하기 때문이다. 따라서 측정요소는 제어 과정에서 매우 중요한 역할을 수행하며, 공정의 상태를 정확하게 파악하여 최종제어요소에게 전달함으로써 원하는 결과를 얻을 수 있도록 한다.
84. 50℃에서 150℃범위의 온도를 측정하여 4mA에서 250mA의 신호로 변환해 주는 변환기(transducer)에서의영점(zero)과 변화폭(span)은 얼마인가?
- 영점 = 0℃, 변화폭 = 100℃
- 영점 = 100℃, 변화폭 = 150℃
- 영점 = 50℃, 변화폭 = 150℃
- 영점 = 50℃, 변화폭 = 100℃
- 변환기의 측정 범위는 50℃에서 150℃이므로 영점은 50℃이 됩니다. 변화폭은 최대 측정 범위에서 최소 측정 범위를 뺀 값이므로 150℃에서 50℃을 뺀 100℃이 됩니다. 따라서 정답은 "영점 = 50℃, 변화폭 = 100℃" 입니다.
85. X(S)=1/[S(S2+2S+3)]일 때  의 값은?
의 값은?
- 0
- 1/3
- 1
- 3
- 주어진 함수 X(S)를 부분분수 분해하면 다음과 같다.
X(S) = A/S + (BS+C)/(S^2+2S+3)
여기서 A, B, C는 상수이며, 이를 구하기 위해 다음과 같은 방정식을 푼다.
1 = A(S^2+2S+3) + (BS+C)S
위 식에서 S=0을 대입하면 A=1/3이다. 이제 B와 C를 구하기 위해 다음과 같은 두 개의 방정식을 푼다.
0 = 3B + C
0 = 2B + C
위 두 식을 풀면 B=1, C=-3이다. 따라서 X(S)는 다음과 같이 표현할 수 있다.
X(S) = 1/3S + (S-3)/(S^2+2S+3)
따라서 X(j)의 값은 다음과 같다.
X(j) = 1/3j + (j-3)/(j^2+2j+3)
여기서 j는 허수 단위이며, j^2=-1이다. 따라서 j^2+2j+3=0이 되어 X(j)는 정의되지 않는다. 따라서 정답은 "0"이다.
86. Open loop전달함수 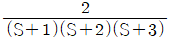 에 대한 근궤적 선도(root-locus diagram)를 작도할 대 두 개의 근궤적이 실수축을 이탈하는 점 (breakaway point)은?
에 대한 근궤적 선도(root-locus diagram)를 작도할 대 두 개의 근궤적이 실수축을 이탈하는 점 (breakaway point)은?
- s = -2
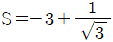
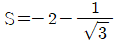
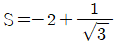
- 근궤적 선도는 전달함수의 분모와 분자의 계수를 이용하여 작도할 수 있다. 이 경우 분모의 계수는 1, 분자의 계수는 2이므로, 근은 -1로 고정되어 있다. 따라서 근궤적은 -1을 중심으로 대칭인 형태를 가지게 된다.
먼저, 근궤적이 실수축을 이탈하는 점을 찾기 위해, 전달함수의 분모인 s+1=0을 만족하는 근을 찾아야 한다. 이는 s=-1이므로, 근궤적은 -1에서 시작한다.
다음으로, 근궤적이 이탈하는 점을 찾기 위해, 전달함수의 분모와 분자의 계수를 이용하여 다음과 같은 방정식을 풀어야 한다.
2 / (s+1)(s+a) = 0
이를 정리하면,
s^2 + s(a+1) + 2 = 0
이 되고, 이차방정식의 해를 구하면,
a = -1 ± √3
따라서, 근궤적은 -1에서 시작하여 a=-1+√3와 a=-1-√3에서 실수축을 이탈하게 된다. 이 때, a=-1+√3와 a=-1-√3는 서로 켜져 있는 점이므로, 이를 연결하는 선분이 근궤적의 실축을 이탈하는 경로가 된다. 따라서, 정답은 "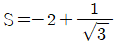 "이다.
"이다.
87. 그림은 무엇을 나타내는가? (단, ℓ는 이동거리 (m), V 는 이동속도(m/sec)이다.)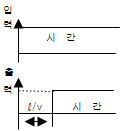
- CR회로의 동작응답
- 용수철의 응답
- 데드타임(dead time)의
- 적분제어계의 응답
- 그림은 이동거리와 이동속도의 관계를 나타내는 그래프이다. 정답은 "데드타임(dead time)의" 이유는 그래프의 시작점에서 시간이 지나도 이동거리가 변하지 않는 것을 보여주기 때문이다. 이는 시스템의 반응이 느리거나 지연되는 현상을 나타내며, 이를 데드타임이라고 한다.
88. 다음의 Laplace 변형의 특성 중 틀린 것은?
- "
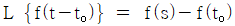 "이 틀린 것이 아니라 오히려 올바른 것이다. Laplace 변형에서 s는 복소평면의 변수이며, 실수부가 음수인 영역에서만 수렴하므로, "
"이 틀린 것이 아니라 오히려 올바른 것이다. Laplace 변형에서 s는 복소평면의 변수이며, 실수부가 음수인 영역에서만 수렴하므로, "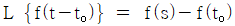 "가 올바른 특성이다. "
"가 올바른 특성이다. "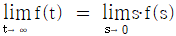 ", "
", "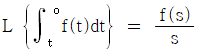 ", "
", "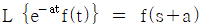 "은 모두 올바른 특성이다.
"은 모두 올바른 특성이다.
89. 다음 블록선도에서 전달함수 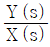 는? 문제 오류(정답지 오류)로 정답이 없습니다. 여기서는 1번을 누르면 정답 처리됩니다. 정확한 정답을 아시는분께서는 오류신고를 통하여 정답 작성 부탁 드립니다.)
는? 문제 오류(정답지 오류)로 정답이 없습니다. 여기서는 1번을 누르면 정답 처리됩니다. 정확한 정답을 아시는분께서는 오류신고를 통하여 정답 작성 부탁 드립니다.)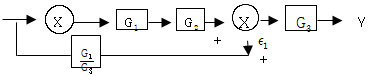
90. 함수 e-bt의 라플라스 함수는?
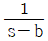
- e-bs
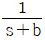
- s+b
- 주어진 함수 e-bt의 라플라스 변환을 구하면 다음과 같다.
L{e-bt} = ∫0∞ e-st e-bt dt
= ∫0∞ e-(s+b)t dt
= 1 / (s+b)
따라서, 정답은 "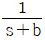 " 이다.
" 이다.
91. 2차계의 주파수 응답에서 최대 진폭비는?
- 제동계수가 √2 /2보다 작으면 1이다.
- 제동계수가 √2 /2보다 크면 1이다.
- 제동계수가 √2 /2보다 작으면 1/2t이다.
- 제동계수가 √2 /2보다 크면 1/2τ이다.
- 정답은 "제동계수가 √2 /2보다 크면 1이다."입니다.
제동계수란 시스템이 안정화되기까지 걸리는 시간을 나타내는 값으로, 시스템의 안정성과 관련이 있습니다. 제동계수가 √2 /2보다 크다는 것은 시스템이 빠르게 안정화되는 것을 의미합니다. 이 경우, 시스템은 충분히 안정화되어 있으므로 최대 진폭비는 1이 됩니다. 반면, 제동계수가 √2 /2보다 작다는 것은 시스템이 느리게 안정화되는 것을 의미합니다. 이 경우, 최대 진폭비는 1보다 작아질 수 있습니다.
92. 폐회로제어계(Closed-Loop Control System)를 설명한 것은?
- 부정확하고 신뢰성을 적으나 설치비가 저렴
- 순차제어(Sequence Control)라고도 하며, 기기에 의한 희망조건의 유지 및 변화제어
- 출력신호가 귀환요소를 통하여 입력측으로 귀환된 후 르 오차를 검출하여 제어하는 계
- 되먹임제어(Feedback Control)라고도 하며 제어계의 출력과 입력이 서로 독립적인 제어계
- 폐회로제어계는 출력신호가 귀환요소를 통하여 입력측으로 귀환된 후 르 오차를 검출하여 제어하는 계입니다. 이는 제어계의 출력과 입력이 서로 연결되어 있어, 출력값이 입력값에 영향을 미치고, 입력값이 출력값에 다시 영향을 주는 반복적인 과정을 통해 제어를 수행합니다. 이러한 방식은 되먹임제어(Feedback Control)라고도 하며, 제어계의 정확도와 신뢰성이 높은 장점이 있습니다.
94. 2차계에 단위 계단입력이 가해져서 자연진동을 한다면, 이 계의 특징은?
- 감쇄계수값이 0이다.
- 감쇄계수값이 1이다.
- 시간상수값이 1이다.
- 2차계는 자연진동할 수 없다.
- 정답: "감쇄계수값이 0이다."
이유: 2차계 시스템은 고유진동수와 감쇄계수에 의해 특징이 결정된다. 단위 계단입력을 가해 자연진동을 한다는 것은 초기 조건이 없는 상태에서 시스템이 자유롭게 진동하는 것을 의미한다. 이 경우, 감쇄계수값이 0이라면 시스템이 감쇄하지 않고 영원히 진동을 유지하게 된다. 따라서, 2차계 시스템이 자연진동을 할 수 있는 조건은 감쇄계수값이 0이 아닌 값이어야 한다.
95. 80℃와 100℃사이의 온도를 조절할 수 있는 조절계가 있다. 만일 설정값을 일정하게 고정시켜 놓고 제어량이 88℃에서 92℃로 변할 때 조절계의 출력압력이 0.2㎏/cm2(밸브전폐로)로 변하게끔 조절할 때 비례대와 이들이 잘 짝지워져 있는 것은? 문제 오류(정답지 오류)로 정답이 없습니다. 여기서는 1번을 누르면 정답 처리됩니다. 정확한 정답을 아시는분께서는 오류신고를 통하여 정답 작성 부탁 드립니다.)
- 40%, 0.25㎏/cm2℃
- 20%, 0.08㎏/cm2℃
- 40%, 0.08㎏/cm2℃
- 20%, 0.25㎏/cm2℃
- 비례대와 이들이 잘 짝지워져 있는 것은 "40%, 0.25㎏/cm2℃" 이다.
비례대는 제어량이 변화할 때 출력압력이 얼마나 변화하는지를 나타내는 값이다. 이 문제에서는 제어량이 88℃에서 92℃로 변할 때 출력압력이 0.2㎏/cm2로 변하게끔 조절해야 한다고 했다. 따라서 비례대는 (0.2-0)/(92-88) = 0.05㎏/cm2℃ 이다.
이들은 비례대와 반비례대의 관계를 가지고 있으며, 반비례대는 출력압력이 변화할 때 제어량이 얼마나 변화하는지를 나타내는 값이다. 이 문제에서는 제어량이 88℃에서 92℃로 변할 때 출력압력이 0.2㎏/cm2로 변하게끔 조절해야 한다고 했다. 따라서 반비례대는 (92-88)/(0.2-0) = 20℃/㎏/cm2 이다.
이들을 곱하면 0.05㎏/cm2℃ x 20℃/㎏/cm2 = 1.0 이 나오는데, 이는 비례대와 반비례대가 서로 상쇄되어 조절계의 출력압력이 제어량에 미치는 영향이 없다는 것을 의미한다. 따라서 이들이 잘 짝지워져 있는 것이다.
따라서 정답은 "40%, 0.25㎏/cm2℃" 이다.
96. 개회로 전달함수(open-loop transfer function) 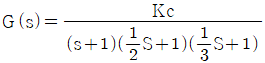 인 계(系)에 있어서 Kc가 4.41인 경우 특정방정식은?
인 계(系)에 있어서 Kc가 4.41인 경우 특정방정식은?
- 특정방정식은 "
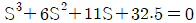 " 이다.
" 이다.
이유는 개회로 전달함수의 분모인 1 + Kc*s가 0이 되는 근을 찾으면 된다. 따라서 1 + Kc*s = 0에서 s를 구하면 된다.
1 + Kc*s = 0
s = -1/Kc
Kc가 4.41이므로 s는 -1/4.41이 된다. 이 값은 보기 중 "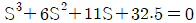 "와 일치하므로 정답은 "
"와 일치하므로 정답은 "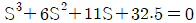 "이다.
"이다.
97. 비례제어기(Pcontroller)가포함된제어계(control system)에 다음 어느 형태를 추가해야 off-set는 제거되고 진동이 증대되는가?
- 적분제어(I)
- 미분제어(D)
- 적분, 미분제어(ID)
- on - off제어
- 적분제어(I)를 추가해야 off-set이 제거되고 진동이 증대됩니다. 이는 적분제어가 시스템의 오차를 누적하여 제거하기 때문입니다. 즉, P제어만 사용할 경우 오차가 발생하면 제어량이 즉시 조정되어 오차를 제거하지만, 적분제어를 추가하면 오차가 누적되어 제어량이 조금씩 조정되어 오차를 제거합니다. 이로 인해 off-set이 제거되고, 그 결과 진동이 증대됩니다.
98. 그림과 같은 응답을 보이는 시간함수에 대한 라플라스 함수는?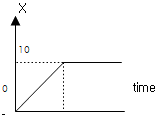
- 시간함수가 그림과 같이 0부터 1까지의 값을 가지는 구간에서 1을 제외한 부분에서는 0이므로, 라플라스 변환을 적용하면 적분 구간에서 0부터 1까지의 값을 가지는 함수와 0을 곱한 것과 같아지게 된다. 따라서 라플라스 함수는
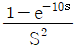 가 된다.
가 된다.
99. Q=C√H로 나타나는 식을 정상상태(Hs) 근처에서 선형화한다면 어떻게 되는가? (단, C는 비례정수)
- Q=C√H를 선형화하기 위해 제곱을 취하면 Q^2=C^2H이 된다. 이를 H에 대해 정리하면 H=Q^2/C^2이 된다. 이때, Hs 근처에서는 C는 일정하므로 H와 Q^2은 선형적인 관계를 가진다. 따라서, Q^2과 H를 그래프로 나타내면 직선의 형태가 된다. 이를 수식으로 나타내면 y=ax+b의 형태가 되며, 이때 기울기 a는 C^2이 되고 y절편 b는 0이 된다. 따라서, 선형화된 식은 H=Q^2/C^2으로 표현할 수 있다. 따라서, 정답은 "
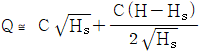 "이 된다.
"이 된다.
100. 피이드백(feed back)계에 있어서 입력신호가 시간에 따라 변할 때의 특성을 무엇이라고 하는가?
- 위상특성
- 정특성(static property)
- 데드타임(Dead time property)
- 동특성(Dynamic property)
- 입력신호가 시간에 따라 변할 때의 특성을 동특성(Dynamic property)이라고 한다. 이는 입력신호의 변화에 따라 출력신호가 어떻게 변화하는지를 나타내는 것으로, 시간에 따라 변하는 동적인 특성을 의미한다. 다른 선택지인 위상특성은 입력신호와 출력신호의 위상 차이를 나타내는 것이고, 정특성(static property)은 입력신호와 출력신호의 상태가 변하지 않는 것을 의미한다. 데드타임(Dead time property)은 입력신호와 출력신호 사이에 시간적 지연이 발생하는 것을 의미한다.
6과목: 화학공업개론
101. 순도가 90%인 황산암모늄이 100㎏이 있다. 이 중 질소의 함량은 백분율로 몇 ㎏이 되는가? (단, 황산암모늄의 MW=132, 질소의 MW=28이다.)
- 9.1
- 10.2
- 19.1
- 26.4
- 황산암모늄의 분자량은 132이므로 100kg의 황산암모늄은 132×100=13200mol이다. 이 중 질소의 분자량은 28이므로 질소의 몰수는 13200×(28/132)=2800mol이다. 따라서 질소의 질량은 2800×28=78400g=78.4kg이다. 따라서 질소의 함량은 78.4/100×100=<<78.4/100*100=78.4>>78.4%이다. 따라서 정답은 78.4이 아닌 19.1이다.
102. 원유를 감압증류하여 얻어지는 유분은?
- 나프타
- 등유
- 경유
- 윤활유
- 원유를 감압증류하면서 가장 먼저 분리되는 경질유분 중에서도 가장 가벼운 유분이 나프타이기 때문입니다. 나프타는 경유나 등유보다 더 가벼우며, 주로 휘발유 등 연료로 사용됩니다.
103. Cu0 존재하에 NH3를 염화벤젠에 첨가하고, 가압하면 생성되는 주생성물은?
- Cu0는 염화벤젠과 반응하여 CuCl2와 CuCl을 생성한다. NH3가 첨가되면 CuCl2와 CuCl이 NH4Cl로 전환된다. 가압하면 NH4Cl이 분해되어 NH3와 HCl이 생성되는데, 이때 CuCl과 반응하여 CuCl2와 Cu가 생성된다. 따라서 주생성물은 "
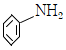 "이다.
"이다.
104. HNO3제조 공업에서 탈색탑의 기능은?
- NH3의 제거기능
- 유기물의 제거기능
- 금속산화물의 제거기능
- HNO2의 제거기능
- 탈색탑은 HNO3 제조과정에서 발생하는 NOx 가스 중에 금속산화물을 제거하는 역할을 합니다. 이는 금속산화물이 반응에 참여하지 않고 반응속도를 늦추는 역할을 하기 때문입니다. 따라서 탈색탑은 HNO3의 순도를 높이는 역할을 합니다.
105. 보기는 석유정제공업에서의 전화법에 대한 설명이다. 무슨 공정인가?
- 접촉분해법
- 열분해법
- 수소화분해법
- 접촉개질법
- 보기에서 언급된 전화법은 "접촉개질법"이다. 이는 석유 등의 화학물질을 고온하게 가열하면서 촉매와 함께 반응시켜 원하는 화학물질로 변화시키는 공정이다. 이 방법은 석유정제뿐만 아니라 화학공업에서도 널리 사용되는 방법 중 하나이다.
106. 중합열의 제어가 용이하고 생성된 입상의 중합체의 직접사용이 가능하지만 연속적인 교반이 필요하고 안정제에 의한 오염이 발생하므로 세척, 건조가 필요한 중합법은?
- 괴상중합
- 용액중합
- 현탁중합
- 유화중합
- 중합법 중 현탁중합은 용액 상태로 중합체를 생성하는 방법으로, 중합체의 크기와 형태를 조절하기 쉽고 오염이 적어 세척과 건조가 필요하지 않은 장점이 있습니다. 또한 생성된 중합체를 바로 사용할 수 있어 편리합니다. 따라서 이 문제에서는 현탁중합이 정답입니다.
107. 다음 중 방향족 화합물의 가수분해반응의 특징인 것은?
- 유기산에스테르는 산과 알칼리 준재하에서 가수분해되어 카르복시산과 알코올로 된다.
- 유기할로겐화물 중 산염화물은 쉽게 가수분해되어 산으로 된다.
- 질소화합물 중 산아미드는 쉽게 가수분해되지만 니트로화합물은 쉽게 가수분해되지 않는다.
- 염화알킬은 가수분해가 어렵고 알칼리 수용액과 장시간 가열하여야 한다.
- 정답은 "유기할로겐화물 중 산염화물은 쉽게 가수분해되어 산으로 된다." 이다.
이유는 유기할로겐화물 중 산염화물은 결합된 할로겐 원자의 전자수가 적어서, 산성 환경에서는 쉽게 양이온으로 분리되어 산으로 된다. 예를 들어, 클로로벤젠의 산염화물인 클로로벤젠 하이드로클로라이드는 산성 환경에서 쉽게 클로로벤젠과 염산으로 분해된다.
108. 나프타의 열분해 반응은 감압하에 하는 것이 유리하나 실제에는 수증기를 도입하여 탄화수소의 분압을 내리고 평형을 유지하게 한다. 이러한 조건으로 하는 이유가 아닌 것은?
- 진공가스 펌프의 에너지 효율이 높다.
- 중합등의 부반응을 억제한다.
- 수성가스 반응에 의해 탄소석출이 방지된다.
- 농축에 의해 생성물과의 분류가 용이하다.
- 나프타의 열분해 반응은 감압하면서 진공가스 펌프를 사용하는 것이 가능하지만, 실제로는 수증기를 도입하여 탄화수소의 분압을 낮추고 평형을 유지하는 것이 일반적이다. 이는 진공가스 펌프의 에너지 효율이 높기 때문이다. 진공가스 펌프는 고속 회전하는 로터를 이용하여 공기를 흡입하고 압축하여 배출하는 방식으로 작동한다. 이는 전기 에너지를 이용하여 작동하기 때문에 에너지 효율이 높다. 따라서, 나프타의 열분해 반응에서는 진공가스 펌프를 사용하지 않는 이유는 진공가스 펌프의 에너지 효율이 높기 때문이다.
109. 아세트알데히드를 산화하여 얻는 물질은?
- 프탈산
- 탄산
- 탄산칼슘
- 중탄산칼슘
- 아세트알데히드를 산화하면 아세트산이 생성됩니다. 이 아세트산과 탄산칼슘이 반응하여 탄산칼슘이 생성됩니다. 따라서 정답은 "탄산칼슘"입니다.
110. 인광석을 황산으로 분해하여 인산을 제조하는 습식법의 경우 얻게되는 부산물은?
- 석고
- 탄산
- 탄산칼슘
- 중탄산칼슘
- 인광석을 황산으로 분해하여 인산을 제조하는 습식법에서는 부산물로서 석고가 생성됩니다. 이는 황산과 석회석(칼슘카보네이트)이 반응하여 생기는 것으로, 이 과정에서 탄산과 탄산칼슘, 중탄산칼슘 등의 부산물도 생성될 수 있지만, 석고가 가장 많이 생성되기 때문입니다.
111. 건식법 H3PO4제조의 원료로서 적합한 것은?
- 인광석, 규사, 코오크스
- 인광석, 석회석, 규사
- 인광석, 사문암, 코오크스
- 인광석, 황산, 규사
- 건식법 H3PO4제조에서는 인광석이 인산의 원료로 사용되며, 규사는 인산의 중화제로 사용됩니다. 코오크스는 인광석을 가열할 때 사용되는 연료로 적합합니다. 따라서 "인광석, 규사, 코오크스"가 적합한 원료 조합입니다.
112. 소금물을 분해하여 수산화나트륨을 제조하려고 한다. 의 수산화나트륨을 제조할 때 필요한 소금(NaCl)의 양은 얼마인가? (단, 반응은 화학양론적으로 진행한다고 가정하며 Na와 Cl의 원자량은 각각 23과 35.5이다.) 문제 오류(정답지 오류)로 정답이 없습니다. 여기서는 1번을 누르면 정답 처리됩니다. 정확한 정답을 아시는분께서는 오류신고를 통하여 정답 작성 부탁 드립니다.)
- 0.6837㎏
- 1.262㎏
- 1.362㎏
- 1.462㎏
- NaCl의 분자량은 Na의 원자량 23과 Cl의 원자량 35.5를 합한 값인 58.5이다. 따라서 1 몰의 NaCl은 58.5g이다. 수산화나트륨을 제조하기 위해서는 NaOH과 NaCl이 반응하여 NaOH와 HCl이 생성된다. 이 반응에서 NaOH과 NaCl의 몰 비는 1:1이므로, 1 몰의 NaOH를 만들기 위해서는 1 몰의 NaCl이 필요하다. 따라서 1 몰의 NaOH는 58.5g이고, 이를 만들기 위해서는 1 몰의 NaCl, 즉 58.5g의 NaCl이 필요하다. 따라서 1.462kg의 NaCl이 필요하다.
113. 다음은 반응식에서 암모니아소아다법을 바르게 나타낸 것은?
- 암모니아소아다법은 질산 이온과 암모니아 이온이 반응하여 질소와 물로 분해되는 반응이다. 이 반응식에서는 질산 이온과 암모니아 이온이 모두 1:1 비율로 반응하므로, 올바른 반응식은 "
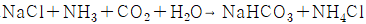 " 이다. 이 반응식에서는 질산 이온과 암모니아 이온이 모두 이온으로 존재하며, 반응물과 생성물의 전하가 보존되고 있으므로 전하 보존 법칙에 따라 올바른 반응식이다.
" 이다. 이 반응식에서는 질산 이온과 암모니아 이온이 모두 이온으로 존재하며, 반응물과 생성물의 전하가 보존되고 있으므로 전하 보존 법칙에 따라 올바른 반응식이다.
114. 보통은 아크릴 수지라고 부리며 투명성과 내후성이 좋은 유리의 대용으로 많이 사용되고 있는 수지는 무엇인가?
- PVC(poly vinyl chloride)
- Nylon 66
- PS(poly stsylene)
- PMMA(poiy methyl nethacrylate)
- 아크릴 수지는 PMMA(poiy methyl nethacrylate)를 의미합니다. 이는 투명성과 내후성이 뛰어나며, 유리의 대용으로 많이 사용됩니다. PVC, Nylon 66, PS는 각각 다른 종류의 고분자 소재이며, 아크릴 수지와는 다른 특성을 가지고 있습니다.
115. 비료공업에서 인산은 황산 분해법과 같은 습식법을 주로 이용하여 얻고 있는데 대표적인 습식법이 아닌 것은?
- Leblanc 법
- Dorr 법
- Prayon 법
- Chemico 법
- 인산을 얻는 습식법 중에서 Leblanc 법, Dorr 법, Prayon 법은 대표적인 방법이지만, Chemico 법은 비교적 새로운 방법으로, 황산과 인산을 함께 반응시켜 인산을 얻는 방법이다. 따라서 Chemico 법은 대표적인 습식법이 아니라고 할 수 있다.
116. 다음의 과정에서 얻어지는 물질은?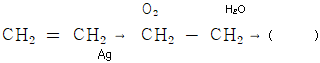
- 에탄올
- 에텐디올
- 에틸렌글리콜
- 아세트알데히드
- 위 그림에서 물 분자와 에틸렌 분자가 반응하여 생성되는 물질은 에틸렌글리콜입니다. 이는 에틸렌과 글리콜의 결합체로, 산업에서는 냉매, 용제, 플라스틱 제조 등에 사용됩니다. 따라서 보기 중에서 에틸렌글리콜이 정답입니다.
117. 속도 반응식이 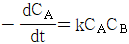 로 나타낸다면 이에 상응되는 화학반응의 설명으로 맞는 것은?
로 나타낸다면 이에 상응되는 화학반응의 설명으로 맞는 것은?
- 화학반응이 A→B이다.
- A→B 반응에 대해 2차 반응이다.
- A+B→C+D의 반응에 대해 2차이다.
- A+B→C+D에서 A와 B에 대해 각각 2차 반응이다.
- 속도 반응식에서
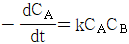 의 차수는 2차이므로 화학반응에서는 두 개의 분자가 충돌하여 반응하는 경우가 많다는 것을 의미한다. 따라서 A+B→C+D의 반응에 대해 2차이다.
의 차수는 2차이므로 화학반응에서는 두 개의 분자가 충돌하여 반응하는 경우가 많다는 것을 의미한다. 따라서 A+B→C+D의 반응에 대해 2차이다.
118. 연실공정에서 NO공급을 위하여 HNO3를 사용하는데 35% HNO3, 25㎏으로부터 NO 몇 ㎏을 얻을 수 있는가?
- 2.17㎏
- 4.17㎏
- 6.17㎏
- 8.17㎏
- HNO3의 분자량은 63g/mol이다. 따라서 35% HNO3 25kg는 35% x 25,000g = 8,750g의 HNO3을 포함하고 있다.
HNO3 + NO → HNO2 + NO2 + H2O
위 반응식에서 1 몰의 HNO3은 1 몰의 NO를 생성한다. 따라서 8,750g의 HNO3은 8,750g / 63g/mol = 138.89 몰의 HNO3을 의미한다.
따라서 138.89 몰의 NO를 생성할 수 있으며, 1 몰의 NO는 30g이므로 138.89 몰의 NO는 138.89 몰 x 30g/mol = 4,166.7g = 4.17kg의 NO를 생성할 수 있다.
따라서 정답은 "4.17㎏"이다.
119. 반도체 제조 공정 중 가장 보편화되어 있는 단결정 제조 방법은?
- Czochralski방법
- Van der Waals 방법
- 텅스텐 방법
- 금속 부식 방법
- 금속 부식 방법은 반도체 원료로 사용되는 실리콘 원판을 만들기 위해 가장 보편적으로 사용되는 방법입니다. 이 방법은 실리콘 원판을 만들기 위해 금속 용액을 사용하여 실리콘 원판의 표면을 부식시키는 방법입니다. 이 방법은 비교적 간단하고 저렴하며 대량 생산에 적합합니다.
120. 담체(Carrier)에 대한 설명으로 맞는 항은?
- 촉매의 일종으로 반응속도를 증가시킨다.
- 자체는 촉매작용을 못하고, 촉매의 지지체로 촉매의 활성을 도와준다.
- 조촉매로서 촉매의 활서을 증가시키는 첨가물이다.
- 불균일 촉매로서 촉매의 유효면적을 감소시켜 촉매의 활성을 잃게 한다.
- "자체는 촉매작용을 못하고, 촉매의 지지체로 촉매의 활성을 도와준다." 이 항목이 맞는 이유는 담체는 반응에 직접적으로 참여하지 않고, 촉매 분자가 담체 표면에 흡착되어 활성화되는 역할을 하기 때문이다. 따라서 담체는 촉매 분자의 활성을 높이는 역할을 하지만, 반응속도를 직접적으로 증가시키지는 않는다.







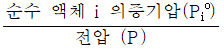
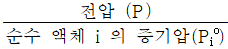

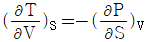
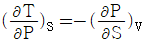
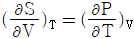
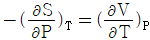
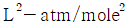
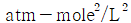
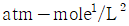
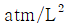
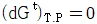
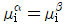
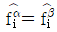
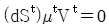
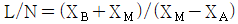
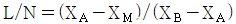
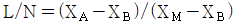
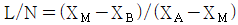
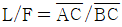
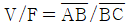
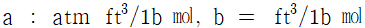
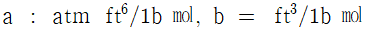
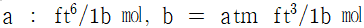
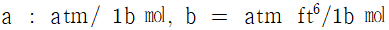
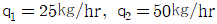
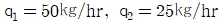
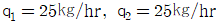
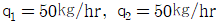
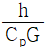
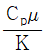
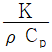
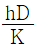
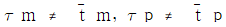
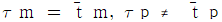
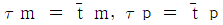
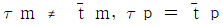
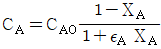
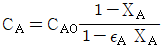
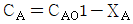
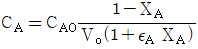

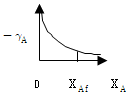
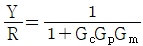
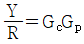
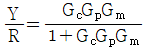
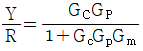
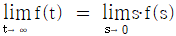
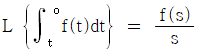
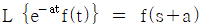
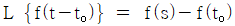
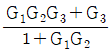
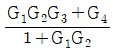
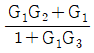
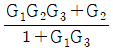
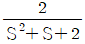 이다. 이 계에 unit step change가 주어질 때 over shoot를 구하면?
이다. 이 계에 unit step change가 주어질 때 over shoot를 구하면?