1과목: 화공열역학
1. 상평형에서 계의 성질이 최대가 되는 것은?
- 엔탈피
- 엔트로피
- 내부 에너지
- Gibbs 자유 에너지
2. 기체의 상태방정식으로 사용되지 않는 식은 다음중 어느 것인가?
- Redlich-Kwong equation
- Beattie-Bridgeman equation
- Benedict-Webb-Rubin equation
- Gibbs-Duhem equation
3. 등온과정에서 300K일때 압력이 10atm에서 1atm으로 변했다면 소요된 일은?
- 787.2㎈
- 967.8㎈
- 1136.2㎈
- 1372.6㎈
4. 단열된 상자가 2개의 같은 부피로 양분되었고, 한 쪽에는 Avogadro수의 이상 기체 분자가 들어 있고 다른 쪽에는 아무 분자도 들어 있지 않다고 한다. 칸막이가 터져서 기체가 양쪽에 차게 되었다면 이때 엔트로피 변화 값 Δ S는 다음중 어느 것인가?
- Δ S = RT ln 2
- Δ S = -R ln 2
- Δ S = R ln 2
- Δ S = -RT ln 2
5. 다음중 열역학 제 2법칙의 수학적인 표현으로 올바른 것은?
- Δ U + Δ KE + Δ PE = Q - W
- Δ Stotal ≥ 0
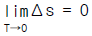
- dU = dQ - dW
6. 어떤 기체는 다음의 상태식에 따른다. P(V-b) = RT, 여기 b는 0 < b < V인 정수이다. 이 기체 1mol을 처음부피 Vi로부터 Vf로 등온팽창 시켰다면 이 때 이루어진 일(work)은 얼마인가?
7. 다음 중 옳은 Maxwell관계식은?
8. 단순한 유체(simple fluid)에 대하여 Pitzer의 편심계수(acentric factor)는 다음의 어떤 사항을 이용한 것인가? (단, Ps는 증기압을 나타낸다.)
- T/TC = 0.5일때 Ps/PC = 0.5이다.
- T/TC = 0.7일때 Ps/PC = 0.5이다.
- T/TC = 0.7일때 Ps/PC = 0.1이다.
- T/TC = 0.5일때 Ps/PC = 0.1이다.
9. Carnot 사이클의 열효율을 높이는데 유효한 방법은?
- 방열온도를 낮게한다.
- 급열온도를 낮게 한다.
- 동작물질의 양을 증가시킨다.
- 밀도가 큰 동작 물질을 사용한다.
10. 다음과 같은 증기-압축 냉동기의 사이클에서 성능 계수(coefficient of performance)는?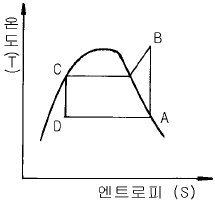
11. 단열 과정으로 조작되는 1몰의 이상기체가 있다. 이 때 계에 대하여 한 일을 여러 방법으로 계산할 수 있다. 다음 중 맞지 않는 것은? (단, γ =Cv/Cp)
- W = -Cv △T
- W = (P1V1-P2V2)/(γ -1)
- W = P1V1[1-(P2/P1)(γ-1)γ]
- W = [RT1/(γ -1)][1-(P2/P1)(γ-1)γ]
12. 380℃ 고온의 열저장고와 120℃의 저온 열저장고사이에서 작동하는 열기관이 60.0[kW]의 동력을 생산한다면 고온의 열저장고로부터 열기관으로 유입되는 열량(QH)은?
- 23.9 [kW]
- 87.7 [kW]
- 90.7 [kW]
- 150.7 [kW]
13. 이상기체를 등온 하에서 압력을 증가시키면 엔탈피는?
- 증가한다.
- 감소한다.
- 일정하다.
- 압력과 비례한다.
14. 1kg-mol의 이상기체를 P1=15atm, V1=4.72L에서 정용변화과정을 통하여 P2=1atm까지 가역변화를 시켰다. 이 때 엔탈 피변화(델타 H)값은 얼마인가? (단, Cp=5kcal/kg.mol.K, Cv=3kcal/kg.moloK이다.)
- -3027kcal
- -4027kcal
- -5027kcal
- -6027kcal
15. 순수한 성분이 액체에서 기체로 상의 전이에 대한 설명중 옳지 않은 것은?
- 1몰당 Gibbs 자유에너지 G는 불연속이다.
- 1몰당 엔트로피 S는 불연속이다.
- 1몰당 부피 V는 불연속이다.
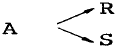
- 1몰당 Gibbs 자유에너지 G의 온도에 대한 변화율은 불연속이다.
16. 스팀과 석탄을 고온에서 반응시켜 수소,CO,CO2,CH4를 생산 한다. 다음 반응이 제안되어 있다면 그 자유도는 얼마인가?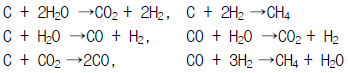
- 1
- 2
- 3
- 4
17. 폐쇄계에 관한 설명 중 틀 린 것은?
- 외부와 열전달을 할 수 있다.
- 외부와 물질전달을 할 수 있다.
- 내부에서 화학반응이 일어날 수 있다.
- 여러상(phase)이 존재할 수 있다.
18. Joule-Thomson 계수 μ T = 0일 때 기체의 온도를 역전온도(inversion temperature)라고 한다. 다음 설명 중 옳은 것은?
- 모든 기체는 역전온도 이상에서 주울 톰슨 팽창시켜도 액화될 수 있다.
- 모든 기체는 역전온도에 관계없이 액화될 수 있다.
- 모든 기체는 역전온도 이하에서만 액화된다.
- 모든 기체는 역전온도 이상에서만 액화된다.
19. 다음 중 잠열에 해당되지 않 는 것은?
- 반응열
- 증발열
- 융해열
- 승화열
20. 어떤 물질이 다음과 같은 부피팽창율과 등온압축율을 가지고 있을 때 이 물질의 상태식은 다음 중 어느 것으로 표현될 수 있는가?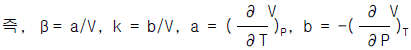
- V = aT + bP + const
- V = bT + aP + const
- V = aT - bP + const
- V = bT - aP + const
2과목: 화학공업양론
21. Heptane(C7H16)을 태워 Dryice(CO2)를 제조한다. CO2가스에서 Dryice로의 전환율은 50%이고, 시간당 Dryice제조량이 500㎏일때 필요한 Heptane의 양은?
- 325㎏/hr
- 227㎏/hr
- 162㎏/hr
- 143㎏/hr
22. 10wt% A 수용액 50kg과 20wt% B 수용액 50kg을 혼합하였다. 혼합용액의 조성은 어떻게 되겠는가?
- 10wt%
- 15wt%
- 20wt%
- 30wt%
23. 지하 220m깊이에서 부터 지하수를 양수하여 20m 옥상에 가설된 물탱크에 매초당 15㎏/s의 양으로 물을 올리고 있다. 이 때의 potential energy의 증가분(Δ Ep)은 얼마인가?
- 35300J/s
- 3600J/s
- 3000J/s
- 200J/s
24. 다음 중 경로함수끼리 짝지어진 것은?
- 내부에너지 - 일
- 위치에너지 - 엔탈피
- 엔탈피 - 내부에너지
- 일 - 엔탈피
25. 습윤공기가 1atm, 20℃에 있다. 이 때 증기의 분압이 1.75㎜Hg일 때 상대습도는? (단,20℃에서 증기압은 17.5㎜Hg이다.)
- 4.33%
- 10%
- 43.3%
- 100%
26. H2의 임계온도는 33K이고, 임계압력은 12.8atm이다. newton's 보정식을 이용하여 보정한 Tc와 Pc는?
- Tc = 47K, Pc = 26.8atm
- Tc = 45K, Pc = 24.8atm
- Tc = 41K, Pc = 20.8atm
- Tc = 38K, Pc = 17.8atm
27. 40℃에서 벤젠과 톨루엔의 혼합물이 기액평형에 있다. Raoult의 법칙이 적용된다고 볼 때 다음 설명 중 틀린 것은 어느것인가? (단, ① 40℃에서의 증기압 벤젠:180㎜Hg, 톨루엔:60㎜Hg ② 액상조성:벤젠 30%, 톨루엔:70%(몰기준))
- 이 계의 자유도는 2이다.
- 기상의 평형분압은 벤젠 54㎜Hg, 톨루엔 42㎜Hg이다.
- 이 계의 평형 전압은 240㎜Hg이다.
- 기상의 평형조성은 벤젠 56.3%, 톨루엔 43.7%이다.
28. 기화잠열을 추산하는 식의 설명중 틀린 것은?
- 포화압력의 대수값과 온도역수의 도시로부터 잠열을 추산하는 식이 Clausius-Clapeyron 식이다
- 정상비등온도와 임계온도ㆍ압력을 이용하여 잠열을 구하는 식이 Watson식이다
- 각 환산온도와 기화열로부터 잠열을 구하는 식이 Watson식이다
- 정상비등온도와 임계온도ㆍ압력을 이용하여 잠열을 구하는 식이 Riedel식이다
29. 100℃ 에서 내부 에너지 100kcal/kg을 가진 공기 2kg이 밀폐된 용기속에 있다. 이 공기를 가열하여 내부 에너지가 130kcal/kg이 되었을 때 공기에 전달되는 열량은?
- 55kcal
- 60kcal
- 75kcal
- 80kcal
30. K2Cr2O7(MW:294) 13wt%의 수용액 100㎏으로부터 64㎏의 물을 증발시킨 다음 20℃까지 냉각 시켰다. K2Cr2O7의 수율은 얼마인가? (단,20℃에서 K2Cr2O7의 용해도는 0.04㎏-mole/100㎏H2O이다.)
- 68.2%
- 71.2%
- 79.2%
- 83.2%
31. 그림은 A,B,C 3성분계의 평형곡선이다. 이 그림에 대한 설명 중 틀린 것은?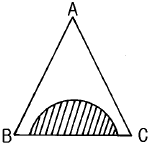
- A와 B는 완전 혼합한다.
- 사선 부분에서만 A,B,C성분이 완전히 혼합한다.
- A와 C는 완전 혼합한다.
- B와 C는 부분(성분) 혼합한다.
32. C2H5OH(ℓ) + 3O2(g) → 3H2O(ℓ) + 2CO2(g) 위 반응의 25℃에서 정용 반응열 Δ Hv = -326.1㎉일때 같은 온도에서 정압반응열 Δ Hp는 얼마인가?
- -324.7㎉
- +325.5㎉
- -326.7㎉
- +326.7㎉
33. CO2는 고온에서 2CO2 → 2CO + O2로 분해한다. 표준상태에서 11.2L의 CO2가 일정압력에서 3000K로 가열했다면 전체 혼합기체의 부피는 얼마인가?
- 160L
- 160m3
- 150L
- 150m3
34. 질소와 수소의 혼합물이 1000기압을 유지하고 있다. 이중 질소의 분압이 450 기압이라면 이 혼합물의 평균 분자량은 얼마인가? (단, 수소의 분자량은 2, 질소의 분자량은 28이다.)
- 16.7 g/gmol
- 15.7 g/gmol
- 14.7 g/gmol
- 13.7 g/gmol
35. 평균 열용량 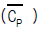 의 설명중 틀린 것은?
의 설명중 틀린 것은?
- 정압 열용량의 온도 의존성을 고려한 열용량이다.
- 온도구간이 클때 대수평균치로 정의되는 열용량이다.
- 온도구간이 클때 분자들의 병진운동을 고려한 열용량이다.
- 온도구간이 작을때는 정압열용량과 평균정압열용량이 거의 같다.
36. 다음 그림은 증류장치를 도식한 것이다. 여기서 Qc는 condenser에서 제거된 열량, Qr는 Reboiler에서 가열한 열량, F는 공급량, D는 탑상부 제품, B는 탑하부 유출량, Cp는 각 streem의 평균비열을 의미한다. 이 계의 Over all energy balance 계산을 올바르게 표시한 것은?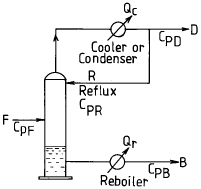
- Qr - Qc = D∫ CPDdT + B∫ CPBdT - F∫ CPFdT
- Qr - Qc = D∫ CPDdT + B∫ CPBdT + F∫ CPFdT
- Qr - Qc = F∫ CPFdT + D∫ CPDdT - B∫ CPBdT
- Qr - Qc = F∫ CPFdT - D∫ CPDdT + F∫ CPRdT
37. 도관내 흐름을 해석할 때 사용되는 베루누이식의 설명 중 틀린 것은?
- 마찰손실이 압력손실 또는 속도두 손실로 나타나는 흐름을 해석할 수 있는 식이다.
- 수평흐름이면 압력손실이 속도두 증가로 나타나는 흐름을 해석할 수 있는 식이다.
- 압력두, 속도두, 위치두의 상관관계 변화를 예측할 수 있는 식이다.
- 도관의 길이방향의 속도변화를 예측할 수 있는 식이다.
38. 순수한 에탄올과 물을 같은 무게로 혼합하여 용액을 만들었다. 이 용액에서 에탄올의 몰분율은 약 얼마인가? (단, 각각 원자량은 C:12, O:16, H:1 이다.)
- 0.5
- 0.6
- 0.4
- 0.3
39. 헨리의 법칙에 대한 설명중 틀린 것은?
- 휘발성이 없는 진한 용액의 기-액 평형을 다루는데 사용된다.
- 헨리상수(HA)는 대체적으로 용액특성에 따른 온도에 의존한다.
- 피리딘(C5H5N)과 물의 용액에서 피리딘에 대해서는 헨리법칙이 적용될수 있다.
- 기-액 평형시 기상의 한 성분의 압력(PA)은 액상에서 한 성분의 몰분율(XA)와 헨리상수(HA)의 적으로 나타낸다.
40. CO2 70V%와 NH3 30V%의 조성의 기체 혼합물을 KOH로 CO2를 제거하여 35V% CO2를 얻었다.이 때 CO2 몇%가 제거되었는 가? (단, KOH는 증발하지 않고 NH3의 양도 변하지 않는다고 가정한다.)
- 77%
- 66%
- 55%
- 44%
3과목: 단위조작
41. 열교환기에 대한 설명으로 옳지 않은 것은?
- 가장 간단한 열교환기는 이중관 열교환기이다.
- 관 밖으로 흐르는 유체의 속도를 증가시키기 위하여 baffle 을 설치한다.
- 열 팽창에 의한 균열을 막기위하여 floating - head(부동헤드) 를 설치한다.
- 열 교환기의 흐름은 대개 평행류이다.
42. 수평으로 놓인 가열된 관에 공기가 일정한 속도로 통과하고 있다. 공기는 4.4℃, 15.24 ㎧ 의 속도로 들어가서 60℃, 22.86 ㎧ 의 상태로 관을 나간다. 공기의 비열을 0.24kcal/kgㆍ℃ 라고 할때 공기에 전달된 열은?
- 24.1 ㎉/㎏ air
- 6.69 ㎉/㎏ air
- 13.35 ㎉/㎏ air
- 48.03 ㎉/㎏ air
43. 기-액 계면에서 물질전달이 일어날 경우 각 경막의 저항에 대한 설명으로 옳은 것은?
- 용해도가 큰 기체의 총괄저항은 액체경막 지배가 된다.
- 용해도가 적은 기체의 총괄저항은 기체경막 지배가 된다.
- 용해도가 적은 기체의 총괄저항은 액체경막 지배가 된다.
- 총괄저항은 용해도와 무관하다.
44. 복사(radiation)에 대한 설명 중 Kirchhoff 법칙을 표현한 것은?
- 어떠한 물체가 그 외계와 온도평형에 있을 때 방사율(emissivity)과 흡수율 (absorptivity)은 같다.
- 흑체의 총복사력 (radiating power)은 절대온도의 4 제곱에 비례한다.
- 어떤 주어진 온도에서 흑체의 최대 단색광 복사력(maximum monochromatic radiating power)을 갖는 파장은 절대온도에 역 비례한다.
- 흑체의 파장에 따른 에너지 분포를 나타낸다.
45. γ 가 활동도 계수를 나타낼 때, 최고 공비 혼합물이 가지는 값의 범위는?
- γA = 1, γB = 1
- γA < 1, γB > 1
- γA < 1, γB < 1
- γA > 1, γB > 1
46. 1atm 상에서 벤젠의 몰분율이 0.6 되는 톨루엔과의 혼합용액 중 벤젠의 톨루엔에 대한 비휘발도는? (단, 이 혼합용액과 평형상태에 있는 증기의 벤젠 몰분율은 0.8 임)
- 1.3
- 1.5
- 2.0
- 2.7
47. 층류에 대한 설명으로 옳지 않은 것은?
- 속도분포가 포물선을 그린다.
- 층류일 때는 패닝 (Fanning)식 만으로서 Poiseulle 식을 유도할 수 있다.
- 유체가 균일한 소용돌이 층을 이루며 흐른다.
- 일명 선류(線流)라고 한다.
48. 상접점(plait point) 의 설명으로 옳지 않은 것은?
- 균일상에서 불균일상으로 되는 경계점
- 액액 평형선 즉, tie - line 의 길이가 0 인 점
- 액액 평형선 즉, tie - line 의 길이가 가장 긴 점
- 추출상과 추출 잔류상의 조성이 같아지는 점
49. 다음 설명 중 옳지 않은 것은?
- 유체의 유동에 대한 저항을 점도라 한다.
- 흐르는 액체 중의 한면에 있어서의 전단 응력은 속도구배에 비례한다.
- 절대 점도를 유체의 밀도로 나눈값을 운동 점도라 한다.
- 비중과 점도와의 관계를 비점도라 한다.
50. 추출 장치에 대한 설명으로 옳지 않은 것은?
- mixer - settler → Batch 형으로써 교반장치를 하여 중력차로 분리한다.
- spray - tower → Heavy liquid 는 상부로, light liquid 는 하부로 유입된다.
- perforated - plate tower → 증류탑 에서와 같은 다공판을 갖는다.
- pulse - column → 충전물이나 다공판이 필요 없고 교반을 요하지 않는다.
51. 원 관내를 유체가 난류로 흐를때 점성 전단(Viscous shear) 은 거의 무시되고 난류 점성(Eddy viscosity)이 지배적인 부분은?
- Viscous sublayer
- Buffer layer
- Turbulent core
- Logarithmic layer
52. 비중이 0.9 인 액체가 나타내는 압력이 25psi 일 때 수두(head)로 나타내면?
- 12.19m
- 19.52m
- 1.219m
- 1.954m
53. 가스를 액체 속에 흡수 시키는 방법 중 옳은 것은?
- 가스의 액체에 대한 용해도가 클 때는 b) 법을 사용한다.
- 가스의 액체에 대한 용해도가 작을 때는 b)법을 사용한다.
- 가스의 액체에 대한 용해도가 크고 작은 것에 상관없이 어느 방법이든 같다.
- 가스의 액체에 대한 용해도가 클 때는 a) 법을 사용한다.
54. 건조 속도곡선에서 두 단계의 감율 건조단계 (그림 참조)를 나타내는 대표적인 물질은?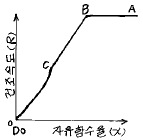
- 모래층(sand bed)
- 비공성 점토스라브(non porous clay slab)
- 다공성 도자기판(porous ceramic plate)
- 비공성 플라스틱막(non porous plastic flim)
55. NNu (Nusselt number)의 정의로서 옳은 것은? (단, Nst = stanton수, Npr = Prandtl수)
- KD/h
- 전도(conduction)저항/대류(convection)저항
- 전체의 온도구배/표면에서의 온도구배
- Nst/NReㆍNpr
56. 추출에 대한 설명으로 옳지 않은 것은?
- 추출은 증류로 분리할 수 있는 물질만 분리할 수 있다.
- 두 용액 중 용해도 차가 현저하게 큰 것을 분리할 수 있다.
- 끓는점이 비슷한 경우 증류보다 추출법을 이용한다.
- 고-액 추출은 침출(leaching), 액 - 액 추출은 액체추출(extraction)이라 한다.
57. 증류탑으로 들어가는 feed 는 찬 액체로 들어가기 때문에 feed 1 mole 당 흡입단(feed pate)으로 오는 vapor 중 0.4mole 을 액화시킨다. feed 는 80mole% methanol 과 20mole% 물이다. 공급선(feed line)을 구하면?
- y = 3.5x - 2
- y = - 1.5x + 2
- y = 1.5x + 0.5
- y = - 3.5x + 2
58. 증발기 조작에서 변수의 영향에 대한 설명으로 옳지 않은 것은?
- 증발기 내의 압력을 낮추어 비등점을 높이면 수증기의 이용율을 높일 수 있다.
- 압력을 낮추어서 진공상태에서 조작하면 가열 표면적을 상당히 줄일 수 있다.
- 증발기 조작에서 공급온도는 대단히 중요하며, 공급물을 예열하면 증발기의 열전달 면적을 줄일 수 있다
- 고압의 수증기를 사용하면 증발기의 크기와 가격을 줄일 수 있지만, 고압의 수증기는 비싸기 때문에 최적 수증기압을 결정하기 위한 총괄경제수지가 필요하다.
59. 오리피스관 전후에 마노미터를 설치하여 관속을 흐르는 유체의 압력차로부터 유량을 측정하고자 할 때, 그림에서 압력차 P1 - P2 는?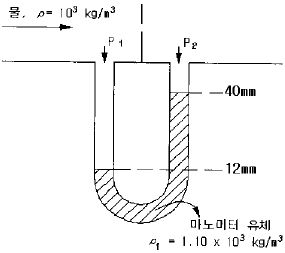
- 3.98×10-4 psia
- 2.23×10-3 psia
- 3.98×10-3 psia
- 2.23×10-2 psia
60. 내부에 가열코일이 들어 있고 외부가 가열자켈로 되어 있는 반응기 내에 비열이 0.67 ㎉/hrㆍ℃ 인 반응물 900㎏을 넣고 온도가 150℃ 인 수증기로 100℃ 까지 단열상태에서 가열하고자 한다. 반응물의 초기온도가 15℃ 일 때 100℃ 까지 가열하는데 필요한 시간은? (단, 총괄 전열계수는 730㎉/hrㆍm2ㆍ℃ 이고 전열면적은 1.5m2 이다.)
- 7분
- 14분
- 18분
- 33분
4과목: 반응공학
61. 다음 그림은 농도 - 시간의 곡선이다. 옳은 반응식은?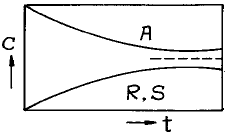
62. 액상 연속 반응 A → R → S 에서 R 이 목표 생성물이다. 이 반응을 플러그 흐름 반응기에서 진행시키고자 할 때 반응기의 크기에 관한 설명으로 가장 옳은 것은?
- 작은 것일수록 좋다.
- 큰 것일수록 좋다.
- 반응 속도식에 따라 큰 것일수록 또는 작은 것일수록 좋을 수 있다.
- 항상 최적의 크기가 있다.
63. 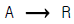 인 액상반응에 대한 평형상수가 K298 = 300 이고 반응열 Δ Hr298 = -18,000㎈/㏖ 이다. 75℃ 에서 평형 전환율은?
인 액상반응에 대한 평형상수가 K298 = 300 이고 반응열 Δ Hr298 = -18,000㎈/㏖ 이다. 75℃ 에서 평형 전환율은?
- 69%
- 55%
- 79%
- 93%
64. A → R, k1 = 100 R → S, k2 = 1 인 반응은 A → S, k 로 볼 수 있다. 이 때 k값은?
- 0.99
- 1
- 100
- 101
65. Langmuir 모델의 가정으로 옳지 않은 것은?
- 흡착이 일어나는 고체 표면층은 균일하다.
- 흡착물은 이웃 흡착물과 상호작용을 전혀하지 않는다
- 흡착열은 동일하다.
- 흡착층은 단분자 층과 다분자 층 공히 적용된다.
66. 1 차 반응일 때 플러그 흐름 반응기의 공간시간(Space time)은? (단, 밀도는 일정하다.)
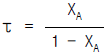
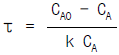
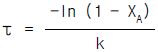
- τ = ln (1 - XA)
67. 초기농도가 1mole/ℓ인 액체 A가 1ℓ/ min 의 속도로 2liter 부피의 혼합반응기에 공급되어 출구농도가 0.1mole/ℓ 이었다면 A 의 소멸속도(mole/ℓㆍmin)는?
- 0.45
- 0.50
- 0.75
- 0.90
68. 어떤 반응에서 무촉매 상태와 촉매 상태와의 반응속도를 비교 하였더니 각 속도 상수의 정수비는 1 : 1000 이었다 20℃ 에서 두 상태의 활성화 에너지 차는?
- 3105㎈
- 3725㎈
- 4022㎈
- 4303㎈
69. NO2 의 분해반응 속도상수는 1차 반응으로서 694℃ 에서 0.138ℓ /molㆍsec 이고 812℃ 에서는 0.370ℓ / molㆍsec이다 이 반응에서 550℃ 일 때 속도상수는?
- 0.0482ℓ /molㆍsec
- 0.0382ℓ /molㆍsec
- 0.0282ℓ /molㆍsec
- 0.0182ℓ /molㆍsec
70. 이상형 반응기의 대표적인 예가 아닌 것은?
- 회분식 반응기
- 플러그흐름 반응기
- 혼합흐름 반응기
- 촉매 반응기
71. 직렬반응에서 원하는 제품의 수율을 최대로 하는 조건으로 옳지 않은 것은?
- 반응기 내에서의 여러 반응물의 조성을 균일하게 유지한다.
- 촉매를 사용하여 원하는 반응의 반응속도를 빠르게 한다.
- 원하는 반응과 부반응이 같은 차수이면 온도를 높게 혹은 낮게 유지한다.
- 반응물의 농도를 높게 혹은 낮게 유지한다.
72. 다음과 같은 평행반응이 진행되고 있을 때, 원하는 생성물이 S 라면 반응물의 농도는 어떻게 조절해 주어야 하는 가?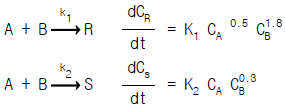
- CA 를 높게, CB 를 낮게
- CA 를 낮게, CB 를 높게
- CA 를 높게, CB 를 높게
- CA 를 낮게, CB 를 낮게
73. 그림은 자동 촉매반응(autocatalytic reaction) 에 대한 것이다. 옳지 않은 것은?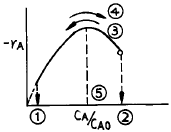
- 반응 초기의 CA/CAO 값은 ②로서 1 의 값을 갖는다.
- 반응의 진행방향은 ③ 이다.
- 반응의 진행방향은 ④ 이다.
- 최대반응 속도일 때의 CA/CAO 값은 ⑤일 때이다.
74. 순환이 없는 자기촉매 반응에서 최종 전화율이 최대 속도점보다 낮을 때 사용하기에 유리한 반응기는?
- 혼합 반응기
- 플러그 반응기
- 혼합 반응기와 플러그 반응기 직렬 연결
- 혼합 반응기와 플러그 반응기 병렬 연결
75. 반응이 다음과 같은 기초반응일 때 속도식으로 옳은 것은?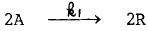
- -rA=rR=k1CA2
- -rA=-rR=k1CA2
- -rA=rR=k1CA
- -rA=-rR=k1CA
76. 순간 수득율 ø = 1/(1+CA) 인 반응을 직렬로 연결된 두개의 혼합반응기에서 진행시킬 때 총괄수득율은? (단, CAO = 1, CA1 = 1/2, CA2 = 0 mole/ℓ 이다.)
- 1/2
- 2/3
- 5/6
- 1
77. A → R → S 로 표시되는 직렬 반응에서 R 의 생성반응이 A 에 관하여 2차이고 S 의 생성반응이 R 에 관하여 1차이면 R 의 생성에 유리한 반응조건은?
- A 의 초기농도를 높이고 관형반응기를 사용한다
- A 의 초기농도를 낮추고 혼합반응기를 사용한다
- A 의 초기농도를 높이고 혼합반응기를 사용한다
- A 의 초기농도를 낮추고 관형반응기를 사용한다
78. 혼합흐름 반응기에서 다음과 같은 액상 1차 반응이 진행되고 있으며 60 % 의 A가 반응된다. 반응기의 크기만을 4 배로 증가 시키면 A 의 몇 % 가 반응 되겠는가?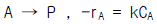
- 60 %
- 73 %
- 86 %
- 92 %
79. A → R 인 비가역 1차 반응에서 다른 조건이 모두 같을 때 CAo 를 증가시키면 전화율은?
- 증가한다
- 감소한다
- 일정하다
- 알수없다
80. 촉매의 세공부피 측정을 위하여 촉매(고체) 시료 90g 을 일정한 밀폐된 용기에 넣고 낮은 압력에서 수은을 주입하여 부피를 측정한 결과 40㎝3 이었으며, 다시 수은 제거 후 He 을 주입한 결과 80㎝3 이었다. 이때 촉매의 진밀도(true density)는?
- 1.25g/㎝3
- 2.25g/㎝3
- 3.25g/㎝3
- 4.25g/㎝3
5과목: 공정제어
81. 전달함수 G(s)의 단위계단(unit step)입력에 대한 응답을 ys,단위순간(impulse)입력에 대한 응답을 yI라한다면 ys와 yI의 관계는?
82. 다음 블록선도에서 전달함수 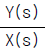 는?
는?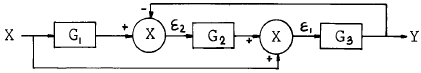
83. 다음은 함수 f(t)의 그림이다. 이 그림은 다음식 중의 어느것에 해당하는가?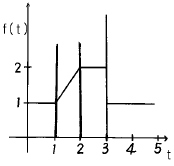
84. 다음 각항의 설명 중 Routh법에 의한 제어계의 안정성 판별조건과 관계 없는 것은?
- Routh array의 첫번째 열에 전부 양(+)의 숫자만 있어야 안정하다.
- 특성방정식이 S에 대해 n차 다항식으로 나타나야 한다.
- 제어계에 수송지연이 존재하면 Routh법은 쓸수없다.
- 특성방정식의 어느 근이든 복소수축의 오른쪽에 위치할때는 계가 안정하다.
85. 다음의 비선형공정을 정상상태의 데이타yss,uss에 대해 선형화 한 것은?
86. 입력과 출력사이의 전달함수의 정의로서 가장 타당한 것은?
87. 그림과 같은 응답 곡선은 2차계 시스템에서 ζ 가 어떤 값을 가질 때 나타나는가?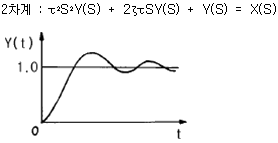
- ζ > 1
- ζ = 1
- ζ < 1
- ζ ≥ 0
88. 공정의 동적거동 형태 중 역응답(inverse response)이란?
- 양의 단위 입력에 대해 정상상태에서 음의 출력을 보이는 것.
- 입력에 대해 일정시간이 경과한 후 응답이 나올 때
- 입력에 대해 진동응답을 보일 때
- 초기응답이 정상상태 이득부호와 반대로 나올 때
89. 비례제어기의 비례제어 상수를 선형계가 안정되도록 결정하기 위해 비례제어 상수를 0으로 놓고 특성방정식을 푼 결과 서로 다른 세 개의 음수의 실근이 구해졌다. 비례제어 상수를 점점 크게 할 때 나타나는 현상 중 올바른 것은?
- 특성방정식은 비례제어 상수와 관계없으므로 세 개의 실근값은 변화가 없으며 계는 계속 안정하다.
- 비례제어 상수가 커짐에 따라 세 개의 실근값 중 하나는 양수의 실근으로 가게 되므로 계가 불안정해진다.
- 비례제어 상수가 커짐에 따라 세 개의 실근값 중 두개는 음수의 실수값을 갖는 켤레 복소수 근으로 갖게되므로 계의 안정성은 유지된다.
- 비례제어 상수가 커짐에 따라 세 개의 실근값 중 두개는 양수의 실수값을 갖는 켤레 복소수 근으로 갖게되므로 계가 불안정해진다.
90. 공정제어에 사용되는 제어기의 기본형 4종류중 그 전달함수가 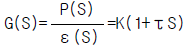 의 꼴로 표시되는 제어기는 어느 것인가?
의 꼴로 표시되는 제어기는 어느 것인가?
- P형
- PI형
- PD형
- PID형
91. 시간상수 τ 가 3sec이고 게인 Kp가 1인 온도계가 초기에 20℃를 유지하고 있다. 이 온도계를 100℃의 물속에 넣었을때 3sec후의 온도계 읽음은?
- 68.4℃
- 70.6℃
- 72.3℃
- 81.9℃
92. 그림과 같은 액면계(liquid level system)가 있다. 단면적(A)이 A = 3ft2, qo=8√h 이고 평균 조작수위 h = 4ft 일 때 시상수(time constant)는 얼마인가?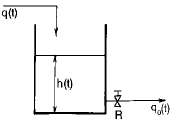
- 4/9min
- 3√3 /4min
- 3/4min
- 3/2min
93. f(t)=1의 Laplace 변환은?
- S
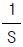
- S2
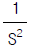
94. 그림의 블록선도에서 출력 Y1(s)와 Y2(s)의 표현으로서 올바른 것은?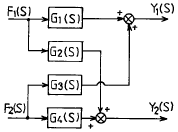
95. 개회로 전달함수가 K/(s + 4)(s + 5)S인 부궤환계가 있다. 근궤적의 점근선이 실수축과 이루는 각도는 얼마인가?
96. 다음 그림은 전기 조절기의 어떤 동작에 상당하는가?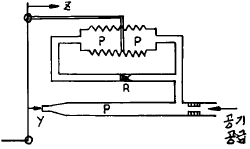
- 비례 - 적분동작기구
- 비례 - 미분동작기구
- 비례 - 미분 -적분동작기구
- 비례 동작기구
97. 그림의 기호는 무엇을 나타내는가?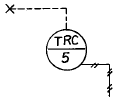
- 팽창식 온도지시 조절계
- 온도기록 조절계(panel상에)
- 온도검출요소 조절계
- 온도기록 조절계(현장에)
98. 전달함수가 Y(S)/X(S) = (τ1S + 1)/(τ2S + 1)인 계에서 단위계단응답 Y(t)는?
99. 복사에 의한 열전달 식은 q = kcAT4 으로 나타내어 진다(k, c, A : 상수). 정상상태에서 T = Ts 일 때 이 식을 선형화 시키면?
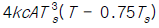
- kcA(T-Ts)
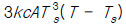
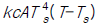
100. 다음은 화학공장의 공정제어의 필요성에 대해 설명한 것이다. 잘못 설명된 것은?
- 균일한 제품을 생산하여 제품의 질을 향상시키기 위해
- 운전도중 안전사고의 예방을 위해
- 생산비 절감 및 생산성 향상을 위해
- 공장운전의 무인화를 위해
6과목: 화학공업개론
101. 인산 2암모늄 비료는 (NH4)2HPO4이다. 이 조성 중 P2O5의 이론적인 함량은 백분율로 얼마가 되겠는가? (단, (NH4)2HPO4 M.W = 132, P2O5 M.W = 142)
- 53.8%
- 73.8%
- 81.9%
- 92.9%
102. 접촉식 황산제조 공정에서 전화기에 대한 설명중 옳은 것은?
- 전화기조작에서 온도조절이 좋지 않아서 온도가 너무 상승하면 전화율이 감소하므로 이의조정이 중요하다.
- 전화기는 SO3 생성열을 제거시키며 동시에 미반응가스를 냉각시킨다.
- 촉매의 온도는 200℃ 이하로 운전하는 것이 좋기때문에 열교환기의 용량을 증대시킬 필요가 있다.
- 전화기의 열교환방식은 최근에는 거의 내부 열교환방식을 채택하고 있다.
103. Dorr식 NaOH 제조공정에서 CaCO3가 각 분리조 바닥에 용이하게 배출될 수 있을 정도로 잘 가라앉기 위하여는 어떤 인자들이 작용되는가?
- 입자의 모양
- 침전입자와 액체와의 밀도차
- 입자의 크기
- 액체의 비중
104. 부식전류가 크게 되는 원인을 열거한 것이다. 옳지 않은 것은?
- 산소분포가 균일할 때
- 서로 다른 금속들이 접하고 있을 때
- 금속이 전도성이 큰 전해액과 접촉하고 있을 때
- 금속표면의 내부응력의 차가 클 때
105. 산화에틸렌의 수화반응으로 만들어지는 것은?
- 아세트알데히드
- 에틸렌글리콜
- 에틸알코올
- 글리세린
106. 에너지원으로 석유ㆍ석탄등의 화석연료를 이용시 나타나는 문제점 및 에너지의 변환에 대한 설명중 맞는 것은?
- CO2의 증가는 지구온난화 및 오존층파괴의 원인
- CO2와 SOX는 광화학스모그의 원인
- NOX는 산성비 및 공기중 오존농도 증가의 원인
- 열에너지로 부터 기계에너지로의 변환효율은 거의 100%에 가깝다.
107. 염화수소(HCl)가스의 합성에 있어서 폭발이 일어나지 않도록 주의하여야 할 사항이 아닌 것은?
- 공기와 같은 불활성 가스로 염소가스를 묽게 한다.
- 석영괘, 자기괘등 반응완화 촉매를 사용한다.
- 생성된 염화수소 가스를 냉각 시킨다.
- 수소가스를 과잉으로 사용하여 염소가스를 미반응 상태가 안되도록 한다.
108. 석유계 아세틸렌 제조법이 아닌 것은?
- 아크 분해법
- 부분 연소법
- 저온 분유법
- 수증기 분해법
109. 암모니아 산화법에 의한 질산 제조에서 백금-로듐(Pt-Rh) 촉매에 대한 설명 중 옳지 않은 것은?
- 백금(Pt) 단독으로 사용하는 것보다 수명이 60% 정도 연장된다.
- 촉매 독물질로서는 비소, 유황, 인, 규소 등의 화합물이다.
- 백금에 로듐(Rh) 함량이 10%인 것이 2%인 것보다 전화율이 낮다.
- 백금(Pt) 단독으로 사용하는 것보다 내열성이 강하다
110. 수평균 분자량이 100,000인 어떤 고분자 시료 1 g 과 수평균 분자량이 200,000인 같은 고분자 시료 2 g을 서로 섞으면 혼합시료의 수평균 분자량은?
- 0.5× 105
- 0.667× 105
- 1.5× 105
- 1.667× 105
111. 암모니아 합성은 고온고압하에서 이루어지며 촉매에 가장 적절한 온도를 설정하는 것이 중요하다. 이때의 온도조절 방식이 아닌 것은?
- 뜨거운 가스 혼합식
- 촉매층간 냉각 방식
- 촉매층내 냉각방식
- 열 교환식
112. H2SO4 60%, HNO3 32%, H2O 8%의 조성을 가진 혼합산 100kg을 벤젠으로 니트로화 할 때 그 중 질산이 화학양론적으로 전부 벤젠과 반응하였다면 DVS(Dehydration Value of Sulfuric acid) 값은?
- 2.50
- 3.50
- 4.50
- 5.50
113. 디음 중 연료전지에 대한 설명 중 틀린 것은?
- 연료전지란 연료의 연소열을 직접 전기에너지로 변환하는 전지이다.
- 음극활성 물질로 H2, 저급탄화수소와 같은 기체, 알코올과 같은 액체를 사용한다.
- 연료전지의 전해질로서 알칼리 수용액, 용융탄산염, 인산수용액 등을 사용한다.
- 양극활성 물질로 hydrazine, Cl2와 같은 기체를 사용한다.
114. 나프탈렌을 고온(160℃)에서 H2SO4과 반응시킨 후 알칼리 용융, 산처리하여 얻을 수 있는 주생성물은?
- α -나프톨
- β -나프톨
- α -나프탈렌 술폰산
- β -나프탈렌 술폰산
115. 탄화수소의 열분해를 방지하기 위하여 사용되는 증류법은?
- 상압증류
- 감압증류
- 가압증류
- 추출증류
116. 스티렌의 제조원료는?
- 에틸렌과 톨루엔
- 에틸렌과 벤젠
- 에틸렌과 클로로벤젠
- 프로필렌과 톨루엔
117. 오늘날 환경오염에 대한 심각성이 대두되면서 폐수처리나 유해가스를 효과적으로 처리할 수 있는 장치의 개발이 많이 요구되고 있다. 특히 값싸고 안전한 광촉매를 이용한 처리기술이 발달되고 있는데, 다음 중 광촉매로 많이 사용되고 있는 반도체 물질은?
- MgO
- CuO
- TiO2
- FeO
118. 인광석을 산분해하여 인산을 제조하는 방식 중 습식법에 해당하는 것이 아닌 것은?
- 황산 분해법
- 염산 분해법
- 질산 분해법
- 아세트산 분해법
119. 비스브레이킹(visbreaking)에 관한 설명중 옳지 않은 것은?
- 접촉분해시 코오크스화하는 것을 억제하는 전처리이다.
- 약 480℃, 수십기압하에서 실시된다.
- 고체상태로 실시하는 완만한 열분해 법이다.
- 접촉 분해로 원료유의 점도를 저하시킨다.
120. 요소비료의 제조방법 중 카바메이트 순환방식의 제조방법은?
- IG법
- Inventa법
- Du Pont법
- CCC법






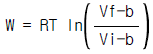
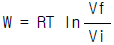
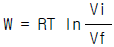
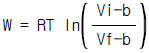
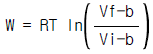 "이 된다.
"이 된다.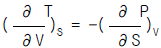
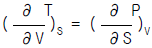
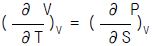
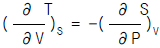
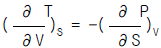 "이다. 이유는 이 식은 전기장과 자기장의 회전에 대한 관계를 나타내며, 전기장의 회전율과 자기장의 회전율이 서로 비례한다는 것을 나타내기 때문이다. 이는 전자기파의 전파속도를 계산하는 데에 사용된다.
"이다. 이유는 이 식은 전기장과 자기장의 회전에 대한 관계를 나타내며, 전기장의 회전율과 자기장의 회전율이 서로 비례한다는 것을 나타내기 때문이다. 이는 전자기파의 전파속도를 계산하는 데에 사용된다.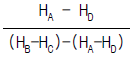
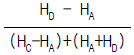
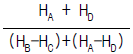
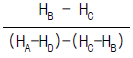
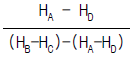 "이다.
"이다.

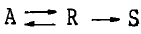
 " 이다.
" 이다.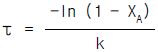 " 이다. 이유는 밀도가 일정하므로 반응물과 생성물의 양이 시간에 따라 일정하게 변화하며, 반응물과 생성물의 농도는 공간에 따라 일정하게 분포하기 때문이다. 따라서 시간과 공간의 변화를 나타내는 공간시간은 "
" 이다. 이유는 밀도가 일정하므로 반응물과 생성물의 양이 시간에 따라 일정하게 변화하며, 반응물과 생성물의 농도는 공간에 따라 일정하게 분포하기 때문이다. 따라서 시간과 공간의 변화를 나타내는 공간시간은 "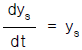
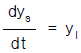
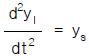
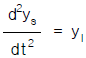
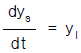 " 이다.
" 이다.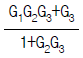
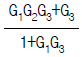
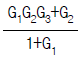
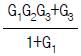
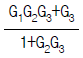 이다.
이다.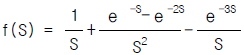
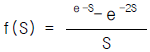
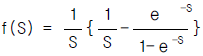
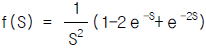
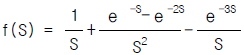 " 이다. 이 그림은 사인 함수의 그래프와 유사하다. 사인 함수는 주기적으로 반복되는 함수이며, 그래프는 원점을 중심으로 대칭이다. 이 그림도 주기적으로 반복되는 형태이며, 그래프가 원점을 중심으로 대칭이다. 따라서 이 그림은 사인 함수의 그래프와 유사하다고 볼 수 있다.
" 이다. 이 그림은 사인 함수의 그래프와 유사하다. 사인 함수는 주기적으로 반복되는 함수이며, 그래프는 원점을 중심으로 대칭이다. 이 그림도 주기적으로 반복되는 형태이며, 그래프가 원점을 중심으로 대칭이다. 따라서 이 그림은 사인 함수의 그래프와 유사하다고 볼 수 있다.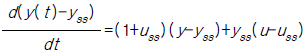
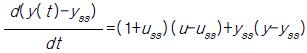
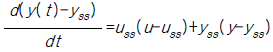
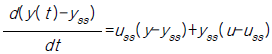
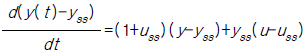 "이다.
"이다.

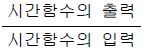
 "는 입력값을 받아 출력값으로 변환하는 함수를 나타내는 그림으로, 가장 타당한 정답이다.
"는 입력값을 받아 출력값으로 변환하는 함수를 나타내는 그림으로, 가장 타당한 정답이다.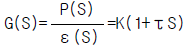 의 꼴로 표시된다. 이는 현재 오차와 오차의 변화율을 모두 고려하여 출력을 결정하는 제어기로, 빠른 반응성과 안정성을 모두 갖추고 있다. P형 제어기는 오차만 고려하고, PI형 제어기는 오차와 오차의 적분값을 고려한다. PID형 제어기는 오차, 오차의 적분값, 오차의 변화율을 모두 고려한다.
의 꼴로 표시된다. 이는 현재 오차와 오차의 변화율을 모두 고려하여 출력을 결정하는 제어기로, 빠른 반응성과 안정성을 모두 갖추고 있다. P형 제어기는 오차만 고려하고, PI형 제어기는 오차와 오차의 적분값을 고려한다. PID형 제어기는 오차, 오차의 적분값, 오차의 변화율을 모두 고려한다.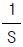 이다. 이유는 Laplace 변환의 정의에 따라 F(s) = L{f(t)} = ∫[0,∞) e^(-st)f(t)dt 이고, f(t)=1일 때 이를 대입하면 F(s) = ∫[0,∞) e^(-st)dt 이다. 이를 적분하면 F(s) = [-1/s * e^(-st)]_[0,∞) = [0 + 1/s] =
이다. 이유는 Laplace 변환의 정의에 따라 F(s) = L{f(t)} = ∫[0,∞) e^(-st)f(t)dt 이고, f(t)=1일 때 이를 대입하면 F(s) = ∫[0,∞) e^(-st)dt 이다. 이를 적분하면 F(s) = [-1/s * e^(-st)]_[0,∞) = [0 + 1/s] = 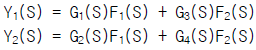
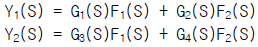
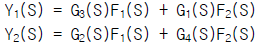
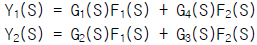
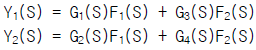 " 입니다.
" 입니다. 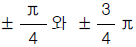
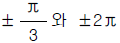
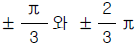
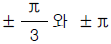
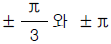 "이다.
"이다.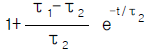
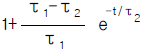
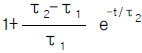
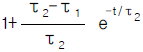
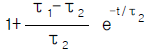 " 이다.
" 이다.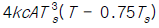 "가 정답이 된다.
"가 정답이 된다.