1과목: 화공열역학
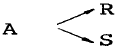
1. Van der Waals식을 이용하여 실제기체의 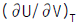 를 구한 결과로서 맞는 것은?
를 구한 결과로서 맞는 것은?
2. 열역학 법칙에 관한 설명 중 틀린 것은?
- 계의 총괄에너지 변화에 외계의 총괄에너지 변화를 더하면 영이 된다.
- 에너지는 여러 가지 형태를 가질 수 있지만 총괄에너지의 총량은 일정하다.
- 어떠한 순환과정에 의해서도 계가 흡수한 열을 완전히 일로 변환시키는 것은 불가능하다.
- 가역단열과정에서 계의 엔트로피 변화는 항상 양의 값을 갖는다.
3. 화학반응에서 정방향으로 반응이 계속 일어나는 경우는? (단, Δ G는 Gibbs free energy 변화임)
- Δ G = Kc
- Δ G = 0
- Δ G > 0
- Δ G < 0
4. 수증기 3㎏mole 이 2㎏/㎝2, 290℃의 상태하에서 10㎏/㎝2까지 등온 압축하는데 제거하여야 할 열량은 몇㎉인가? (단, 처음 상태의 S1 = 1.9645㎉/㎏, 최종상태의 S2 =1.7038㎉/㎏이다.)
- -6927.2
- -7927.2
- -8927.2
- -9729.2
5. 어떤 연료의 발열량이 10000㎉/㎏일때 이 연료 1㎏이 연소해서 30%가 유용한 일로 바뀔수 있다면 500㎏의 무게를 올릴 수 있는 높이는 약 얼마인가?
- 25m
- 250m
- 2.5㎞
- 25㎞
6. 내부 에너지 10㎉, 압력이 1atm,부피가 1m3인 계의 엔탈피는?
- 10㎉
- 14㎉
- 24㎉
- 34㎉
7. 열용량이 Cp인 물질이 정압하에서 온도 T1에서 T2까지 변화할 때 엔트로피(Entropy)변화량은?
- Cp(T2-T1)
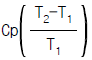
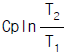
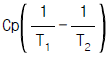
8. 다음의 각 냉동 사이클 가운데 1 냉동톤당 냉동제의 순환량이 가장 적게 필요한 것은?
- Carnot 냉동 사이클
- 공기 냉동 사이클
- 증기-압축냉동 사이클(팽창 밸브 설치)
- 증기-압축냉동 사이클(팽창 엔진 설치)
9. 어떤 유체가 장치속으로 1.8㎞/min의 유속으로 들어간다. 이 유체가 장치를 어떤 속도로 떠나야 들어가고 나갈때의 운동에너지의 차가 그 유체의 1㎉/㎏에 해당하겠는가?
- 5.76㎞/min
- 6.24㎞/min
- 9.63㎞/min
- 11.57㎞/min
10. 이상용액에 대한 설명 중 틀린 것은?
- 혼합에 따른 엔탈피 및 엔트로피의 변화가 없다.
- 모든 농도범위에서 Lewis-Randall법칙이 성립된다.
- 용액중 한 성분의 부분 몰용적은 그 성분이 순수한 상태에서 갖는 몰용적과 같다.
- 용액속에서의 분자간의 인력은 서로 같은 분자간의 인력이나 서로 다른 분자간의 인력이 모두 같다.
11. Diesel기관과 Otto기관의 차이점에 관한 설명 중 틀린 것은?
- Diesel기관이 Otto기관보다 압축과정에서의 온도가 충분히 높아서 연소가 자발적으로 시작한다.
- 같은 압축비를 사용하면 Otto기관이 Diesel기관보다 효율이 높다.
- Diesel기관은 Otto기관보다 미리 점화하게 되므로 얻을 수 있는 압축비에 한계가 있다.
- Diesel기관은 연소공정이 거의 일정한 압력에서 일어날 수 있도록 서서히 연료를 주입한다.
12. Van der Waals 식에 따르는 1 몰의 기체를 17℃ 의 온도에서 등온가역과정으로 20 L에서 10 L로 압축할 때의 일은 몇 J 인가? (단, Van der Waals 식은 아래와 같이 표시된다. 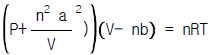 이 때 a = 4 L2/atm-mol2, b = 0.027 L/mol, R = 8.314J/mol-K, 1 atm-Lr = 101.3 J )
이 때 a = 4 L2/atm-mol2, b = 0.027 L/mol, R = 8.314J/mol-K, 1 atm-Lr = 101.3 J )
- 1654.24 J
- -1654.24 J
- 1694.76 J
- -1694.76 J
13. C(s) + O2(g) → CO2(g) : △H1 = -94050 kcal/kmolㆍCO2CO(g)+1/2 O2(g) → CO2(g):△H2 = -67640 kcal/kmolㆍCO2 위와 같은 반응을 알고 있을 때 다음 반응열은 얼마인가?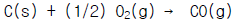
- -37025 kcal/kmolㆍCO2
- -26410 kcal/kmolㆍCO2
- -74050 kcal/kmolㆍCO2
- +26410 kcal/kmolㆍCO2
14. 어떤 계가 단일 초기평형상태에서 두 개의 과정으로, 하나는 가역적으로 다른 하나는 비가역적으로 똑같은 최종 평형상태로 변한다. 이들 과정의 △S가 계에 어떻게 관계 하는가?
- △Sirr = △Srev.
- △Sirr > △Srev.
- △Sirr < △Srev.
- 알 수 없다.
15. 1 mole의 이상기체가 등온하에서 10 atm에서 1 atm로 팽창된 때의 entropy의 변화는 몇㎈/gㆍ㏖ K인가?
- 1.57
- 2.57
- 3.57
- 4.57
16. 다음 중에서 같은 환산온도와 환산압력에서 압축인자가 가장 비슷한 것끼리 짝지워진 것은?
- 아르곤-크립톤
- 산소-질소
- 수소-헬륨
- 메탄-프로판
17. 다음 중 열역학 제1법칙을 옳게 표현한 것은?
- 위치에너지와 운동에너지는 서로 반비례한다.
- 이상기체에만 적용되는 법칙이다.
- 엔트로피의 증가원리를 표현한 법칙이다.
- 에너지보존 법칙을 표현한 법칙이다.
18. 일정온도와 일정압력에서 일어나는 화학반응의 평형판정 기준을 옳게 표현한 식은? (단, △는 반응물과 생성물의 관련성질 변화량이며, 아래첨자 tot은 총변화량을 나타내며, G = 깁스 자유에너지, H = 엔탈피이다.)
- (ΔGtot)T,P = 0
- (ΔHtot)T,P > 0
- (ΔGtot)T,P < 0
- (ΔHtot)T,P= 0
19. 어떤 화학반응에 대한 Δ S° 는 Δ H° = Δ G° 인 온도에서 어떤 값을 갖겠는가?
- Δ S° > 0
- Δ S° < 0
- Δ S° = 0
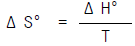
20. 어떤 기체가 Joule Thomson Inversion point가 될수 있는 조건은?(단, 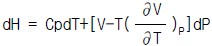 이다.)
이다.)
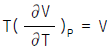
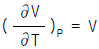
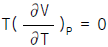
- dH = 0
2과목: 화학공업양론
21. 다음은 수평도관의 흐름을 해석하는데 적용되는 기계적 에너지 수지식의 설명이다. 틀린 것은?
- 마찰손실은 에너지수지가 성립하기 위해 보충해주는 에너지양이다.
- 마찰손실이 증가하면 속도수두의 변화도 증가한다.
- 마찰손실이 감소하면 압력강하도 증가한다.
- 마찰손실이 증가하면 위치에너지 변화는 감소한다.
22. 현재 전세계 에너지 소비율이 (energy consumption rate)이 7.1× 1012 W 라고 한다면, 이 양은 매년 몇 칼로리씩 소모되는 양인가?(단, 4.2J/cal 이다.)
- 2.2× 1020cal/year
- 5.3× 1019cal/year
- 3.2× 1019cal/year
- 4.3× 1020cal/year
23. 임계상태의 설명중 맞는 것은?
- 임계온도는 기상이 액상으로 바뀔 수 있는 최소 온도이다.
- 임계압력은 기상이 액상으로 바뀔 수 있는 최대 압력이다.
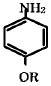
- 임계점에서 체적에 대한 압력의 이분값이 존재하지 않는다.
- 기상거동이 액상거동에 근접해 있는 상태이다.
24. 단일 증류탑을 이용하여 폐처리된 에탄올 25mol%와 물 75mol%의 혼합액 50kg mol/hr을 증류하여 85mol%의 에탄올을 회수해서 공정에 재사용하고, 나머지 잔액은 3mol%의 에탄올이 함유된 상태로 폐수처리 시키고자한다. 이 같은 증류탑을 통해 혼합액 중에 몇 %에 해당하는 양이 증류공정을 통해 회수가 되겠는가?
- 85%
- 88%
- 91%
- 93%
25. 모터로 무게 900N인 벽돌짐을 30초내에 15m올리려 한다. 모터가 필요로 하는 최소한의 일률은?
- 250W
- 350W
- 450W
- 550W
26. 포스겐가스를 만들기 위하여 CO가스 1.2몰(㏖)과 Cl2가스 1몰을 다음 반응식과 같이 촉매하에서 반응시킨다. 이 때 전환율이 90%이라면 반응후 총 몰수는?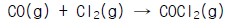
- 1.2몰
- 1.1몰
- 1.3몰
- 1.4몰
27. 이상기체라고 가정할 때 단열공정(adiabatic process)에 대한 P-V-T(압력-부피-온도)의 관계가 올바른 것은? [단, k = (Cp/Cv)이다.]
- T2/T1 = (V1V2)K-1
- T2/T1 = (P2P1)K-1
- T2/T1 = (P2P1)(K-1)/K
- T2/T1 = (V1V2)(K-1)/K
28. 평균 열용량이 CP인 이상기체를 T1에서 T2까지 일정압력과 일정용적에서 가열할 때 열용량 사이의 관계는?
- Δ U = dE - d(PV)
- CVΔ t = (Cp-R)Δ t
- Δ U = CVΔ t - W
- Δ U = RΔ T
29. 압축계수 Z는 이상기체 법칙에서 PV=ZNRT로 놓아서 정의된 계수로 옳은 것은?
- Z는 이상기체의 경우 1이다.
- Z는 실제기체의 경우 1이다.
- 일반화시킨 즉 환산연수로는 정의할 수 없다.
- Z는 그의 단위가 R값의 역수이다.
30. 벤젠의 표준 총 발열량(고발열량)은 -780980㎈/g-㏖이고, 표준 진발열량(저발열량)은 -749423㎈/g-㏖이다. 이 때 물의 증발 잠열은?
- -1530403㎈/g-㏖
- 31557㎈/g-㏖
- 10519㎈/g-㏖
- 1530403㎈/g-㏖
31. 비엔탈피의 설명 중 틀린 것은?
- 물질의 열역학적 상태변화를 규정짓는 특성치이다.
- 비엔탈피변화는 비내부에너지, 압력 및 비용에 의해 결정된다.
- 비엔탈피변화는 일반적으로 일정압력하의 열용량과 온도차에 의해 결정된다.
- 비엔탈피변화는 일반적으로 일정부피하의 열용량과 온도차에 의해 결정된다.
32. 다음 중 이상기체 상수 R 에 해당하는 값은?
33. 연속 정류탑에 의하여 알코올을 정류한다. feed의 농도는 35% EtOH이고 탑상 유출물은 85% EtOH, 탑저에서 5% EtOH로 분류한다면, feed 1㎏당 탑상 유출물의 ㎏수는?
- 0.215
- 0.375
- 0.450
- 0.530
34. 다음 중 에너지 단위는?
- Paㆍm3
- Watt
- N/m2
- Joule/s
35. 18℃의 물 500g을 80℃로 온도를 높이는데 발열량 5200㎉/m3의 기체 연료 12L가 소비되었다. 연료가 완전히 연소하였다면 열손실은?
- 25.2 %
- 30.2 %
- 50.3 %
- 70.5 %
36. 암모니아 합성 공정의 조작에서 1:3의 N2, H2 혼합물을 반응기에 급송하였더니 30%가 NH3 로 변환하였다. 생성한 NH3는 응축시켜 분리하고 미반응 기체는 반응기로 재순환을 시켰다. 처음 N2-H2 혼합물은 100 에 대하여 0.2비로 Ar을 포함하고 있다. 반응기에 들어가는 Ar의 허용한도는 N2-H2 100 용적에 대하여 5 라고 한다면 제거해야 할 순환율의 분율은 얼마인가?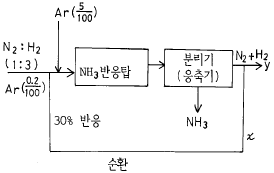
- 0.013
- 0.23
- 2.24
- 25.4
37. 몰 증발잠열을 구할 수 있는 방법중 두가지 물질의 증기압을 동일 온도에서 비교하여 대수좌표에 나타낸 것은?
- Duhring plot
- Othmer plot
- Cox chart
- Watson plot
38. 카르노(carnot)기관이 열을 고열원에서 125kcal를 받고 저열원에서 75kcal를 배출할 때, 이 열기관의 효율은?
- 20%
- 30%
- 40%
- 50%
39. 화학공정을 통해 얻어진 자료가 연속적인 변수값을 나타낸다. 자료해석을 위해 평균값을 계산하려고 하는데 다음중 어떤 유형의 평균값을 이용하는 것이 가장 바람직하겠는가?
- 가중평균
- 기하평균
- 대수평균
- 산술평균
40. 다음식은 Van der Waals의 실존기체의 상태식으로 제안된식이다. 이 식에서 a의 단위는 다음 어느 것인가?
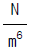
- Nㆍm2
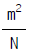
- Nㆍm4
3과목: 단위조작
41. 장치설계에서 이론단수(theoretical stage)가 의미하는 것은?
- 평형이 이루어지는 수
- 조작회수
- 처리하는 회수
- 탑의 실제단수
42. 내경이 10㎝인 곧은 pipe 속으로 유체가 도입된다. 이 유체의 NRe가 2,000일 때 전이길이(transition length)는?
- 5m
- 10m
- 15m
- 20m
43. 순수한 물 20℃의 점도는?
- 1[g/㎝ㆍsec]
- 1[cP]
- 1[Paㆍs]
- 1[㎏/mㆍsec ]
44. absorption factor method를 이용하여 이상단수를 구할 수 있는 경우는?
- 조작선이 직선이면 평형선이 직선이 아니라도 구할 수 있다.
- 조작선이 직선이 아니라도 평형선이 직선이면 된다.
- 조작선과 평형선이 직선이어야 한다.
- 조작선과 평형선에 관계없이 공급선이 직선이면 된다
45. 가열된 평판위로 Prandtl 수가 1보다 큰 액체가 흐를 때 수력학적 경계층 두께δ h와 열전달 경계층 두께 δ T와의 관계로 옳은 것은?
- δ h>δ T
- δ h<δ T
- δ h=δ T
- Prandtl 수 만으로는 알 수 없다.
46. 다음 중 Nusselt Number는? (단, h:전열계수, D:지름, k:열전도도, ρ :밀도, Cp:비열, ν :동점도, α :열확산도)
- hD/k
- k/ρ Cp
- ν /α
- ν /D
47. plait point 에 대한 설명으로 옳지 않은 것은?
- 이 점에서 2 상이 1 상이 된다.
- 이 점에서는 추출이 불가능하다.
- Tie line 의 길이가 0 이다.
- 이 점을 경계로 추제성분이 많은 쪽이 추잔상이다.
48. 천연가스를 상온 상압에서 300 m3/min 를 파이프로 통하여 수송한다. 이 조건에서 공정 파이프 라인(line) 의 최적 유속이 2 m/sec 라고 하면 사용관의 최적 직경은?
- 1.4(m)
- 1.8(m)
- 2.1(m)
- 2.5(m)
49. 어떤 냉장고가 내면 1/2인치의 송판 중간에 4인치의 코르크판 그리고 외면은 3인치의 콘크리트 구조로 되어 있다. 냉장고 내벽의 온도는 255K이고, 외벽의 온도는 297K이다. 송판의 열전도도(K)는 0.15, 코르크판의 열전도도(K)는 0.04, 그리고 콘크리트의 열전도도(K)는 0.762W/mㆍK이다. 이 때 1m2에 대한 열손실(W)은?
- 1.541(W)
- 15.41(W)
- 154.1(W)
- 1541(W)
50. 흡수탑에서 액체 체류량이 증가하기 시작하는 점을 의미하는 것은?
- flooding point(왕일점)
- loading point(부하점)
- channeling(편통)
- entrainment(비말동반)
51. 3중 효용 증발기에서 첫번 효용 증발기에 들어가는 수증기의 온도가 230℉ 이고, 맨끝 효용기의 비점이 145℉ 이다. 각 효용기의 총괄 전열계수가 각각 500, 400, 200Btu/ft2ㆍhrㆍ℉ 일 때 제1 효용기에서의 비점은 얼마인가?(단, 비점 상승은 무시한다.)
- 165.1℉
- 180.1℉
- 202.1℉
- 212.1℉
52. Momentum flux(운동량 流速)에 대한 표현으로 옳지 않은 것은?
- Mass flux와 선속도의 곱이다.
- 밀도와 Mass flux와의 곱이다.
- 밀도와 선속도 자승의 곱이다.
- Mass flow rate와 선속도의 곱을 단면적으로 나눈 것이다.
53. 같은 용적, 같은 압력하에 있는 같은 온도의 두 기체 A와 B의 몰수는 어떤 관계인가?
- 같다
- 다르다
- A = 2B
- B = 2A
54. 증발관내에서 포말생성의 예방과 관계가 없는 것은?
- 액체를 가열표면까지 올려서 가열로 파괴한다.
- 수증기를 분출하여 파괴한다.
- 피마자유, 식물유 등을 첨가해서 억제한다.
- 증발관 상부에 큰 공간을 둔다.
55. 50㎏/hr의 물을 10℃에서 75℃까지 가열하려고 170℃의 연도가스 200㎏/hr를 병류로 흐르게 하였다. 연도가스의 비열이 0.25kcal/kg℃, 총괄전열계수가 100㎉/hr m2℃일 때 소요 전열면적은 몇 m2인가?
- 0.42
- 0.84
- 1.26
- 1.68
56. 다음 중 이동단위높이(HTU)를 구할 수 있는 것은?
- 물질전달계수와 질량속도로 부터
- 평행선의 기울기로 부터
- 탑내농도 변화로 부터
- 조작선의 기울기로 부터
57. Fick의 법칙에 대한 설명으로 옳은 것은?
- 확산 속도는 농도 구배 및 면적에 반비례한다.
- 확산 속도는 농도 구배에 비례하고, 면적에 비례한다
- 확산 속도는 압력에 반비례하고, 절대온도에 비례한다.
- 확산 속도는 압력에 비례하고, 면적에 비례한다.
58. 추출에서는 3성분계로 추질 a 를 포함하는 용액(추료) b를 용매 S 로서 추출하면 서로 혼합되지 않는 두 상, 즉 추출액과 추잔액의 두 층으로 나뉜다. 이 평형계는 3 상이 서로 용존해 있으므로 그림과 같이 삼각좌표를 사용한다. 점 P 에서의 용매 S 의 성분은?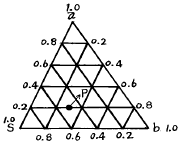
- 60 %
- 50 %
- 30 %
- 20 %
59. 기체의 증습원리에 어긋나는 것은?
- 기체중의 증기를 도입하는 방법
- 기체중에 높은 습도의 기체를 혼입하는 방법
- 기체나 물을 직접 접촉시키는 방법
- 기체를 압축액화시키는 법
60. Hagen - Poiseuille 식과 Fanning 식에 대한 설명으로 옳지 않은 것은?
- 두식 모두 관내의 압력손실을 구하는데 사용될 수 있다.
- Hagen - Poiseuille 식은 관내의 유체가 층류인 경우에만 유용하다.
- Fanning 식은 관내의 유체가 난류인 경우에만 유용하다.
- Fanning 식은 마찰계수를 사용하여 압력손실을 계산한다.
4과목: 반응공학
61. A→ R 인 반응이 체적 V = 0.05ℓ 인 플러그흐름 반응기에서 일어날 때 반응 속도식은 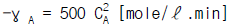 이다. CAO = 0.01mole/ℓ 이고 공급 속도가 0.05ℓ /min이라면 전환율은?
이다. CAO = 0.01mole/ℓ 이고 공급 속도가 0.05ℓ /min이라면 전환율은?
62. 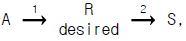 각 경로의 활성화에너지가 E1 < E2 인 경우의 반응에 대한 설명으로 적합한 것은?
각 경로의 활성화에너지가 E1 < E2 인 경우의 반응에 대한 설명으로 적합한 것은?
- 공간시간(τ)이 상관 없다면 가능한 한 최저 온도에서 반응
- 등온 반응에서 τ 값이 주어지면 가능한 한 최고 온도에서 반응
- 온도 변화가 가능하다면 초기에는 낮게 반응이 진행됨에 따라 높게 반응
- 온도 변화가 가능하더라도 최적 등온 조작이 유리
63. N2O2의 1차 반응 속도상수는 0.345/min이고, 초기농도 CAo가 1.6㏖/ℓ이었다면 N2O2의 농도가 0.6㏖/ℓ 될 때까지의 소요시간은?
- 1.81분
- 2.84분
- 3.62분
- 2.33분
64. A + R → R + R인 자기촉매 반응의 시간에 따른 전화율을 잘 나타낸 그림은?
65. 다음 반응에서 CA0 = 1㏖/ℓ, CR0 = CS0 = 0 그리고 속도상수 k1 = k2 = 0.1min-1와 100ℓ/h의 원료유입에서 R을 얻는다고 한다. 이 때 성분 R의 수득률을 최대로 할 수 있는 플러그 흐름 반응기의 크기를 구하면?(단, 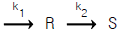 )
)
- 16.67ℓ
- 26.67ℓ
- 36.67ℓ
- 46.67ℓ
66. 크기가 다른 3개의 혼합반응기(mixed flow reactor)를 사용하여 2차 반응에 의해서 제품을 생산하려 한다. 최대의 생산율을 얻기 위한 반응기의 설치 순서로서 옳은 것은?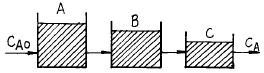
- A → B → C 순서
- B → A → C 순서
- C → B → A 순서
- 순서에 무관
67. CSTR(Continuous Stirred Tank Reactor)의 체류분포 시간을 측정하기 위해서 계단입력과 펄스입력을 이용하였다. 이상유동일 때 다음 중 틀린 것은?
- 계단 입력과 펄스입력의 체류시간 분포는 다르다.
- 계단 입력과 펄스입력의 평균 체류시간은 같다.
- 펄스 입력의 출력곡선은 체류시간 분포와 같다.
- 평균체류 시간은 반응기내의 반응물 부피를 급송량으로 나눈것과 같다.
68. 평균체류 시간이 같은 관형반응기와 혼합반응기에서 A → R(-γ A = kCAn)으로 표시되는 화학반응이 일어날 때 관형반응기의 전화율 XP와 혼합반응기의 전화율 Xm의 비 XP/Xm 이 가장 큰 반응차수는?
- 0차
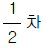
- 1차
- 2차
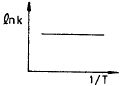
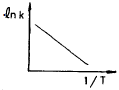
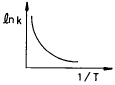
69. 반응속도 상수 k는 온도 T의 영향을 많이 받는다. lnk와 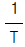 사이의 관계를 바르게 나타낸 그래프는?
사이의 관계를 바르게 나타낸 그래프는?
70. 다음 그림은 어떤 균일계 비가역 병렬 반응기에서 순간수율 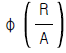 와 반응물의 농도(CA)간의 관계를 나타낸 것이다. 빗금친 부분의 넓이가 뜻하는 것은?
와 반응물의 농도(CA)간의 관계를 나타낸 것이다. 빗금친 부분의 넓이가 뜻하는 것은?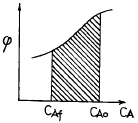
- 총괄 수율 Ф
- 반응하여 없어진 반응물의 몰수
- 반응으로 생긴 R의 몰수
- 반응기를 나오는 R의 농도
71. A→ R 인 액상 1차반응이 등온회분 반응기에서 진행된다. 이 때 액상반응물 A의 70%가 13분만에 전화되었다. 이 조건에서 같은 전화율을 얻기 위해 필요한 PFR에서의 공간시간(space time)은?
- 13(min)
- 16(min)
- 18(min)
- 26(min)
72. 다음은 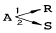 반응의 농도와 시간과의 그림이다. 생성물(生成物) R 을 많이 생기게 하려고 할 때의 반응온도 조건은? (단, E1 은 1의 경로의 활성화에너지, E2는 2의 경로의 활성화에너지이다.)
반응의 농도와 시간과의 그림이다. 생성물(生成物) R 을 많이 생기게 하려고 할 때의 반응온도 조건은? (단, E1 은 1의 경로의 활성화에너지, E2는 2의 경로의 활성화에너지이다.)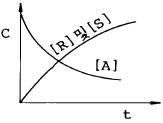
- E1 > E2 때 저온조작
- E1 > E2 때 고온조작
- E1 = E2 때 저온조작
- E1 = E2 때 고온조작
73. 그림과 같은 기초적 반응에 대한 농도 - 시간곡선을 가장 잘 표현하고 있는 반응 형태는?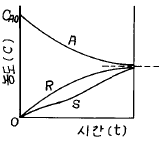
74. 아세트산 에틸의 가수분해는 1차 반응속도식에 따른다고 한다. 만일 어떤 실험조건하에서 정확히 20 % 를 분해시키는데 50 분이 소요 되었다면 반감기는?
- 16.1분
- 31.3분
- 139.2분
- 155.3분
75. 다음 그림은 농도 - 시간의 곡선이다. 옳은 반응식은?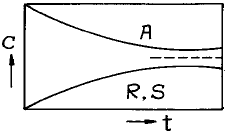
76. Ideal steady state flow reactor 의 종류 중 틀린 것은?
- Mixed flow reactor
- Plug flow reactor
- Piston flow reactor
- Batch reactor
77. 이상기체 반응물 A 가 1 L/sec 속도로 체적 1 L 의혼합 반응기에 공급되어 50 % 가 반응 된다. 나가는 속도는 2 L/sec, 반응식이 A → 3R 일 때 일정온도 압력하에서 반응물 A 의 평균 체류시간(mean residence time)은 몇 초 인가?
- 0.5
- 1.0
- 1.5
- 2.0
78. A → R인 반응에 대하여 동일한 반응 조건에서 정촉매를 사용하였을 때의 반응속도상수 Kpc와 촉매를 사용하지 않았을 때의 Kp 사이의 관계는?
- Kp > Kpc
- Kp < Kpc
- Kp = Kpc
- 알수없다.
79. 다음과 같은 식에서  (원하는 생성물)
(원하는 생성물) 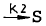 R을 원하는 생성물이라고 하면 다음 중 옳은 방법은?
R을 원하는 생성물이라고 하면 다음 중 옳은 방법은?
- E1 > E2면 저온으로 함
- E1 < E2면 고온으로 함
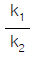 을 크게 함
을 크게 함 을 적게 함
을 적게 함
80. 반응물 A가 다음의 평행 반응으로 반응한다. 이에 대한 설명으로 옳은 것은? (단, 이 때 R,은 목적하는 생성물, S는 목적하지 않는 생성물이다.)
- a1 > a2일 때, 회분식 반응기나 플러그 흐름 반응기가 유리하다.
- a1 = a2일 때, 반응물 A의 농도가 낮은 것이 좋다.
- a1 = a2일 때, 반응기의 크기에 영향을 받지 않는다.
- a1 < a2일 때, 반응기의 형태에 영향을 받지 않는다.
5과목: 공정제어
81. 다음 기계식 압력계 가운데서 탄성 압력계는?
- 벨로우스식
- 환상 천칭식
- 피스톤 압력계
- 2액마노미터
82. 반응속도 상수의 온도의 조성은 다음의 아레니우스(Arrhenius)식으로 표현된다. 정상상태 온도 TS에서 선형화 시킨 K의 표현으로 타당한 것은?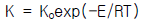
83. 시간상수 τ 가 0.1분이고, 게인 Kp가 1인 온도계가 초기에 90℃를 유지하고 있다. 이 온도계를 100℃의 물속에 넣었을때 온도계 읽음이 98℃가 되는데 걸리는 시간은 얼마인가?
- 0.082분
- 0.124분
- 0.161분
- 0.216분
84. 다음 미분방정식 해의 라플라스 함수는?
85. 어떤 압력측정장치의 측정범위는 0∼400 psig, 출력범위는 4∼20 mA로 조정되어 있다. 이 장치의 이득을 구하면 얼마인가?
- 0.01 mA/psig
- 25 mA/psig
- 0.08 mA/psig
- 0.04 mA/psig
86. 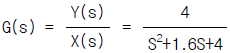 인 2차계의 단위계단 응답시 %over shoot 및 최대값은?
인 2차계의 단위계단 응답시 %over shoot 및 최대값은?
- over shoot = 20.7%, 최대값 = 1.207
- over shoot = 25.4%, 최대값 = 1.254
- over shoot = 30.7%, 최대값 = 1.307
- over shoot = 35.4%, 최대값 = 1.354
87. 다음 중 계단입력에 대한 공정출력이 가장 느리게 움직이는 것은?
88. 폐회로제어계(Closed -Loop Control System)를 설명한 것은 ?
- 부정확하고 신뢰성은 적으나 설치비가 저렴
- 순차제어(Sequence Control)라고도 하며,기기에 의한 희망조건의 유지및 변화제어
- 출력신호가 귀환요소를 통하여 입력측으로 귀환된 후 그 오차를 검출하여 제어하는 계
- 되먹임제어(Feedback Control)라고도 하며 제어계의 출력과 입력이 서로 독립적인 제어계
89. 선형계의 안정성을 판별하기 위한 특성방정식이 올바로 표기된 것은?
- 1 + 닫힌 루프 전달함수 = 0
- 1 - 닫힌 루프 전달함수 = 0
- 1 + 열린 루프 전달함수 = 0
- 1 - 열린 루프 전달함수 = 0
90. 다음의 제어방식중 잔류편차(off - set)는 존재하나 최종값에 도달시간을 단축시킬수 있는 제어방식은?
- P형
- PI형
- PD형
- PID형
91. 다음 그림의 블록선도에서 총괄 전달함수가 옳은 것은?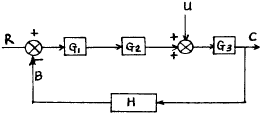
92. 다음의 함수를 라플라스로 전환한 것으로 맞는 것은?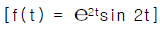
93. 개회로 전달함수(open -loop transfer function) 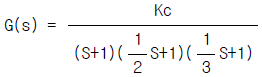 인 계(系)에 있어서 Kc가 4.41인 경우 특정방정식은?
인 계(系)에 있어서 Kc가 4.41인 경우 특정방정식은?
- S3 + 7S2 + 14S + 76.5 = 0
- S3 + 5S2 + 12S + 4.4 = 0
- S3 + 4S2 + 10S + 10.41 = 0
- S3 + 6S2 + 11S + 32.5 = 0
94. 어떤 1차계의 전달함수는 1/(2s+1) 로 주어진다. 이제 크기 1, 지속시간 1인 펄스입력변수가 도입되었을 때 출력은? (단, 정상상태에서의 입력과 출력은 모두 0으로 간주한다.)
- 1-e-t/2- {1-e-(t-1)/2}u(t-1)
- 1-e-(t-1)/2u(t-1)
- 1-te-t/2u(t-1)
- 1-{e-t/2+e-(t-1)/2}u(t-1)
95. 아래함수의 Laplace변환은 다음 중 어느 것인가?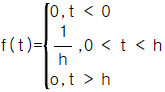
96. 다음 설명 중 맞는 것은 ?
- 페루프의 동특성은 공정의 동특성에 의해 결정되며 제어기의 조율에는 무관하다.
- 적분공정의 경우는 비례제어기 만으로도 설정점 변화를 오프셋 없이 따라 갈 수 있다.
- 폐루프의 안정성은 제어기의 조율에 관계없이 공정에 의해서 이미 결정 된다.
- 시간지연이 있는 일차공정의 경우 제어기 이득 크기에 관계없이 폐루프는 안정하다.
97. 전달함수{G(S)}가 G(S) = 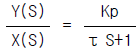 인 1차계에서 입력 x(t)가 단위순간(impulse)인 경우 출력 y(t)는?
인 1차계에서 입력 x(t)가 단위순간(impulse)인 경우 출력 y(t)는?
98. 물탱크에서 물이 관을 통해 밖으로 빠져나가는 양이 물탱크 안의 액체 높이의 제곱근에 비례할 때 이를 선형화 하여 현재의 액체 높이로 표현했을 때 올바른 것은?
- 현재의 높이의 반 x 높이
- 현재의 높이의 제곱근 x 높이
- 현재의 높이의 제곱근의 역수의 반 x 높이
- 현재의 높이의 제곱근의 반 x 높이
99.  의 고차계 공정에서의 단위계단 입력에 대한 공정응답 중 맞는 것은?
의 고차계 공정에서의 단위계단 입력에 대한 공정응답 중 맞는 것은?
- 차수 n 이 커지면 진동응답이 생길 수 있다.
- 차수 n 이 커질수록 응답이 느려진다.
- 시상수 τ 가 클수록 응답이 빨라진다.
- 이득 K 가 커지면 진동응답이 생길 수 있다.
100. 그림과 같이 표시되는 함수의 Laplace 변환은?
- e-cs
 [f]
[f] - ecs
 [f]
[f]  [f(s-c)]
[f(s-c)] [s(s+c)]
[s(s+c)]
6과목: 화학공업개론
101. 생고무의 90%이상이 고분자량의 탄화수소로 되어 있는데 어떤 부가구조형태를 가지고 있는가?
- 1, 2 결합
- 2, 3 결합
- 3, 4 결합
- 1, 4 결합
102. 수소가스 제조 공정에서 2차 개질 공정의 주 반응은?
- CO + H2O → CO2 + H2
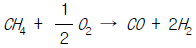
- CO2 + 3H2 → CH4 + H2O
- C + O2 → CO2
103. 소금의 전기분해에 대한 설명 중 틀린 것은?
- 전해조의 전류효율은 Faraday의 법칙에 기초를 두어 실제 생산량과 이론 생산량의 비율로 나타낸다.
- 전압효율은 이론분해 전압과 실제 전해조 전압의 비율로 나타낸다.
- 전력효율은 전류효율× 전압효율로서 표시된다.
- 이론 분해 전압은 Gibbs-Duhem 식
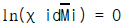 로 구한다.
로 구한다.
104. 인산제조 방법 중 건식법의 특징이 아닌 것은?
- 습식법보다 Fe, Al 성분을 많이 포함하는 저품위 인광석(P2O5)을 처리할 수 없다.
- 인의 기화와 산화를 각각 별도로 할 수 있다.
- 고순도로 진한 인산이 생긴다.
- slag는 시멘트의 원료가 된다.
105. 디메틸테레프탈레이트와 에틸렌글리콜을 축중합하여 얻어지는 것은?
- 폴리아미드 섬유
- 폴리에스테르계 섬유
- 아크릴 섬유
- 폴리비닐알콜계 섬유
106. 다음 유지의 분석시험값 중 성분 지방산의 평균분자량을 알 수 있는 것은?
- Acid value (산값)
- Rhodan value (로단값)
- Acetyl value (아세틸값)
- Saponification value (비누화값)
107. 아닐린을 Na2Cr2O7을 산화제로 황산용액 중에서 저온(5℃)에서 산화시켜 얻을 수 있는 생성물은?
- 벤조퀴논
- 아조벤젠
- 니트로벤젠
- 니트로페놀
108. 다음 반응의 생성물은?
109. 촉매의 담체(carrier)에 대한 설명 중 틀린 것은?
- 자체만으로 촉매작용이 없다.
- 열에 대한 안전성을 부여한다.
- 촉매의 용융을 방지한다.
- 선택성을 감소시킨다.
110. 업용수 중 칼슘이온의 농도가 20 mg/L 이었다면, 이는 몇 ppm 경도에 해당하는가 ?
- 20
- 30
- 40
- 50
111. 수성가스를 제조할 때 메탄의 생성을 억제하기 위한 조건으로서 맞는 것은?
- 낮은 압력, 낮은 온도
- 낮은 압력, 높은 온도
- 높은 압력, 낮은 온도
- 높은 압력, 높은 온도
112. 암모니아 합성용 수소가스의 정제순서는?
- 워어터가스전화 - 황화합물제거 - CO2제거 - CO제거- CH4제거
- 황화합물제거 - CO2제거 - 워어터가스전화 - CO제거- CH4제거
- 워어터가스전화 - CO2제거 - 황화합물제거 - CO제거- CH4제거
- 황화합물제거 - 워어터가스전화 - CO2제거 - CO제거- CH4제거
113. 반도체 제조 공정중 원하는 형태로 패턴이 형성된 표면에서 원하는 부분을 화학반응 혹은 물리적 과정을 통하여 제거하는 공정은?
- 세정공정
- 식각공정
- 포토리소그래피
- 건조공정
114. 에스테르는 산과 알콜이 다음의 어느 반응을 일으켜 생성되는가?
- 검화
- 환원
- 축합
- 중화
115. 다음 요소 비료에 대한 설명 중 틀린 것은?
- CO2와 NH3를 원료로 사용하여 만든다.
- 합성온도는 약 180∼200℃ 이다.
- 반응압력은 약 2∼3 atm이다.
- 비순환법에서는 황산암모니아가 부산물로 생긴다.
116. 올레핀과 CO와 H2의 혼합가스를 촉매 존재하에서 고압으로 반응시켜 카르보닐 화합물을 제조하는 반응은?
- 옥소 반응
- 에스테르화 반응
- 카르보닐화 반응
- 산화 반응
117. 전지 Cu│ CuSO4(0.05M), HgSO4(S)│ Hg의 기전력은 25℃에서 약 0.418 V이다. 이 전지의 자유에너지 변화(△G)는?
- -96 kcal
- -19.3 kcal
- -9.65 kcal
- -193 kcal
118. 0.5 Faraday의 전류량에 의해서 생성되는 NaOH의 양은 몇 g 인가?(단, Na=23, H=1, O=16)
- 10
- 20
- 30
- 40
119. 연실식 황산제조에서 Gay - Lussac탑의 기능은?
- 황산의 생성
- 질산의 환원
- 질소산화물의 회수
- 니트로실 황산의 분해
120. Poly(vinyl alcohol)의 원료 물질은?
- 비닐알콜
- 염화비닐
- 초산비닐
- 플루오르화비닐





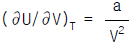
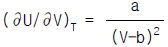
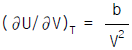
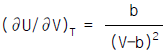

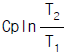 이다. 이유는 엔트로피 변화량은 열과 함께 전달되는 열역학적인 특성이기 때문에, Cp(T2-T1)와 같이 열용량과 온도 차이를 이용하여 계산할 수 있다. 따라서, 보기에서
이다. 이유는 엔트로피 변화량은 열과 함께 전달되는 열역학적인 특성이기 때문에, Cp(T2-T1)와 같이 열용량과 온도 차이를 이용하여 계산할 수 있다. 따라서, 보기에서 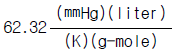

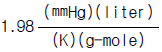
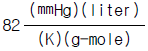
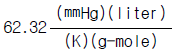 " 입니다.
" 입니다.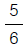
 이다.
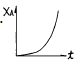
이다.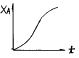

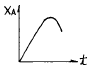
 "이다. 이유는 A + R → R + R인 자기촉매 반응은 초기에는 A와 R의 농도가 높아서 반응이 빠르게 일어나 전화율이 높아지지만, 시간이 지남에 따라 R의 농도가 증가하면서 반응 속도가 느려지고 전화율이 감소하기 때문이다. 따라서 그래프는 초기에는 급격히 상승하다가 점차 감소하는 모양새를 보이게 된다. 이러한 모양새가 "
"이다. 이유는 A + R → R + R인 자기촉매 반응은 초기에는 A와 R의 농도가 높아서 반응이 빠르게 일어나 전화율이 높아지지만, 시간이 지남에 따라 R의 농도가 증가하면서 반응 속도가 느려지고 전화율이 감소하기 때문이다. 따라서 그래프는 초기에는 급격히 상승하다가 점차 감소하는 모양새를 보이게 된다. 이러한 모양새가 "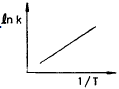
 " 이다.
" 이다.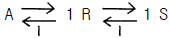
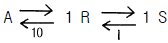
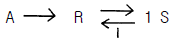
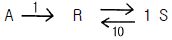
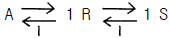 "이다. 이유는 초기에 농도가 높을수록 반응 속도가 빠르게 증가하다가 일정 농도 이상부터는 반응 속도가 더 이상 증가하지 않고 일정하게 유지되기 때문이다. 이러한 형태의 반응을 일급 반응(First-order reaction)이라고 한다. 다른 보기들은 초기에 반응 속도가 일정하게 유지되거나, 농도가 높아질수록 반응 속도가 감소하는 형태의 반응을 나타내기 때문에 이 문제에서는 가장 적합하지 않다.
"이다. 이유는 초기에 농도가 높을수록 반응 속도가 빠르게 증가하다가 일정 농도 이상부터는 반응 속도가 더 이상 증가하지 않고 일정하게 유지되기 때문이다. 이러한 형태의 반응을 일급 반응(First-order reaction)이라고 한다. 다른 보기들은 초기에 반응 속도가 일정하게 유지되거나, 농도가 높아질수록 반응 속도가 감소하는 형태의 반응을 나타내기 때문에 이 문제에서는 가장 적합하지 않다.


 "이다.
"이다.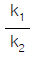 을 크게 한다는 것은 반응의 활성화 에너지를 줄이는 것으로, 반응이 더 쉬워지게 된다. 따라서 원하는 생성물을 만들기 위한 반응이 어려울 경우
을 크게 한다는 것은 반응의 활성화 에너지를 줄이는 것으로, 반응이 더 쉬워지게 된다. 따라서 원하는 생성물을 만들기 위한 반응이 어려울 경우 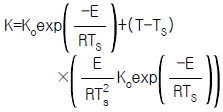
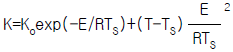
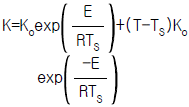
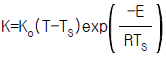
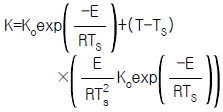 " 이다.
" 이다.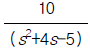
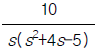
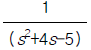
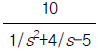
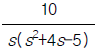 " 가 정답이다.
" 가 정답이다.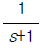
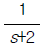
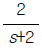
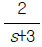
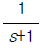 "이다. 이유는 계단입력이 들어오면, 출력이 변화하기까지 시간이 오래 걸리기 때문이다. 이 출력은 계단함수의 형태를 띄고 있어서, 입력이 변화하면 출력이 급격하게 변화하게 된다. 이러한 계단함수의 출력은 시간이 지남에 따라 점차 안정화되기 때문에, 출력이 변화하기까지 시간이 오래 걸리게 된다. 따라서 계단입력에 대한 공정출력이 가장 느리게 움직이는 것은 "
"이다. 이유는 계단입력이 들어오면, 출력이 변화하기까지 시간이 오래 걸리기 때문이다. 이 출력은 계단함수의 형태를 띄고 있어서, 입력이 변화하면 출력이 급격하게 변화하게 된다. 이러한 계단함수의 출력은 시간이 지남에 따라 점차 안정화되기 때문에, 출력이 변화하기까지 시간이 오래 걸리게 된다. 따라서 계단입력에 대한 공정출력이 가장 느리게 움직이는 것은 "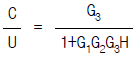
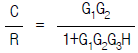
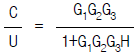
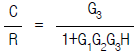
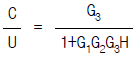 "이다.
"이다. 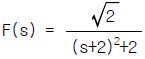
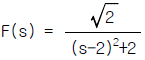
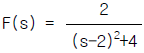
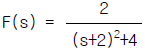
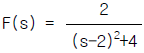 " 이다.
" 이다.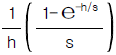
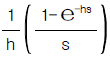
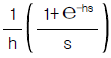
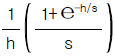
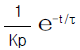

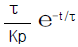
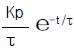
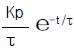 "이다.
"이다. [f]"이다.
[f]"이다.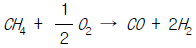 " 이다. 이유는 이 반응식이 메탄(Methane)을 생산하는 반응식이기 때문이다.
" 이다. 이유는 이 반응식이 메탄(Methane)을 생산하는 반응식이기 때문이다. 로 구한다."가 틀린 설명입니다. 이론 분해 전압은 네르스트 방정식을 이용하여 구합니다. Gibbs-Duhem 식은 상태 방정식 중 하나로, 화학 반응에 대한 열역학적 평형을 나타내는 식입니다.
로 구한다."가 틀린 설명입니다. 이론 분해 전압은 네르스트 방정식을 이용하여 구합니다. Gibbs-Duhem 식은 상태 방정식 중 하나로, 화학 반응에 대한 열역학적 평형을 나타내는 식입니다.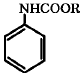
 " 이기 때문에 정답은 "
" 이기 때문에 정답은 "
Van der Waals식은 실제 기체의 분자 크기와 상호작용을 고려한 식으로, 이상기체의 상태방정식인 PV=nRT 식보다 실제 기체의 상태를 더 정확하게 나타낼 수 있다. 따라서 Van der Waals식을 이용하여 구한 결과가 가장 정확하다.
Van der Waals식은 다음과 같다.
(P + a(n/V)^2)(V - nb) = nRT
여기서, P는 압력, V는 부피, n은 몰수, T는 온도, a와 b는 기체의 특성상수이다.
따라서, Van der Waals식을 이용하여 실제기체의