1과목: 화공열역학
1. 다음 그림은 카르노 사이클인데 T1에서 열을 받고 T2에서 열을 방출한다. 카르노 동력사이클의 순서는 다음 어느 것인가?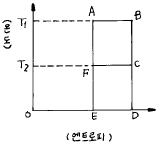
- A - B - C - D - E - F - A
- A - B - C - F - E - D - C
- A - B - C - F - A
- F - C - B - A - F
2. 압축 또는 팽창에 관해 옳게 설명된 것은? (단, 첨자 S는 등엔트로피를 의미)
- 압축기의 효율은 η = (Δ H)S /Δ H 로 나타낸다.
- 노즐에서 에너지 수지식은 WS = -Δ H 이다.
- 터빈에서 에너지 수지식은 WS = -∫ u du 이다.
- 조름공정에서 에너지 수지식은 dH = - u du 이다.
3. 열용량 Cp및 Cv의 값이 일정한 이상기체가 단열 가역적으로 팽창 또는 수축할 때 다음 중에서 옳은 것은?
- 일의 양은 반드시 0 이다.
- 열전달량은 반드시 0 이다.
- 내부 에너지의 변화는 0 이고 계에 열이 들어온다.
- 내부 에너지의 변화는 0 이고 계에서 열이 나간다.
4. 물과 수증기와 얼음이 공존하는 삼중점에서 자유도의 수는?
- 0
- 1
- 2
- 3
5. 질량이 500g인 기체 암모니아가 70℃의 항온조에 담겨있는 20000㎝3의 봄베속에 들어있다. 이상기체법칙에 의하여 봄베속의 압력을 계산하면 얼마인가?
- 40.4 bar
- 43.5 bar
- 41.9 bar
- 46.7 bar
6. 다음 중 열의 일당량은 어느 것인가?
- 427㎏ㆍm/㎉
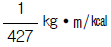
- 427㎉/㎏ㆍm
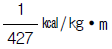
7. 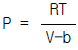 (단,b : 상수)로 표시되는 기체의 퓨가시티 계수,ø 는?
(단,b : 상수)로 표시되는 기체의 퓨가시티 계수,ø 는?
8. 액체로부터 증기로 바뀌는 정압 경로를 밟는 순수한 물질에 대한 G와 T의 그래프 중 옳게 표시된 것은? (단, G는 깁스 자유에너지이다.)
9. 1 mole의 이상기체가 1 기압 0℃ 에서 10 기압으로 압축 되었다. 다음 중 어느 과정을 경유하였을 때 압축 후의 온도가 가장 높겠는가?
- 등온 압축(isothermal)
- 등적 압축(isometric)
- 단열 압축(adiabatic)
- 비가역 압축(irreversible)
10. 물질의 기본적 성질에 대한 미분형 관계식을 표시하고 있다. 틀 린 것은?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- dU = TdS + PdV
- dH = TdS + VdP
- dA = -SdT - PdV
- dG = SdT + VdP
11. 어떤 화학반응의 평형정수의 온도에 대한 미분계수가 다음과 같이 표시된다. 이 반응에 대한 설명으로 옳은 것은?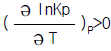
- 이 반응은 흡열반응이며, 온도상승에 따라 K의 값이 커진다.
- 이 반응은 흡열반응이며, 온도상승에 따라 K의 값은 작아진다.
- 이 반응은 발열반응이며, 온도상승에 따라 K의 값은 커진다.
- 이 반응은 발열반응이며, 온도상승에 따라 K의 값은 작아진다.
12. 낮은 압력의 실제 기체는 비리얼(virial)상태 방정식을 압력의 항으로 전개하면 다음과 같다. Z = 1 + B'P, 단 B'(T) 이러한 일정량의 기체를 등온가역 압축을 하면 한 일은 이상기체의 경우와 비교하면 어떻게 되는가?
- 같다.
- 크다.
- 작다.
- 비교할 수 없다.
13. 열과 일 사이의 에너지 보존의 원리를 표현한 법칙은?
- 보일 샤를의 법칙
- 열역학 제 1법칙
- 열역학 제 2법칙
- 열역학 제 3법칙
14. 용매에 소량의 기체가 녹아 있을 때 나타나는 퓨가시티를 구하고자 할 경우에 가장 적절한 방법은?
- Raoult's law를 이용한다.
- Henry's law를 이용한다.
- Nernst의 분배법칙을 이용한다.
- Vander Waals식을 이용한다.
15. 등온과정에서 이상기체의 초기 압력이 1atm, 최종압력이 10atm 이면 엔트로피 변화는?
- Δ S = RT
- Δ S = 2.303 RT
- Δ S = 4.606 RT
- Δ S = RTㆍln5
16. 다음 중 Joule - Thomson 계수(μ )에 대한 설명으로 옳은 것은?
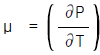 로 정의된다.
로 정의된다.- 고압에선 양의 값이다.
- 전환점에선 1이다.
- 이상기체에선 영이다.
17. 대기압하에 있는 SO2가스를 400℉로 부터 1600℉까지 흐름 과정으로 가열하려고 한다. SO2유속이 400lb/min일 때 열전달 속도는 몇 Btu/min인가? (단,Cp = 12.47 Btu/lb mole℉이다.)
- 93400
- 93525
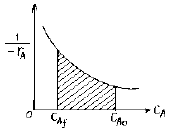
- 98525
- 103400
18. 화학반응에서 정방향으로 자발적반응이 일어나는 경우는?
- Δ G > 0
- Δ G < 0
- Δ G = 0
- Δ G = Kc
19. Gibbs Duhem식이 다음 식으로 표시될 경우는? (단, Xi : i성분의 조성, 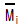 :i성분의 부분몰특성)
:i성분의 부분몰특성)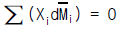
- 압력과 몰(㏖)수가 일정할 경우
- 몰(㏖)수와 온도가 일정할 경우
- 몰(㏖)수와 성분이 같을 경우
- 압력과 온도가 일정할 경우
20. 다음은 carnot cycle에 관한 설명이다. 틀 린 것은?
- 가역 사이클이다.
- 작업물질의 종류에 무관하다.
- 그 효율은 두 열원의 온도에만 의하여 결정된다.
- 비가역 열기관의 열효율은 가역기관의 열효율보다 클 수 있다.
2과목: 화학공업양론
21. 다음 중 SI 단위계로만 구성된 것은?
- cm, dyne, erg,
- ft, K㏖/m3, m2/s, cal
- lbm, Btu, Ω , ㎛2
- ㎏, N, ℃, sec
22. 1기압이 760mmHg인 것을 이용하여 kgf/㎝2 단위로 환산하면 얼마인가?
- 14.7
- 1.0336
- 29.92
- 1013
23. 질소에 벤젠이 10Vol%포함되어 있다. 온도 20℃,압력 740㎜Hg때 이 혼합물의 관계 포화도를 %로 구하면? (단,20℃에서 순수한 벤젠의 증기압은 80㎜Hg이다.)
- 10.8%
- 80.0%
- 92.5%
- 100.0%
24. 다음에서 자유도(F1 + F2)는 얼마인가?
- 1
- 2
- 3
- 4
25. 0℃에서 100℃까지 산소의 평균 몰 열용량은 Cp = 6.987㎈/gmolㆍK 이다. 0℃부터 시작하여 몇 K가 되면 정용하에서의 산소의 엔트로피 증가가 1㎈/gmol K 만큼 증가하는가? (단, 산소는 이상기체로 가정한다.)
- 22.50 K
- 33.86 K
- 222.0 K
- 333.6 K
26. 30℃,760㎜Hg에서 공기중의 수증기압이 30㎜Hg이고,이 온도에서 포화 수증기압은 0.0533㎏/㎝2이다. 이 때 상대 습도는 얼마인가?
- 55.53%
- 65.54%
- 76.55%
- 85.56%
27. 질산 65%, 황산 5%, 물 30%로 이루어진 혼합산(A) 20 lb에 황산 60%, 질산 30%, 물 10%로 이루어진 혼합산(B) 30lb를 섞었을 때 최종 혼합산의 질산조성(%)은? (단, 혼합산의 직각 삼각도표는 우측에 나타나고 AB선분의 실측값이 4cm이다.)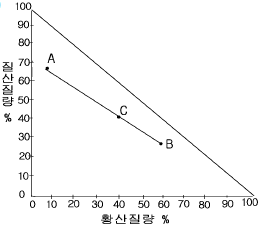
- 24
- 36
- 44
- 58
28. 다음과 같은 화학반응이 일어나고 있다.(표참조)feed의 molar flow rate는 100㎏-mole/hr이고 C2H4의 생산은 40.0㎏-mole/hr가 생산된다. CH4의 생산이 5.0㎏-mole/hr가 병행되고 있다면 methane에 대한 ethylene의 selectivity는 얼마인가?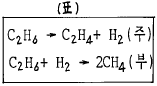
29. 표준상태에서 100L의 C2H6(g)를 완전히 액화한다면 몇 g의 C2H6(ℓ )이 되겠는가? (단, 이 C2H6 증기의 압축인자는 0.95이다.)
- 134g
- 141g
- 157g
- 163g
30. 이상기체 A의 정압열용량은 Cp =10 + 2×10-3T(J/mol℃)로 나타낸다. 이 때 이상기체 A의 2mol을 0℃에서 100℃까지 가열하는데 필요한 열량은 얼마인가?
- 1000 J
- 1010 J
- 2000 J
- 2020 J
31. 5%wt Na2SO4수용액에 Na2SO4ㆍ10H2O 1㎏을 첨가하여 30%wt Na2SO4수용액을 만들려고 한다. 5%Na2SO4수용액 얼마가 필요한가? (단,Na2SO4분자량 : 142, H2O분자량 : 18)
- 0.24㎏
- 0.56㎏
- 0.86㎏
- 결정못함
32. 지구상에서 70 kg중의 무게가 나가는 사람이 달 (중력가속도=4.9 m/s2)에서는 무게(kg중)가 얼마가 되는가?
- 70 kg중
- 140 kg중
- 17.5 kg중
- 35 kg중
33. 아래의 반응식을 이용하여 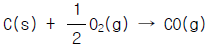 의 반응열을 계산하면 얼마인가?
의 반응열을 계산하면 얼마인가?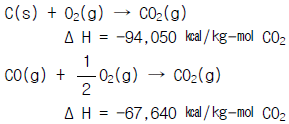
- -26,410 ㎉/㎏-㏖ CO
- 37,025 ㎉/㎏-㏖ CO
- -37,025 ㎉/㎏-㏖ CO
- 26,410 ㎉/㎏-㏖ CO
34. 실제기체에 대한 상태방정식으로 이용되고 있는 반데르발스 방정식(Van der Waal's equation)에서 상수 a와 b의 차원으로 모두 올바른 것은?
- a : atm ft3/1b mol, b = ft3/1b mol
- a : atm ft6/1b mol, b = ft3/1b mol
- a : ft6/1b mol, b = atm ft3/1b mol
- a : atm/1b mol, b = atm ft6/1b mol
35. 무게로 40%의 수분을 함유한 목재를 수분함량이 10%가 되도록 건조했다. 원목재 1㎏당 증발된 물의 양은?
- 113.3g
- 223.3g
- 333.3g
- 443.3g
36. 다음 중 온도 T 에서의 몰 기화열 Δ Hv에 대한 Clasius-Clapeyron 식의 변수 관계가 올바른 것은? (단, P*는 증기압, T는 절대온도, Vg와 Vt는 각각 기상과 액상의 몰 부피이다)
- dp*/dt = Δ Hv/[T(Vg - Vt)]
- dp*/dt = TΔ Hv/(Vg - Vt)
- dp*/dt = (Vg - Vt)/TΔ Hv
- dp*/dt = Δ Hv(Vg - Vt)/T
37. 0℃,1atm에서 22.4m3의 가스를 정압하에서 500㎉의 열을 가하였을때 이 가스의 온도는 몇℃가 되겠는가? (단,가스를 이상기체로 보고 정압평균분자 열용량은 6.5㎉/㎏㏖이다.)
- 57℃
- 67℃
- 77℃
- 87℃
38. 다음 3성분계 선도에서 R혼합물의 A성분의 조성을 잘못 표시한 것은? (단,AG = DN)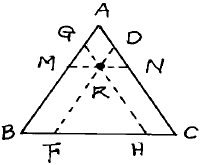
39. 자유도의 설명중 맞는 것은?
- 상평형을 규정하기 위해 고정시켜야 할 독립시량변수의 수이다.
- 상의 수에서 성분의 수를 뺀 값에 2를 더해준 값을 말한다.
- 깁스상률의 특별한 경우에 자유도가 유도된다.
- 상평형에 무관하게 고정시켜야 할 독립시강변수의 수이다.
40. 1atm,32℉에서 1lb의 물을 1atm,300℉ 수증기로 변화시키는데 필요한 열은? (단,물의 Cp = 1 Btu/lb ℉,수증기의 Cp = 0.4 Btu/1b ℉,1atm에서 Δ Hv = 1000 Btu/lb)
- 1015.2Btu
- 1115.2Btu
- 1215.2Btu
- 1315.2Btu
3과목: 단위조작
41. 다음 중 뉴톤유체가 아닌 것은?
- 가스
- 비콜로이드성 액체
- 진용액
- 콜로이드성 액체
42. 정류탑에서 q 선 의 기울기가 0 (零)이 되는 경우는?
- 비점의 액을 공급할 경우
- 과열 증기를 공급할 경우
- 포화액을 공급할 경우
- 포화 증기를 공급할 경우
43. 고정상 침출에 대한 설명으로 옳지 않은 것은?
- 고체는 추출이 끝날 때까지 탱크 내에 고정된다.
- 일반적으로 향류 조작을 한다.
- 용매로 비휘발성 물질을 사용한다.
- 밀폐된 공간에서 가압하에 조작한다.
44. 다음 중 열전도도가 가장 큰 것은?
- 메탄
- 메탄올
- 블록
- 알루미늄
45. 정분자 증발(constant molal vaporization)일 경우 유출물이 50㎏-㏖/hr로 얻었다. 원료는 1/2 이 포화증기이고, 1/2 이 포화액인 상태로 50㎏-㏖/hr 로 들어가며 조작환류비( reflux ratio ) 는 2 이다. 이 때 reboiler 에서 발생되는 증기의 속도는[㎏-㏖/hr]는?
- 150 ㎏-㏖/hr
- 100 ㎏-㏖/hr
- 200 ㎏-㏖/hr
- 125 ㎏-㏖/hr
46. 벤젠 1ℓ 에 0.1M 의 picric acid 를 가지는 용액에 벤젠 1ℓ 를 가하였을 때 분배계수가 0.5 이라면 벤젠 중에서 picric acid 의 농도는?
- 0.013M
- 0.023M
- 0.033M
- 0.043M
47. 혼합 초기, 혼합 도중, 완전혼합 시의 각 균일도 지수의 값을 바르게 나타낸 것은? (참고로 균일도 지수는 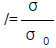 이며 σ 는 혼합 도중의 혼합분산, σ 0 는 혼합 전의 최초의 혼합분산이다.)
이며 σ 는 혼합 도중의 혼합분산, σ 0 는 혼합 전의 최초의 혼합분산이다.)
- 혼합 초기 : 0, 혼합 도중 : 0 에서 1 사이의 값, 완전 혼합 : 1
- 혼합 초기 : 1, 혼합 도중 : 0 에서 1 사이의 값, 완전 혼합 : 0
- 혼합 초기와 혼합 도중 : 0 에서 1 사이의 값, 완전 혼합 : 1
- 혼합 초기와 혼합 도중 : 0 에서 1 사이의 값, 완전혼합 : 0
48. 관을 통한 유체의 흐름에 있어서 경계층의 분리가 일어나는 상태에서 발생하는 마찰현상을 나타내는 용어는?
- 표면마찰 (skin friction)
- 두손실 (head loss)
- 자유난류 (free turbulent)
- 형태마찰 (form friction)
49. 공비 혼합물의 성질이 아닌 것은?
- 최고 및 최저 비점을 가진다.
- 상대 휘발도가 1 이다.
- 정비점 혼합물이라고 한다.
- 증류에 의하여 분리된다.
50. Reynolds 수의 물리적 의미는?
- 관성력과 점성력과의 비이다.
- 항력과 점성력과의 비이다.
- 중력과 점성력과의 비이다.
- 부력과 점성력과의 비이다.
51. 열복사현상의 일종인 온실효과에 대한 설명으로 옳지 않은 것은?
- 대기 중의 CO2 또는 H2O에 의해서도 발생될 수 있다.
- 긴 파장의 복사선은 유리와 같은 매개체를 쉽게 통과할 수 있다.
- 물체는 낮은 온도에서 긴 파장의 복사선을 방출한다.
- 온도에 따라 방출되는 복사선의 파장 차에 의해 나타나는 현상이다.
52. 복사 에너지를 증가시킬 수 있는 방법으로 옳지 않은 것은?
- 온도를 고온으로 한다.
- 복사 면적을 크게 한다.
- 흑체에 가까운 물질을 만든다.
- 표면을 광택있게 한다.
53. 건조 조작에 있어서 건조량을 결정하는데 가장 중요한 인자는?
- 평형 함수량(Equilibrium Moisture)
- 결합 수분(Bound Water)
- 비결합 수분(Unbound Water)
- 자유 수분(Free Moisture)
54. 길고 곧은 관내를 흐르는 유체가 난류흐름일 때 유체와 관벽 사이에서의 열전달에 대한 차원해석을 통하여 무차원 관계식이 얻어진다. 이 관계식에 포함되지 않는 무차원군은?
- 그레즈수(NGr)
- 프란틀수(NPr)
- 레이놀즈수(NRe)
- 누셀수(NNu)
55. 70℃, 1atm 에서 에탄올과 메탄올의 혼합물이 액상과 기상이 평형을 이루고 있을 때 기상의 에탄올의 몰분율은? (단, 이 혼합물은 이상용액으로 가정하며 70℃에서 순수한 에탄올과 메탄올의 증기압은 각각 543, 857 ㎜Hg이다)
- 0.12
- 0.31
- 0.62
- 0.75
56. 0.5㎉/hrㆍmㆍ℃ 의 열전전도를 가진 25㎝ 두께의 벽돌로 만들어진 가열로의 내벽 온도가 800℃, 외벽 온도가 50℃ 일때 단위면적 m2 당 열손실은 몇 ㎉/hrㆍm2 인가?
- 4,500
- 2,500
- 1,500
- 750
57. 습도를 측정하는 방법으로 옳지 않은 것은?
- 노점(dew point)측정
- 건.습구온도 측정
- 용적 변화 측정(습윤기체 흡수액에서)
- 습윤기체의 비열 측정
58. 유량측정기구 중 부자 또는 부표(float)라고 하는 부품에 의해 유량을 측정하는 기구는?
- 로타미터 (rotameter)
- 벤투리미터 (venturi meter)
- 오리피스미터 (orifice meter)
- 초음파유량계 (ultrasonic meter)
59. 다성분계의 기액평형에서 분배계수(distribution coefficient)가 1.20 이고, 액성조성이 0.2 였다면 기상에서의 평형조성은?
- 0.16
- 0.24
- 6
- 1
60. 유체가 관내를 층류로 흐르고 있다. Reynolds 수가 1000인 경우 직관에 의한 마찰손실을 계산할 때 사용되는 Fanning 식의 마찰계수 f의 값은?
- 0.012
- 0.016
- 0.020
- 0.024
4과목: 반응공학
61. 반응물 A 와 B 가 반응하여 목적하는 생성물 R 과 그 밖의 생성물이 생긴다. 다음과 같은 반응식 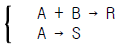 에 대해서 생성물 R 의 생성을 높히기 위한 반응물 농도의 조건은?
에 대해서 생성물 R 의 생성을 높히기 위한 반응물 농도의 조건은?
- CB 를 크게 한다.
- CA 를 크게 한다.
- CA, CB 둘 다 상관 없다.
- CB 를 작게 한다.
62. 반응속도 상수에 대한 식 d(ln k)/dt = (mRT + E)/RT2 에서 m=1/2인 경우는?
- 충돌이론
- 전이상태이론
- Arrhenius식
- 기체분자운동론
63. 촉매반응기구에 대한 설명으로 옳지 않은 것은?
- 기체분자가 촉매 표면에 흡착된다.
- 촉매독에 따른 활성점 농도는 일정하다.
- 활성점에는 점유와 공백활성점이 있다.
- 활성점에서 반응이 일어나 생성물이 나타난다.
64. 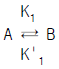 의 촉매 반응이 일어날 때 Langmuir 이론에 의한 A 의 흡착 반응 속도식은? (단, γA:흡착속도, K1,K' 각 경로에서 흡착속도 상수 θ :흡착분율, PA:A성분의 부분압)
의 촉매 반응이 일어날 때 Langmuir 이론에 의한 A 의 흡착 반응 속도식은? (단, γA:흡착속도, K1,K' 각 경로에서 흡착속도 상수 θ :흡착분율, PA:A성분의 부분압)
- γA = k1PAθAθB - k'1θB
- γA = k1PAθA(rθB) - k'1θA
- γA = k1PA(1-θA-θB) - k'1θA
- γA = k1PA(1-θA) - k'1θB
65. 어떤 물질의 분해반응은 1차 반응으로 99% 까지 분해하는 데 6646 초가 소요되었다고 한다면, 33% 까지 분해하는데 몇 초가 걸리겠는가?
- 1000초
- 1210초
- 580초
- 2215초
66. 부피 100ℓ 이고 space time 5min 인 mixed flow reactor에 대한 다음 설명 중 옳은 것은?
- 이 반응기는 1분에 20ℓ의 반응물을 처리할 능력이 있다.
- 이 반응기는 1분에 0.2ℓ의 반응물을 처리할 능력이 있다.
- 이 반응기는 1분에 5ℓ의 반응물을 처리할 능력이 있다.
- 이 반응기는 1분에 100ℓ의 반응물을 처리할 능력이 있다.
67. 다음 반응에 대해 Cs 를 최대로 하기 위한 최적 온도의 진행으로 옳은 것은? (단, E1 = 10, E2 = 25, E3 = 15, E4 = 10, E5 = 20, E6 = 25, E 는 Activation Energy)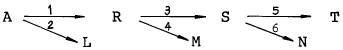
- 저온 - 저온 - 저온
- 저온 - 고온 - 저온
- 고온 - 저온 - 고온
- 고온 - 고온 - 저온
68. 구형연속 조작의 조작점 중 최적점은?
- M 점
- N 점
- 최적점은 없다.
- S 점
69. 그림 A,B,C 는 mixed flow reactor 와 plug flow reactor을 각각 다르게 연결한 것이다. 1 차 이상의 반응에서 그림 A 에서의 생성물의 양을 X1 로 하고 그림 B 에서의 생성물의 양을 X2 로 하며, 그림 C 에서의 생성물의 양을 X3로 하였을 때 옳은 것은?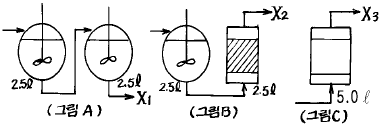
- X1 < X3 < X2
- X2 < X1 < X3
- X1 < X2 < X3
- X3 < X1 < X2
70. 반응속도 상수 k 의 단위는?
- (㏖/cm3)-1(sec)
- (㏖/cm3)n(sec)-1
- (㏖/cm3)1-n(sec)-1
- (㏖/cm3)n(sec)
71. 이상적 혼합 반응기(ideal mixed flow reactor)에 대한 설명으로 옳지 않은 것은?
- 반응기 내의 농도와 출구의 농도가 같다.
- 무한개의 이상적 혼합 반응기를 직렬로 연결하면 이상적 관형 반응기(plug flow reactor)가 된다.
- 1 차 반응에서의 전환율은 이상적 관형 반응기보다 혼합 반응기가 항상 못하다.
- 회분식 반응기(batch reactor)와 같은 특성을 나타낸다.
72. 에탄이 273℃ 에서 열분해 할 때의 활성화 에너지는 7500cal 이다. 546℃ 에서 열분해 할 때는 273℃ 에서 열분해 할 때 보다 몇 배 더 빠르겠는가?
- 2.3
- 5.0
- 7.5
- 10.0
73. 반응기에 유입되는 물질량의 체류시간에 대한 설명으로 옳지 않은 것은?
- 반응물의 부피가 변하면 체류시간이 변한다.
- 반응흐름이 실제흐름이면 체류시간이 달라진다.
- 액상반응이면 공간시간과 체류시간이 같다.
- 기상반응이면 공간시간과 체류시간이 같다.
74. plug flow reactor 속에서 phosphine 의 균일 기상 분해반응 4PH3(g) → P4(g) + 6H2 의 1200℉ 에서의 속도식은 -rPH3 = 10(1/hr)CPH3 이다. 순수한 phosphine 4 Lb mole/hr 인 원료 공급에 대하여 80 % 전화를 일으킬 수 있는 반응기의 크기는? (단,이 때의 압력은 4.6atm 이다)
- 233.6ℓ
- 233.6ft3
- 85.2ℓ
- 85.2ft3
75. 다음 각 그림의 빗금친 부분의 넓이 가운데 플러그 반응기의 공간시간 τ p를 나타내는 것은? (단, 밀도 변화가 없는 반응이다.)
76. 크기가 다른 두 혼합 흐름 반응기를 직렬로 연결한 반응기에 대한 설명으로 옳지 않은 것은? (단, n 는 반응차수를 의미한다.)
- n > 1 인 반응에서는 작은 반응기가 먼저 와야 한다.
- n < 1 인 반응에서는 큰 반응기가 먼저 와야 한다.
- 두 반응기의 최적 크기 비는 반응속도와 전화율에 따른다.
- 특수한 경우 1 차 반응에서는 다른 크기의 반응기가 이상적이다.
77. Space time 이 1.62 분이고 CAo = 4㏖/ℓ 이며 원료 공급이 1분에 1000 ㏖ 로 공급되는 흐름 반응기의 최소 체적은?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- 105ℓ
- 205ℓ
- 305ℓ
- 405ℓ
78. A → R → S (k1, k2) 인 반응에서 k1 = 1, k2 = 100 이면(CS/CA0)는?
- e-t
- e-100t
- 1 - e-t
- 1 - e-100t
79. 다음과 같은 반응에서 k1 = k2 = 1 sec-1 이다. p 의 농도 CP 가 최대로 되는 시간은 얼마인가?
- 1초
- 2초
- 3초
- 4초
80. 비가역 0 차 반응에서 반응이 완결되는데 필요한 반응 시간은?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- 초기 농도의 역수와 같다.
- 속도 정수, k 의 역수와 같다.
- 초기 농도를 속도 정수로 나눈 값과 같다.
- 초기 농도에 속도 정수를 곱한 값과 같다.
5과목: 공정제어
81. 개회로 전달함수 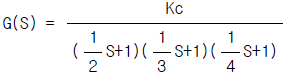 이면 근궤적의 분기점은?
이면 근궤적의 분기점은?
- -4.53
- -2.89
- -4.98
- -2.42
82. 다음 그림과 같은 나이퀴스트 선도(Nyquist diagram)로 부터 계의 안정도를 판별하면 어느 것인가?
- Stable
- Conditionally Stable
- Unstable
- not Known
83. 다음 블록선도로부터 레귤레이터 문제(Regulator problem)에 대한 총괄전달함수는?
84. PID 제어기에서 제어기 이득이 증가할 경우의 제어계의 응답특성은?
- 오프셋이 늘어난다.
- 폐루프 응답이 빨라진다.
- 제어기 입력에 대한 제어기 출력이 작아진다.
- 공정에서의 시간지연이 줄어든다.
85. 위치의 시간변화 및 운항장치 등에 주로 사용되는 제어기구는 어느 것인가?
- Servo 제어기구
- Regulator 제어기구
- Automatic 제어기구
- Load 제어기구
86. 라플라스 변환의 주요 목적은?
- 비선형 대수방정식을 선형 대수방정식으로 변환
- 비선형 미분방정식을 선형 미분방정식으로 변환
- 선형 미분방정식을 대수방정식으로 변환
- 비선형 미분방정식을 대수방정식으로 변환
87. 전달함수가 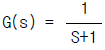 인 계의 대역폭(Band Width)은?
인 계의 대역폭(Band Width)은?
- 0
- 1
- √2
- 2
88. 다음 중 가능한 한 커야 하는 계측기의 특성은?
- 시간상수(time constant)
- 감도(sensitivity)
- 응답시간(response time)
- 수송지연(transportation lag)
89. 어떤 제어밸브를 통하여 흐르는 유체의 유속은 밸브 압력이 3psig에서 15psig까지 변할때 0(ft3/min)에서 2(ft3/min)까지 변한다면 이 밸브의 감도(sensitivity)는?
- 3/12
- 2/15
- 2/3
- 1/6
90. 제어계의 안정성을 판별하는 방법은?
- 매케이브 - 틸레법(Mecabe - Thiele method)
- 아인슈타인법
- 길리란드법(Gilliland method)
- 나이퀴스트법(Nyguist method)
91. 단면적이 A인 어떤 탱크가 있다. 수면으로 부터 h 만큼 떨어진 탱크의 측부분에 오리피스 구멍을 만들었다. 이 오리피스를 통해 나오는 유체의 유량은?
- h에 비례한다.
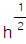 에 비례한다.
에 비례한다.- h2에 비례한다.
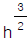 에 비례한다.
에 비례한다.
92. 미달감쇄 2차계(Under Damped 2nd Order System)에서 오우버슈우트는?
- 시간정수와 감쇄인자의 함수이다.
- 감쇄인자만의 함수이다.
- 시간정수만의 함수이다.
- 감쇄인자와는 상관없다.
93. 1차계의 경우 Corner 주파수에서의 AR (amplitude ratio)는?
- √2
- 1
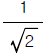
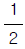
94. 전폐와 전개의 제어 형식으로 인하여 제어 결과가 cycling이 나타나는 제어기는?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- 비례 제어기
- 비례-미분 제어기
- 비례-적분 제어기
- on-off 제어기
95. 그림에서와 같이 원통형 물 저장탱크가 q(t)=20[m3/hr], h=4m로 정상상태에 있다. 그런데 t=0 이후부터 물을 25[m3/hr]로 증가시켜 넣었을 때 시간에 따른 높이의 변화식 h(t)는? [단, 배출유량(qo)과 탱크수위 높이(h)간의 관계식은 qo = K√h (K=상수)이다.]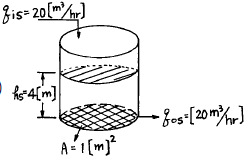
96.  의 시간함수는?
의 시간함수는?
- f(t) = e-t - 2e-2t
- f(t) = e-t + e-2t
- f(t) = e-t - e-2t
- f(t) = e-t + 2e-2t
97. f(t) = e-tsin 2t일때 Laplace transform f(s)는?
98. 수송래그(Transportation Lag)의 전달함수는 다음 중 어떤 것인가? (단, τ 는 제어계의 시간정수 이다.)
- G(s)=e-τs

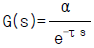
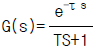
99. 다음 중 비례미분 제어기의 전달함수를 나타낸 것은? (단,τb = 2,τI = 3,Kc = 0.5)
100. 다음 그림은 두개의 탱크로 이루어진 액위 시스템을 보인 것이다. qi(t), q2(t)의 라플라스 변환을 각각 Qi(s), Q2(s)라고 할 때 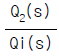 는 어떤 관계로 주어지는가? (단,R1과 R2는 저항을 나타내며 A1과 A2는 단면적이다.)
는 어떤 관계로 주어지는가? (단,R1과 R2는 저항을 나타내며 A1과 A2는 단면적이다.)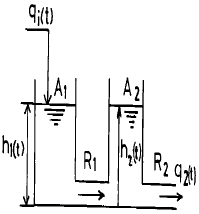
6과목: 화학공업개론
101. 반도체공정 중 감광되지 않은 부분을 선택적으로 제거하는 공정을 무엇이라하는가?
- 조립
- 에칭
- 박막형성
- 이온주입
102. 이온전도성 산화물을 전해질로 이용하여 고온으로 운전하는 연료전지(fuel cell)는?
- Phosphoric acid fuel cell
- Solid oxide fuel cell
- Molten carbonate fuel cell
- Solid polymer fuel cell
103. 공업적 접촉개질 프로세스중 MoO3 - Al2O3계 촉매를 사용하는 것은?
- Platforming
- Houdriforming
- Ultraforming
- Hydroforming
104. 분자량이 1.0× 104 g/mol인 고분자 100g과 분자량 2.5×104 g/mol인 고분자 50g, 그리고 분자량 1.0× 105 g/mol인 고분자 50g이 혼합되어 있다. 이 고분자물질의 수평균 분자량은?
- 16,000
- 28,500
- 36,250
- 57,000
105. 순도가 90%인 황산암모늄이 100kg이 있다. 이 중 질소의 함량은 백분율로 몇 kg이 되는가? (단, 황산암모늄의 MW=132, 질소의 MW=28 이다.)
- 9.1
- 10.2
- 19.1
- 26.4
106. 이온교환에의해 수처리할때 그 설명이 잘못된 것은?
- 양이온 교환에는 슬폰기를 교환기로 갖는 R-SO3+H+형의 수지를 사용한다.
- 양이온 교환수지는 Na+, Ca2+,를 흡착하여 H+를 방출 한다.
- 음이온 교환수지를 재생 할때는 산으로 세정한다.
- 이온교환은 이온교환수지를 충진한 탑을 통과시켜서 각종 이온을 흡착 제거하는 것이다.
107. 석유의 주성분은 탄화수소로 되어 있으나 산지에 따라 차이가 있다. 탄화수소 이외에 다음에서 가장 많이 불순물로 존재하여 공해문제로 등장되는 것은?
- 산소 화합물
- 질소 화합물
- 황 화합물
- 금속 화합물
108. 다음의 질소질 비료중 흡습성이 강하고 논농사에는 부적합한 비료는?
- NH4Cl
- NH4NO3
- NH2CONH2
- (NH4)2SO4
109. 가성소오다 제조때 격막식 전해조의 양극재료는?
- 수은
- 철
- 흑연
- 구리
110. 반도체 제조과정중에서 식각공정후 행해지는 세정공정에 사용되는 piranha 용액은?
- NH4OH + HF + H2O
- HCl + HF + H2O
- NH4OH + H2O2 + H2O
- HCl + H2O2 + H2O
111. 일반적으로 알코올에 염화슬폰산을 작용시켰을때 얻어지는 최종적 주생성물은?
- R - SO3H
- R - OSO2OH
- R - Cl
- R - SO2Cl
112. 방향족 아민에 정확히 1당량의 황산을 가했을 때의 생성물은?
113. 건식법에 의한 인산제조공정에 대한 설명 중 맞는 것은?
- 인의 농도가 낮은 인광석을 원료로 사용할 수 있다.
- P2O5 85%정도의 고농도 인산은 제조할 수 없다.
- 전기로에서 인의 기화와 산화가 동시에 일어난다.
- 대표적인 건식법은 이수석고법이다.
114. 하루8ton의 염소 가스를 생산하는 공장이 있다. 이 공장에서 하루동안 얻어지는 NaOH의 량은 몇 ton인가? (단, Na = 23, Cl = 35.5, O = 16, H = 1)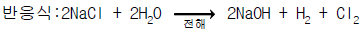
- 5.5ton
- 7.8ton
- 9.0ton
- 14.3ton
115. 다음중 석유류중의 불순물(황,질소,산소)제거에 사용되는 방법은?
- Hydroforming process
- Visbreaking process
- Hydrotreating process
- Platforming process
116. 다음 중 슬폰산화가 되기 쉬운 것은?
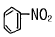
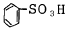
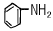
- RH
117. 다음 중 다니엘 전지의 부극(-)에서 일어나는 반응은?
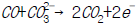
- Zn→Zn2++2e-
- Cu2+2e-→Cu
- H2→2H++2e-
118. 양이온 중합에 사용되는 개시제(촉매)는?
- 수소산
- 알칼리 금속
- 알핀 촉매
- 과산화물
119. 나트륨 이용율을 높이고,폐기되는 염소의 효율적 이용등에 착안하여 소오다회와 염화암모늄을 동시에 생산하는 제조방법은?
- Le Blanc법
- Sesqui 탄산소오다법
- 염안 소오다법
- 액안 소오다법
120. Solvay법(암모니아 소다법)에서 암모니아를 회수하기 위해서 사용되는 것은?
- Ca(OH)2
- Ca(NO3)2
- NaHSO4
- NaHCO3






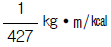 는 열전도율을 나타내는 값이며, 열의 일당량과는 직접적인 연관이 없다.
는 열전도율을 나타내는 값이며, 열의 일당량과는 직접적인 연관이 없다. 
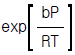
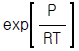

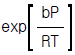 "이다.
"이다.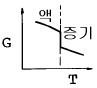

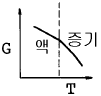
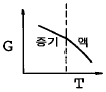
 " 이다. 이유는 G는 T와 P에 의존하는데, 액체에서 증기로 바뀌는 과정은 정압 경로를 따르므로 P는 일정하다. 따라서 G는 T에 대해 일정한 기울기를 가지는 직선 그래프가 된다.
" 이다. 이유는 G는 T와 P에 의존하는데, 액체에서 증기로 바뀌는 과정은 정압 경로를 따르므로 P는 일정하다. 따라서 G는 T에 대해 일정한 기울기를 가지는 직선 그래프가 된다.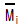 = 0
= 0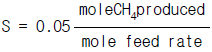
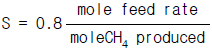
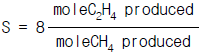
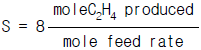
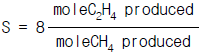 "이다. 이유는 위에서 계산한 것과 같이 methane에 대한 ethylene의 selectivity가 88.9%이기 때문이다.
"이다. 이유는 위에서 계산한 것과 같이 methane에 대한 ethylene의 selectivity가 88.9%이기 때문이다.


 "이 잘못 표시된 것이다. 이유는 R혼합물의 A성분의 조성은 AG와 DN의 중간값인 50:50이어야 하지만, "
"이 잘못 표시된 것이다. 이유는 R혼합물의 A성분의 조성은 AG와 DN의 중간값인 50:50이어야 하지만, "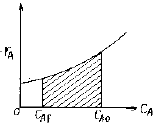

 "이다.
"이다.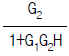
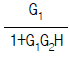
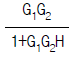
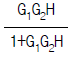
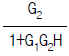 " 이다.
" 이다.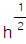 에 비례한다.
에 비례한다.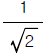 " 이다. 이유는 Corner 주파수에서는 고주파와 저주파의 진폭이 같아지기 때문에 AR이 1이 되어야 한다. 따라서, "
" 이다. 이유는 Corner 주파수에서는 고주파와 저주파의 진폭이 같아지기 때문에 AR이 1이 되어야 한다. 따라서, "
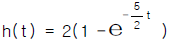
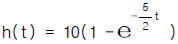
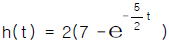
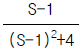
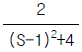
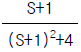

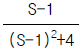
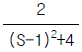
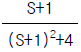
 "이다.
"이다.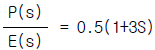
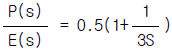

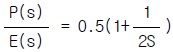
 " 이다.
" 이다. 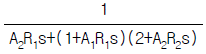
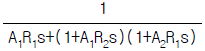
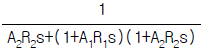
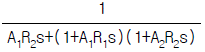
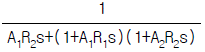 가 정답이다.
가 정답이다.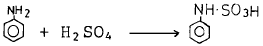
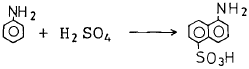
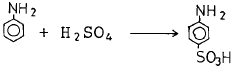
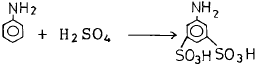
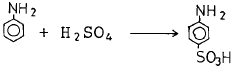 "와 같다. 따라서 정답은 "
"와 같다. 따라서 정답은 " "은 산화력이 강한 화합물인 Fe2O3으로, 따라서 슬폰산화가 되기 쉬운 것이다. 나머지 보기들은 슬폰산화가 되기 어렵거나 불가능한 물질들이다.
"은 산화력이 강한 화합물인 Fe2O3으로, 따라서 슬폰산화가 되기 쉬운 것이다. 나머지 보기들은 슬폰산화가 되기 어렵거나 불가능한 물질들이다.
따라서, A에서 열을 받고 B에서 가열과정을 거쳐 T2보다 높은 온도인 C로 이동한다. 그 후, C에서 열을 방출하면서 F까지 이동하고, F에서 냉각과정을 거쳐 다시 A로 돌아온다.
따라서, 정답은 "A - B - C - F - A" 이다.