1과목: 공업합성
1. 중과린산석회의 제법으로 가장 옳은 설명은?
- 인산을 암모니아로 처리한다.
- 과린산석회를 암모니아로 처리한다.
- 칠레 초석을 황산으로 처리한다.
- 인광석을 인산으로 처리한다.
2. 공업적인 HCl 제조방법에 해당하는 것은?
- 부생염산법
- Petersen Tower법
- OPL법
- Meyer법
3. 석회질소 비료에 대한 설명 중 틀린 것은?
- 토양의 살균효과가 있다.
- 과린산석회, 암모늄염 등과의 배합비료로 적당하다.
- 저장 중 이산화탄소, 물을 흡수하여 부피가 증가한다.
- 분해 시 생성되는 디시안디아미드는 식물에 유해하다.
4. 석유정제에 사용되는 용제가 갖추어야 하는 조건이 아닌 것은?
- 선택성이 높아야 한다.
- 추출할 성분에 대한 용해도가 높아야 한다.
- 용제의 비점과 추출성분의 비점의 차이가 적어야 한다.
- 독성이나 장치에 대한 부식성이 적어야 한다.
5. 말레산 무수물을 벤젠의 공기산화법으로 제조하고자 할 때 사용되는 촉매는?
- V2O5
- PdCl2
- LiH2PO4
- Si-Al2O3 담체로 한 Nickel
6. 전류효율이 90%인 전해조에서 소금물을 전기분해하면 수산화나트륨과 염소, 수소가 만들어진다. 매일 17.75ton 의 염소가 부산물로 나온다면 수산화나트륨의 생산량(ton/day)은?
- 16
- 18
- 20
- 22
7. 초산과 에탄올을 산 촉매 하에서 반응시켜 에스테르와 물을 생성할 때, 물 분자의 산소원자의 출처는?
- 초산의 C=O
- 초산의 OH
- 에탄올의 OH
- 촉매에서 산소 도입
8. 암모니아 산화에 의한 질산제조 공정에서 사용되는 촉매에 대한 설명으로 틀린 것은?
- 촉매로는 Pt에 Rh이나 Pd를 첨가하여 만든 백금계 촉매가 일반적으로 사용된다.
- 촉매는 단위 중량에 대한 표면적이 큰 것이 유리하다.
- 촉매형상은 직경 0.2cm 이상의 선으로 망을 떠서 사용한다.
- Rh은 가격이 비싸지만 강도, 촉매활성, 촉매손실을 개선하는데 효과가 있다.
9. 다음 중 옥탄가가 가장 낮은 가솔린은?
- 접촉개질 가솔린
- 알킬화 가솔린
- 접촉분해 가솔린
- 직류 가솔린
10. 열가소성 플라스틱에 해당하는 것은?
- ABS수지
- 규소수지
- 에폭시수지
- 알키드수지
11. 황산제조에 사용되는 원료가 아닌 것은?
- 황화철광
- 자류철광
- 염화암모늄
- 금속제련 폐가스
12. 650℃에서 작동하며 수소 또는 일산화탄소를 음극연료로 사용하는 연료전지는?
- 인산형 연료전지(PAFC)
- 알칼리형 연료전지(AFC)
- 고체산화물 연료전지(SOFC)
- 용융탄산염 연료전지(MCFC)
13. 반도체 제조과정 중에서 식각공정 후 행해지는 세정공정에 사용되는 piranha 용액의 주원료에 해당하는 것은?
- 질산, 암모니아
- 불산, 염화나트륨
- 에탄올, 벤젠
- 황산, 과산화수소
14. 폐수 내에 녹아있는 중금속 이온을 제거하는 방법이 아닌 것은?
- 열분해
- 이온교환수지를 이용하여 제거
- pH를 조절하여 수산화물 형태로 침전제거
- 전기화학적 방법을 이용한 전해 회수
15. LeBlanc법으로 100% HCl 3000kg을 제조하기 위한 85% 소금의 이론량(kg)은? (단, 각 원자의 원자량은 Na는 23 amu, Cl은 35.5 amu 이다.)
- 3636
- 4646
- 5657
- 6667
16. 레페(Reppe) 합성반응을 크게 4가지로 분류할 때 해당하지 않는 것은?
- 알킬화 반응
- 비닐화 반응
- 고리화 반응
- 카르보닐화 반응
17. 환경친화적인 생분해성 고분자로 가장 거리가 먼 것은?
- 전분
- 폴리이소프렌
- 폴리카프로락톤
- 지방족폴리에스테르
18. 염화수소 가스 42.3kg을 물 83kg에 흡수시켜 염산을 제조할 때 염산의 농도(wt%)는? (단, 염화수소 가스는 전량 물에 흡수된 것으로 한다.)
- 13.76
- 23.76
- 33.76
- 43.76
19. 일반적인 공정에서 에텔렌으로부터 얻는 제품이 아닌 것은?
- 에틸벤젠
- 아세트알데히드
- 에탄올
- 염화알릴
20. 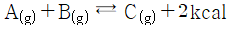 반응에 대한 설명 중 틀린 것은?
반응에 대한 설명 중 틀린 것은?
- 발열반응이다.
- 압력을 높이면 반응이 정방향으로 진행한다.
- 온도을 높이면 반응이 정방향으로 진행한다.
- 가역반응이다.
2과목: 반응운전
21. 평형상태에 대한 설명 중 옳은 것은?
- (dGt)T.P = 1 이 성립한다.
- (dGt)T.P > 0 가 성립한다.
- (dGt)T.P = 0 이 성립한다.
- (dGt)T.P < 0 가 성립한다.
22. 질소가 200atm, 250K로 채워져 있는 10L 기체저장탱크에 5L 진공용기를 두 탱크의 압력이 같아질 때까지 연결하였을 때, 기체저장탱크(T1f)와 진공용기(T2f)의 온도(K)는? (단, 질소는 이상기체이고, 탱크 밖으로 질소 또는 열의 손실을 완전히 무시할 수 있다고 가정하며, 질소의 정압열용량은 7 cal/mol·K 이다.)
- T1f = 222.8, T2f = 330.6
- T1f = 222.8, T2f = 133.3
- T1f = 133.3, T2f = 330.6
- T1f = 133.3, T2f = 222.8
23. 3개의 기체 화학종(N2, H2, NH3)으로 구성된 계에서 아래의 화학반응이 일어날 때 반응계의 자유도는?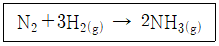
- 0
- 1
- 2
- 3
24. 기체의 평균 열용량(<CP>)과 온도에 대한 2차 함수로 주어지는 열용량(CP)과의 관계식으로 옳은 것은? (단, 열용량은 α + βT + γT2로 주어지며, T0는 초기온도, T는 최종온도, α, β, γ는 물질의 고유상수를 의미한다.)
25. 에탄올과 톨루엔의 65℃에서의 Px 선도는 선형성으로부터 충분히 큰 양(+)의 편차를 나타낸다. 이렇게 상당한 양의 편차를 지닐 때 분자간의 인력을 옳게 나타낸 것은?
- 같은 종류의 분자간의 인력 > 다른 종류의 분자간의 인력
- 같은 종류의 분자간의 인력 < 다른 종류의 분자간의 인력
- 같은 종류의 분자간의 인력 = 다른 종류의 분자간의 인력
- 같은 종류의 분자간의 인력 + 다른 종류의 분자간의 인력 = 0
26. 공기표준 오토사이클의 효율을 옳게 나타낸 식은? (단, a는 압축비, γ는 비열비(CP/Cv)이다.)
27. 열역학적 성질에 대한 설명 중 옳지 않은 것은?
- 순수한 물질의 임계점보다 높은 온도와 압력에서는 상의 계면이 없어지며 한 개의 상을 이루게 된다.
- 동일한 이심인자를 갖는 모든 유체는 같은 온도, 같은 압력에서 거의 동일한 Z값을 가진다.
- 비리얼(Virial) 상태방정식의 순수한 물질에 대한 비리얼 계수는 온도만의 함수이다.
- 반데르 발스(Van der Waals) 상태방정식은 기/액 평형상태에서 3개의 부피 해를 가진다.
28. 아세톤의 부피팽창계수(β)는 1.487×10-3 ℃-1, 등온압축계수(κ)는 62×10-6 atm-1 일 때, 아세톤을 정적하에서 20℃, 1atm부터 30℃까지 가열하였을 때 압력(atm)은? (단, β와 κ의 값은 항상 일정하다고 가정한다.)
- 12.1
- 24.1
- 121
- 241
29. i성분의 부분 몰 성질(partial molar property; 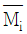 )을 바르게 나타낸 것은? (단, M은 열역학적 용량변수의 단위 몰 당 값, ni은 i성분 이외의 모든 몰 수를 일정하게 유지한다는 것을 의미한다.)
)을 바르게 나타낸 것은? (단, M은 열역학적 용량변수의 단위 몰 당 값, ni은 i성분 이외의 모든 몰 수를 일정하게 유지한다는 것을 의미한다.)
30. 푸개시티(Fugacity)에 관한 설명으로 틀린 것은?
- 일종의 세기(intensive properties) 성질이다.
- 이상기체 압력에 대응하는 실제기체의 상태량이다.
- 순수기체의 경우 이상기체 압력에 퓨개시티 계수를 곱하면 퓨개시티가 된다.
- 퓨개시티는 압력만의 함수이다.
31. 반응물 A가 아래와 같이 반응하고, 이 반응이 회분식 반응기에서 진행될 때, R 물질의 최대 농도(mol/L)는? (단, 반응기에 A 물질만 1.0 mol/L로 공급하였다.)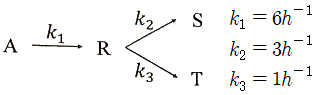
- 0.111
- 0.222
- 0.333
- 0.444
32. A → P 비가역 1차 반응에서 A의 전화율 관련식을 옳게 나타낸 것은?
33. A → R → S인 균일계 액상반응에서 1단계는 2차 반응, 2단계는 1차 반응으로 진행된다. 이 반응의 목적 생성물이 R일 때, 다음 설명 중 옳은 것은?
- A의 농도를 높게 유지할수록 좋다.
- 반응온도를 높게 유지할수록 좋다.
- A의 농도는 R의 수율과 직접 관계가 없다.
- 혼합흐름 반응기가 플러그흐름 반응기보다 더 좋다.
34. 이상기체인 A와 B가 일정한 부피 및 온도의 반응기에서 반응이 일어날 때 반응물 A의 반응속도식(-rA)으로 옳은 것은? (단, PA는 A의 분압을 의미한다.)
35. 반응물 A의 전화율(XA)과 온도(T)에 대한 데이터가 아래와 같을 때 이 반응에 대한 설명으로 옳은 것은? (단, 반응은 단열상태에서 진행되었으며, HR은 반응의 엔탈피를 의미한다.)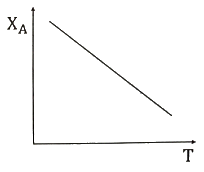
- 흡열반응, △HR < 0
- 발열반응, △HR < 0
- 흡열반응, △HR > 0
- 발열반응, △HR > 0
36. 다음 비가역 기초반응에 의하여 연간 2억 kg 에틸렌을 생산하는데 필요한 플러그흐름 반응기의 부피(m3)는? (단, 공장은 24시간 가동하며, 압력은 8 atm, 온도는 1200K로 등온이며 압력강하는 무시하고, 전화율 90%로 반응한다.)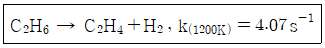
- 2.84
- 28.4
- 42.8
- 82.2
37. 반응물 A의 경쟁반응이 아래와 같을 때, 생성물 R의 순간 수율(øR)은?
38. 플러그흐름 반응기에서 비가역 2차반응에 의해 액체에 원료 A를 95%의 전화율로 반응시키고 있을 때, 동일한 반응기 1개를 추가로 직렬 연결하여 동일한 전화율을 얻기 위한 원료의 공급속도(FA0′)와 직렬 연결 전 공급속도(FA0)의 관계식으로 옳은 것은?
- FA0′ = 0.5FA0
- FA0′ = FA0
- FA0′ = ln2FA0
- FA0′ = 2FA0
39. A와 B의 병렬반응에서 목적생성물의 선택도를 향상시킬 수 있는 조건이 아닌 것은? (단, 반응은 등온에서 일어나며, 각 반응의 활성화에너지는 E1 < E2 이다.)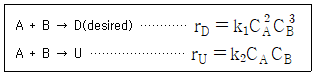
- 높은 압력
- 높은 온도
- 관형반응기
- 반응물의 고농도
40. 혼합흐름 반응기의 다중 정상상태에 대한 설명 중 틀린 것은? (단, 반응은 1차 반응이며, R(T)와 G(T)는 각각 온도에 따른 제거된 열과 생성된 열을 의미한다.)
- R(T)의 그래프는 직선으로 나타낸다.
- 점화-소화곡선에서 도약이 일어나는 온도를 점화온도라 한다.
- 유입온도가 점화온도 이상일 경우 상부 정상상태에서 운전이 가능하다.
- 아주 높은 온도에서는 공식을
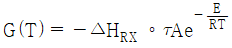 로 축소해서 생성된 열을 구할 수 있다.
로 축소해서 생성된 열을 구할 수 있다.
3과목: 단위공정관리
41. 2개의 관을 연결할 때 사용되는 관 부속품이 아닌 것은?
- 유니온(union)
- 니플(nipple)
- 소켓(socket)
- 플러그(plug)
42. 절대습도가 0.02인 공기를 매분 50kg씩 건조기에 불어 넣어 젖은 목재를 건조시키려 한다. 건조기를 나오는 공기의 절대습도가 0.05일 때 목재에서 60kg의 수분을 제거하기 위한 건조시간(min)은?
- 20.0
- 20.4
- 40.0
- 40.8
43. 8% NaOH 용액을 18%로 농축하기 위해서 21℃ 원액을 내부압이 417 mmHg인 증발기로 4540kg/h 질량 유속으로 보낼 때, 증발기의 총괄열전달계수(kcal/m2·h·℃)는? (단, 증발기의 유효 전열 면적은 37.2m2, 8% NaOH 용액의 417 mmHg에서 비점은 88℃, 88℃에서의 물의 증발잠열은 547 kcal/kg, 가열증기온도는 110℃이며, 액체의 비열은 0.92 kcal/kg·℃로 일정하다고 가정하고, 비점상승은 무시한다.)
- 860
- 1120
- 1560
- 2027
44. 건조장치의 선정에서 고려할 사항 중 가장 중요한 사항은?
- 습윤상태
- 화학포텐셜
- 엔탈피
- 반응속도
45. 분자량이 296.5인 어떤 유체 A의 20℃에서의 점도를 측정하기 위해 Ostwald 점도계를 사용하여 측정한 결과가 아래와 같을 때, A 유체의 점도(P)는?
- 0.13
- 0.17
- 0.25
- 2.17
46. HETP에 대한 설명으로 가장 거리가 먼 것은?
- Height Equivalent to a Theoretical Plate를 말한다.
- HETP의 값이 1m보다 클 때 단의 효율이 좋다.
- (충전탑의 높이 : Z)/(이론 단위수 : N)이다.
- 탑의 한 이상단과 똑같은 작용을 하는 충전탑의 높이이다.
47. 1atm에서 물이 끓을 때 온도 구배(△T)와 열 전달계수(h)와의 관계를 표시한 아래의 그래프에서 핵비등(Nucleate boiling)에 해당하는 구간은?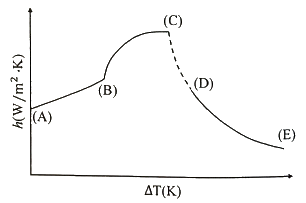
- A-B
- A-C
- B-C
- D-E
48. 확산에 의한 분리 조작이 아닌 것은?
- 증류
- 추출
- 건조
- 여과
49. 레이놀즈수가 300인 유체가 흐르고 있는 내경이 2.5cm 관에 마노메타를 설치하고자 할 때, 관 입구로부터 마노메타까지의 최소 적정거리(m)는?
- 0.158
- 0.375
- 1.58
- 3.75
50. 증류에 대한 설명으로 가장 거리가 먼 것은? (단, q는 공급원료 1몰을 원료 공급단에 넣었을 때 그 중 탈거부로 내려가는 액체의 몰수이다.)
- 최소환류비일 경우 이론단수는 무한대로 된다.
- 포종(bubble-cap)을 사용하면 기액접촉의 효과가 좋다.
- McCabe-Thiele법에서 q값은 증기 원료일 때 0보다 크다.
- Ponchon-Savarit법은 엔탈피-농도 도표와 관계가 있다.
51. Methyl acetate가 아래의 반응식과 같이 고압촉매 반응에 의하여 합성될 때 이 반응의 표준 반응열(kcal/mol)은? (단, 표준연소열은 CO(g) - 67.6 kcal/mol, CH3OCH3(g) -348.8 kcal/mol, CH3COOCH3(g) -397.5 kcal/mol 이다.)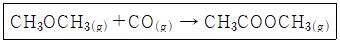
- -18.9
- +28.9
- -614
- +814
52. 기체 A 30vol%와 기체 B 70vol% 기체 혼합물에서 기체 B의 일부가 흡수탑에서 산에 흡수되어 제거된다. 이 흡수탑을 나가는 기체 혼합물 조성에서 기체 A가 80vol%이고 흡수탑을 들어가는 혼합기체가 100mol/h 라 할 때, 기체 B의 흡수량(mol/h)은?
- 52.5
- 62.5
- 72.5
- 82.5
53. 각기 반대 방향의 시속 90km로 운전중인 질량이 10ton인 트럭과 2.5ton인 승용차가 정면으로 충돌하여 두 차가 모두 정지하였을 때, 충돌로 인한 운동에너지의 변화량(J)은?
- 0
- 3.9×106
- 4.3×106
- 5.1×106
54. 순환(recycle)과 우회(bypass)에 대한 설명 중 틀린 것은?
- 순환은 공정을 거쳐 나온 흐름의 일부를 원료로 함께 공정에 공급한다.
- 우회는 원료의 일부를 공정을 거치지 않고, 그 공정에서 나오는 흐름과 합류시킨다.
- 순환과 우회 조작은 연속적인 공정에서 행한다.
- 우회와 순환 조작에 의한 조성의 변화는 같다.
55. 일산화탄소 분자의 온도에 대한 열용량(CP)이 아래와 같을 때, 500℃와 1000℃ 사이의 평균열용량(cal/mol·℃)은?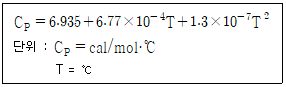
- 0.7518
- 7.518
- 37.59
- 375.9
56. 60℃에서 NaHCO3 포화수용액 10000kg을 20℃로 냉각할 때 석출되는 NaHCO3의 양(kg)은? (단, NaHCO3의 용해도는 60℃에서 16.4g NaHCO3/100gH2O 이고, 20℃에서 9.6g NaHCO3/100gH2O 이다.)
- 682
- 584
- 485
- 276
57. 그림과 같은 공정에서 물질수지도를 작성하려면 측정해야 할 최소한의 변수(자유도)는? (단, A, B, C는 성분을 나타내고 F 흐름은 3성분계, W 흐름은 2성분계, P 흐름은 3성분계이다.)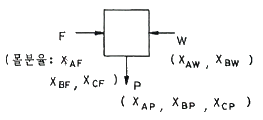
- 3
- 4
- 5
- 6
58. 질소와 산소의 반응과 반응열이 아래와 같을 때, NO 1mol 의 분해열(kcal)은?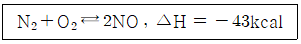
- -21.5
- -43
- +43
- +21.5
59. 연료를 완전 연소시키기 위해 이론상 필요한 공기량을 A0, 실제 공급한 공기량을 A라고 할 때, 과잉공기 %를 옳게 나타낸 것은?
60. 지하 220m 깊이에서부터 지하수를 양수하여 20m 높이에 가설된 물탱크에 15kg/s의 양으로 물을 올릴 때, 위치 에니지의 증가량(J/s)은?
- 35280
- 3600
- 3250
- 205
4과목: 화공계측제어
61. 공정 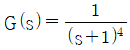 에 대한 PI제어기를 Ziegler-Nichols법으로 튜닝한 것은?
에 대한 PI제어기를 Ziegler-Nichols법으로 튜닝한 것은?
- Kc = 0.5, τI = 2.8
- Kc = 1.8, τI = 5.2
- Kc = 2.5, τI = 6.8
- Kc = 2.5, τI = 2.8
62. 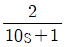 로 표현되는 공정 A와
로 표현되는 공정 A와 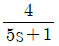 로 표현되는 공정 B에 같은 크기의 계단입력이 가해졌을 때 다음 설명 중 옳은 것은?
로 표현되는 공정 B에 같은 크기의 계단입력이 가해졌을 때 다음 설명 중 옳은 것은?
- 공정 A가 더 빠르게 정상상태에 도달한다.
- 공정 B가 더 진동이 심한 응답을 보인다.
- 공정 A가 더 진동이 심한 응답을 보인다.
- 공정 B가 더 큰 최종 응답 변화 값을 가진다.
63. 연속 입출력 흐름과 내부 가열기가 있는 저장조의 온도제어 방법 중 공정제어 개념이라고 볼 수 없는 것은?
- 유입되는 흐름의 유량을 측정하여 저장조의 가열량을 조절한다.
- 유입되는 흐름의 온도를 측정하여 저장조의 가열량을 조절한다.
- 유출되는 흐름의 온도를 측정하여 저장조의 가열량을 조절한다.
- 저장조의 크기를 증가시켜 유입되는 흐름의 온도 영향을 줄인다.
64. 다음과 같은 블록선도에서 Bode 시스템 안정도 판단에 사용되는 개방회로 전달함수는?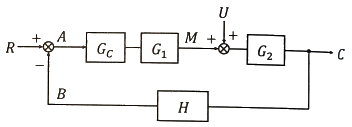
- C/R
- C/U
- G1G2U
- GCG1G2H
65. Smith predictor는 어떠한 공정문제를 보상하기 위하여 사용되는가?
- 역응답
- 공정의 비선형
- 지연시간
- 공정의 상호간섭
66. 동일한 2개의 1차계가 상호작용 없이(non interacting) 직렬연결 되어 있는 계는 다음 중 어느 경우의 2차계와 같아지는가? (단, ξ는 감쇠계수(damping coefficient) 이다.)
- ξ > 1
- ξ = 1
- ξ < 1
- ξ = ∞
67. 특성방정식의 근 중 하나가 복소평면의 우측반평면에 존재하면 이 계의 안정성은?
- 안정하다.
- 불안정하다.
- 초기는 불안정하다 점진적으로 안정해진다.
- 주어진 조건으로는 판단할 수 없다.
68. 블록선도에서 servo problem인 경우 proporitional control(Gc = Kc)의 offset은? (단, TR(t) = U(t) 인 단위계단신호이다.)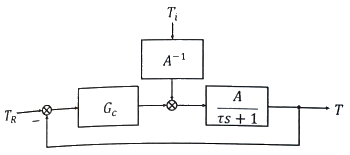
- 0
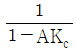
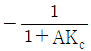
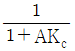
69. 운전자의 눈을 가린 후 도로에 대한 자세한 정보를 주고 운전을 시킨다면 이는 어느 공정제어 기법이라고 볼 수 있는가?
- 앞먹임제어
- 비례제어
- 되먹임제어
- 분산제어
70. 동적계(Dynamic System)를 전달함수로 표현하는 경우를 옳게 설명한 것은?
- 선형계의 동특성을 전달함수로 표현할 수 없다.
- 비선형계를 선형화하고 전달함수로 표현하면 비선형 동특성을 근사할 수 있다.
- 비선형계를 선형화하고 전달함수로 표현하면 비선형 동특성을 정확히 표현할 수 있다.
- 비선형계의 동특성을 선형화하지 않아도 전달함수로 표현할 수 있다.
71. 어떤 계의 단위계단 응답이 아래와 같을 때, 이 계의 단위충격응답(impulse resonse)은?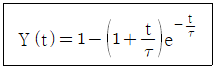
72. 특성방정식에 대한 설명 중 틀린 것은?
- 주어진 계의 특성방정식의 근이 모두 복소평면의 왼쪽 반평면에 놓이면 계는 안정하다.
- Routh test에서 주어진 계의 특성방정식이 Routh array의 처음 열의 모든 요소가 0 이 아닌 양의 값이면 주어진 계는 안정하다.
- 주어진 계의 특성방정식이 S4 + 3S3 - 4S2 + 7 = 0 일 때 이 계는 안정하다.
- 특성방정식이 S3 + 2S2 + 2S + 40 = 0 인 계에는 양의 실수부를 가지는 2개의 근이 있다.
73. 초기상태 공정입출력이 0이고 정상상태일 때, 어떤 선형 공정에 계단 입력 u(t) = 1을 입력했더니, 출력 y(t)는 각각 y(1) = 0.1, y(2) = 0.2, y(3) = 0.4 이었다. 입력 u(t) = 0.5 를 입력할 때 각각의 출력은?
- y(1) = 0.1, y(2) = 0.2, y(3) = 0.4
- y(1) = 0.05, y(2) = 0.1, y(3) = 0.2
- y(1) = 0.1, y(2) = 0.3, y(3) = 0.7
- y(1) = 0.2, y(2) = 0.4, y(3) = 0.8
74. 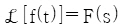 일 때, 최종치 정리를 옳게 나타낸 것은?
일 때, 최종치 정리를 옳게 나타낸 것은?
75. 다음 중 ATO(Air-To-Open) 제어밸브가 사용되어야 하는 경우는?
- 저장 탱크 내 위험물질의 증발을 방지하기 위해 설치된 열교환기의 냉각수 유량 제어용 제어밸브
- 저장 탱크 내 물질의 응고를 방지하기 위해 설치된 열교환기의 온수 유량 제어용 제어밸브
- 반응기에 발열을 일으키는 반응 원료의 유량 제어용 제어밸브
- 부반응 방지를 위하여 고온 공정 유체를 신속히 냉각시켜야 하는 열교환기의 냉각수 유량 제어용 제어밸브
76. 복사에 의한 열전달 식은 q = σAT4 으로 표현된다. 정상상태에서 T = Ts 일 때 이 식을 선형화하면? (단, σ와 A는 상수이다.)
- σA(T – Ts)
- σATs4(T – Ts)
- 3σATs3(T – Ts)2
- 4σATs3(T – 0.75Ts)
77. 비례제어기를 사용하는 어떤 제어계의 폐루프 전달함수는 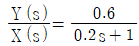 이다. 이 계의 설정치 X에 단위 계단 변화를 주었을 때 offset 은?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
이다. 이 계의 설정치 X에 단위 계단 변화를 주었을 때 offset 은?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- 0.4
- 0.5
- 0.6
- 0.8
78. 나뉘어 운영되고 있던 두 공정을 한 구역으로 통합하여 운영할 때의 경제성을 평가하고자 한다. △Tmin = 20℃로 하여 최대 열교환을 하고, 추가로 필요한 열량은 수증기나 냉각수로 공급한다고 할 때, 필요한 유틸리티와 그 에너지량은? (단, 필요에 따라 Stream은 spilt 할 수 있으며, Ts와 Tt는 해당 STream의 유입온도와 유출온도를 의미한다.)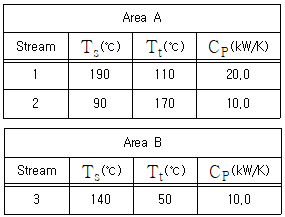
- 냉각수, 10kW
- 냉각수, 30kW
- 수증기, 10kW
- 수증기, 30kW
79. 공정유체 10m3를 담고 있는 완전혼합이 일어나는 탱크에 성분 A를 포함한 공정유체가 1m3/h로 유입되며 또한 동일한 유량으로 배출되고 있다. 공정유체와 함께 유입되는 성분 A의 농도가 1시간을 주기로 평균치를 중심으로 진폭 0.3mol/L로 진동하며 변한다고 할 때 배출되는 A의 농도변화 진폭(mol/L)은?
- 0.5
- 0.05
- 0.005
- 0.0005
80. 제어밸브(Control valve)를 나타낸 것은?






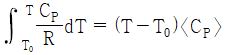
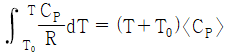
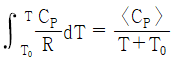
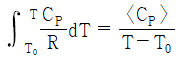
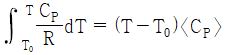 " 인 이유는, 평균 열용량은 열용량이 온도에 따라 변화하는 경우에 사용하는 개념으로, 열용량이 온도에 따라 변화하는 경우에는 평균 열용량이 CP보다 작아지기 때문이다. 따라서, 평균 열용량은 CP보다 작은 값을 가지게 된다.
" 인 이유는, 평균 열용량은 열용량이 온도에 따라 변화하는 경우에 사용하는 개념으로, 열용량이 온도에 따라 변화하는 경우에는 평균 열용량이 CP보다 작아지기 때문이다. 따라서, 평균 열용량은 CP보다 작은 값을 가지게 된다.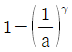
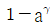
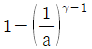
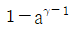
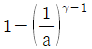 "이다.
"이다.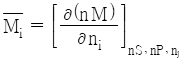
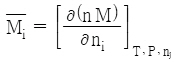
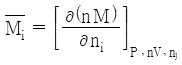
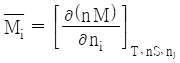
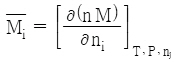 "이다.
"이다.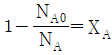
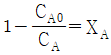
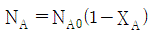
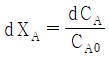
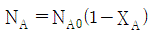 "입니다.
"입니다.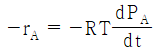
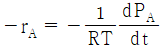
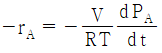
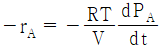
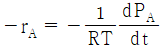 "이다. 이유는 반응물 A의 분압(PA)이 반응속도에 직접적인 영향을 미치는 경우, 일반적으로 반응속도식은 PA의 1차식으로 표현된다. 따라서, "-rA = kPA"와 같은 식으로 표현할 수 있다.
"이다. 이유는 반응물 A의 분압(PA)이 반응속도에 직접적인 영향을 미치는 경우, 일반적으로 반응속도식은 PA의 1차식으로 표현된다. 따라서, "-rA = kPA"와 같은 식으로 표현할 수 있다.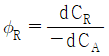
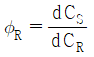
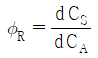
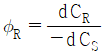
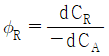 "이다.
"이다.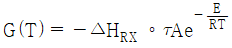 로 축소해서 생성된 열을 구할 수 있다." 이 설명이 틀린 것은 아니다. 이유는 1차 반응에서 생성된 열은 온도에 비례하므로, 아주 높은 온도에서는 R(T)가 G(T)보다 훨씬 크기 때문에 G(T)를 무시할 수 있고, 따라서 공식을
로 축소해서 생성된 열을 구할 수 있다." 이 설명이 틀린 것은 아니다. 이유는 1차 반응에서 생성된 열은 온도에 비례하므로, 아주 높은 온도에서는 R(T)가 G(T)보다 훨씬 크기 때문에 G(T)를 무시할 수 있고, 따라서 공식을 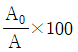
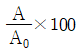
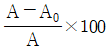
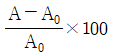
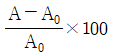 "입니다.
"입니다.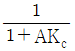 "가 정답이다.
"가 정답이다.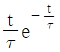
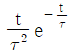
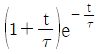
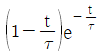

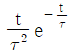 "이다.
"이다.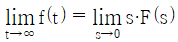
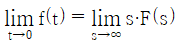
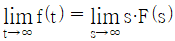
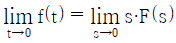
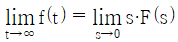 "입니다.
"입니다.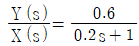 이므로 Kp = 0.4이다.
이므로 Kp = 0.4이다. 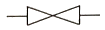
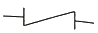

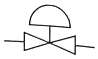
 "가 제어밸브를 나타내는 것은 밸브의 형태와 기능이 가장 잘 표현되어 있기 때문입니다. 이 밸브는 유체의 유동을 조절하는 기능을 가지고 있으며, 밸브의 크기와 형태에 따라 다양한 용도로 사용됩니다.
"가 제어밸브를 나타내는 것은 밸브의 형태와 기능이 가장 잘 표현되어 있기 때문입니다. 이 밸브는 유체의 유동을 조절하는 기능을 가지고 있으며, 밸브의 크기와 형태에 따라 다양한 용도로 사용됩니다.