1과목: 일반화학
1. 질량 백분율(mass percentage)을 옳게 나타낸 것은?
2. 아레니우스의 정의에 따른 산가 염기에 대한 설명 중 옳지 않은 것은?
- 산이란 물에 녹였을 때 하이드로늄이온(H3O+)의 농도를 순수한 물에서보다 증가시키는 물질이다.
- 염기란 물에 녹였을 때 수산화이온(OH-)의 농도를 순수한 물에서보다 증가시키는 물질이다.
- 19세기에 도입된 이 정의는 잘 알려진 산/염기와 화학적으로 유사한 화합물에는 적용되지 않는다.
- 순수한 물에는 적지만 같은 양의 수소이온(H+)과 수산화이온(OH-)이 존재한다.
3. 주기율표에 근거하여 제시된 다음의 설명 중 틀린 것은?
- NH3가 PH3보다 물에 더 잘 녹는 이유는 PH3와 달리 NH3가 수소결합을 할 수 있기 때문이다.
- 수용액 조건에서 HF, HCI, HBr, HI 중 가장 강산은 HI 이다.
- C는 O보다 전기음성도가 더 크므로 O-H결합보다 C-H결합이 더 큰 극성을 띠게 된다.
- Na와 Cl은 공유결합을 통해 분자를 형성하지 않는다.
4. 다음 유기물의 명명법 중 틀린 것은?
- CH3COOH : 아세트산
- HOOCCOOH : 옥살산
- CCI2F2 : 클로로플루오르 메탄
- CH2=CHCI : 염화비닐
5. 다음 중 밑줄 친 물질의 용해도가 증가하는 것은?
- 기체용질이 녹아있는 용기의 부피를 증가시킨다.
- 황산나트륨(Na2SO4)이 녹아있는 수용약의 온도를 60℃ 정도로 약간 올려준다.
- 황산비륨(BaSO4)이 들어있는 수용액에 NaCI을 소량 첨가한다.
- 염화칼륨(KCI) 포화용액을 냉장고에 넣는다.
6. 다음 중 알코올에 대한 설명으로 틀린 것은?
- 일반적으로 탄소의 개수가 작은 경우 극성이다.
- 작용기는 -OR (R은 알킬기)이다.
- 수소결합을 할 수 있다.
- 분자량이 비슷한 다른 유기분자보다 일반적으로 끓는점이 높다.
7. 525℃에서 다음 반응에 대한 평형상수 K 값은 3.35 × 10-3이다. 이 때 평형에서 이산화탄소 농도를 구하면 얼마인가?
- 0.84 × 10-3mol/L
- 1.68 × 10-3mol/L
- 3.35 × 10-3mol/L
- 6.77 × 10-3mol/L
8. 주기율표에서의 일반적인 경향으로 옳은 것은?
- 원자 반지름은 같은 족에서는 위로 올라갈수록 증가한다.
- 원자 반지름은 같은 주기에서는 오른쪽으로 갈수록 감소한다.
- 금속성은 같은 주기에서는 오른쪽으로 갈수록 증가한다.
- 18족(0족)에서는 금속성 물질만 존재한다.
9. 산-염기에 대한 Brønsted-Lowry의 모델을 설명한 것 중 가장 거리가 먼 것은?
- 산은 양성자(H+ 이온)주개이다.
- 염기는 양성자(H+ 이온)받개이다.
- 염기에서 양성자가 제거된 화학종을 짝염기라고 한다.
- 산염기 반응에서 양성자는 산에서 염기로 이동된다.
10. 같은 질량의 산소분자와 메탄올에 들어있는 산소 원자 수의 비는?
- 산소 : 메탄올 = 5:1
- 산소 : 메탄올 = 2:1
- 산소 : 메탄올 = 1:2
- 산소 : 메탄올 = 1:1
11. Ca(HCO3)2에서 탄소의 산화수는 얼마인가?
- +2
- +3
- +4
- +5
12. 티오시아네이트(Thiocyanate) 이온(SCN-)의 가장 적합한 Lewis 구조는?
13. 배의 철 표면이 녹스는 것을 방지하기 위하여 종종 마그네슘 판을 붙인다. 이 작업을 하는 이유는?
- 마그네슘이 철보다 더 좋은 산화제이므로 마그네슘이 더 산화되기 쉽다.
- 마그네슘이 철보다 더 좋은 산화제이므로 마그네슘이 더 환원되기 쉽다.
- 마그네슘이 철보다 더 좋은 환원제이므로 마그네슘이 더 산화되기 쉽다.
- 마그네슘이 철보다 더 좋은 환원제이므로 마그네슘이 더 환원되기 쉽다.
14. 아세톤의 다른 명칭으로서 옳은 것은?
- dimethylketone
- 1-propanone
- propanal
- methylethylketone
15. 산소가 20mol%, 질소가 30mol%, 수소가 50mol%로 구성된 기체 혼합물의 평균 분자량은 얼마인가?
- 8.3g/mol
- 15.8g/mol
- 28.5g/mol
- 37.6g/mol
16. 헬륨의 원자량은 4.0 이다. 헬륨원자 1g속에 들어있는 원자의 개수는 몇 개인가?
- 1.5×1023개
- 6.02×1023개
- 2.4×1024개
- 4.8×1024개
17. 아보가드로의 수에 대한 설명 중 옳지 않은 것은?
- 아보가드로의 수는 일반적으로 6.02×1023이다.
- 아보가드로의 수는 정확히 12g에 존재하는 12C 원자의 숫자로 정의한다.
- 12C원자 한 개의 질량은 1.99×10-24g이다.
- 아보가드로수는 실험실에서의 거시적질량과 개별원자와 분자들의 미시적 질량 사이의 관련성을 확립하기 위한 것이다.
18. 다음 두 반응의 평형상수 K값은 온도가 증가하면 어떻게 되는가?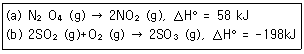
- (a), (b) 모두 증가
- (a), (b) 모두 감소
- (a) 증가, (b) 감소
- (a) 감소, (b) 증가
19. 0.10M NaCI 용액 20mL에 0.20M AgNO3 용액 20mL를 첨가하였다. 이 때 생성되는 염 AgCI의 용해도(g/L)는? (단, AgCI의 Ksp=1.0 × 10-10 분자량은 143이다.)
- 1.21 × 10-7 g/L
- 2.86 × 10-7 g/L
- 1.00 × 10-5 g/L
- 1.43 × 10-3 g/L
20. C6H14의 분자식을 가지는 화합물은 몇 가지 구조이성질체가 가능한가?
- 3
- 4
- 5
- 6
2과목: 분석화학
21. 13.58g의 tris(hydroxymethyl) aminomethane(분자량=121.14)와 5.03g의 tris hydrochloride(분자량=157.60)를 혼합한 수용액 1.00L에 1.00M염산 10.0mL을 첨사하였을 때의 pH는 약 얼마인가? (단, tris 짝산의 pKa = 8.072이다.)
- 7.43
- 7.85
- 8.46
- 9.27
22. 산-염기 적정에서 사용하는 지시약이 용액속에서 다음과 같이 해리한다고 한다. 만일 이 용액에 산을 첨가하여 용액의 액성을 산성이 되게 했다면 용액의 색깔은 어느 쪽으로 변화하는가?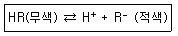
- 적색
- 무색
- 적색과 무색이 번갈아 나타난다.
- 알 수 없다.
23. EDTA 적정에 사용되는 xylenol orange 와 같은 금속이온 지시약의 일번적인 특징의 아닌 것은?
- pH 에 따라 색이 다소 변한다.
- 산화-환원제로서 전위(potential)에 따라 색이 다르다.
- 지시약은 EDTA 보다 약하게 금속과 결합해야만 한다.
- 금속이온과 결합하면 색깔이 변해야 한다.
24. pka가 5인 약산(HA) 1M 용액의 pH에 가장 가까운 것은?
- 2.3
- 2.5
- 3.0
- 3.3
25. 0.1M KNO3 와 0.05M Na2SO4 된 혼합용액의 이온세기는 얼마인가?
- 0.2
- 0.25
- 0.3
- 0.35
26. 산해리 상수(acid dissociation constant)에 관한 설명으로 틀린 것은?
- HA ⇄ H++A-의 평형상수에 해당한다.
- HA + H2O⇄ H3O++A-의 평형상수에 해당한다.
 로 표현될 수 있다.
로 표현될 수 있다.- 산의 농도를 묽히면 산해리 상수는 작아진다.
27. 다음 염(salt)돌 중에서 물에 녹았을 떄, 염기성 수용액을 만드는 염을 모두 나타낸 것은?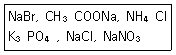
- CH3COONa, K3PO4
- CH3COONa
- NaBr, CH3COONa,NH4Cl
- NH4Cl, K3PO4, NaNO3
28. 미지시료 내의 특정 물질의 양을 분석하는 방법으로 적정이 사용된다. 적정의 요건으로 틀린 것은?
- 부반응이 없어야 한다.
- 반응이 진행되어 당량점부근에서 완결되어야 한다.
- 반응은 화학양론적이어야 한다.
- 적정에서의 반응은 느려도 크게 상관없다.
29. 분석물질이 EDTA를 가하기 전에 침점물을 형성하거나 적정조건에서 EDTA와 느리게 반응하거나, 지시약을 가로막는 분석물을 적합한 EDTA 적정법은?
- 직접적정
- 치환적정
- 간접적정
- 역적정
30. 용해도곱 상수와 공통이온 효과에 대한 설명으로 틀린 것은?
- 용해도곱 상수는 용해반응의 평형상수이다.
- 용해도곱이 클수록 잘 녹는다.
- 고체염이 용액 내에서 녹아 성분 이온으로 나누어지는 반응에 대한 평형 상수이다.
- 성분 이온들 중의 같은 이온하나가 이미 용액 중에 들어 있으면 공통이온효과로 인해 그 염은 잘 녹는다.
31. 이온 선택 전극에 대한 설명으로 옳은 것은?
- 이온 선택 전극은 착물을 형성하거나 형성하지 않은 모든 상태의 이온을 측정하기 떄문에 pH값에 관계없이 일정한 측정 결과를 보인다.
- 금속 이온에 대한 정량적인 분석 방벙 중 이온 선택 전극 측정 결과와 유도 결합 플라즈마 결합결과는 항상 일치한다.
- 이온 선택 전극의 선택 계수가 높을수록 다른 이온에 의한 방해가 크다.
- 액체 이온선택전극은 일반적으로 친수성 막으로 구성되어 있으며 친수성 막 안에 소수성 이온 운반체가 포함되어 있다.
32. 산화ㆍ환원 적정에서 사용되는 KMnO4에 대한 설명으로 틀린 것은?
- 진한 자주색을 띤 산화제이다.
- 매우 안정하여 일차표준물질로 사용된다.
- 강한 산성용액에서 무색의 Mn2+로 환원된다.
- 산성용액에서 자체지시약으로 작용한다.
33. 많은 종류의 이온성 침전물을 사용하여 무게분석을 할 때 순수한 물 대신에 전해질 용액으로 침전물을 세척하는 주된 이유는?
- 표면전하를 중화시켜 침전 입자들의 표면에 반발력 때문에 생기는 풀림 현상을 방지한다.
- 침전 형성 시 내포된 불순물들을 효과적으로 제거한다.
- 불순물 화학종이 침전되는 것은 방지하는 가림제의 역할을 한다.
- 전해질 환경에서 입자의 삭임과정이 촉징된다.
34. 1atm 의 값과 가장 거리가 먼 것은?
- 101.325KPa
- 1013mbar
- 760mmHg
- 14.7N/m2
35. 성분이온 중 한 가지 이상인 용액 중에 들어있는 경우 그 염의 용해도가 감소하는 현상을 공통이온 효과라고 한다. 다음 중 공통이온 효과와 가장 관련이 있는 원리 또는 법칙은?
- 비어(Beer)의 법칙
- 패러데이(Faraday) 법칙
- 파울리(Pauli)의 배타원리
- 르 샤틀리에 (Le Chatelier) 원리
36. 다음 염 중 용액의 pH를 낮추었을 떄 용해도가 증가하지 않는 것은?
- AgBr
- CaCO3
- BaC2O4
- Mg(OH)2
37. 전기화학 반응에 대한 설명 중 틀린 것은?
- 환원반응이 일어나는 전극을 개소드전극(cathode electrode)이라 하며, 갈바니 전지에서는 (-) 극이 된다.
- 염다리(salt bridge)에서는 전류가 이온의 이동에 의해서 흐르게 된다.
- 반쪽전지의 전위를 나타내는 값으로 표준환원전위를 나타내는 값으로 표준환원전위를 사용하며, 표준수소전극의 전위는 0.000V 이다.
- 전극반응의 전압은 Nernst식으로 표시되며, 갈바니 전지에서는 표준환원전위가 큰 반쪽반응의 전극이(+) 극이 된다.
38. 완층용액에 대한 설명 중 옳은 것으로만 모두 나열된 것은?
- ㉢
- ㉠, ㉡
- ㉠, ㉢
- ㉠, ㉡, ㉢
39. 국제단위계(SI)의 기본단위가 아닌 것은?
- 줄(J)
- 킬로그램(Kg)
- 초(s)
- 몰(mol)
40. 이온세기와 활동도, 활동도 계수에 대한 설명으로 옳은 것은?
- 활동도 계수의 단위는 mol/L 이다.
- 이온의 전화가 커질수록 활동도 보정은 필요없게 된다.
- 일반적으로 이온세기가 증가할수록 활동도 계수는 감소한다.
- 활동도 계수는 이온이 갖는 전하크기에 무관하다.
3과목: 기기분석I
41. FTIR(Fourier Transform Infrared; FT 적외선) 분광기기를 사용하여 측정한 흡광도 스펫트럽의 신호대 잡음비(signal-to-noise)가 4이었다. 신호대 잡음비를 20으로 증가시키려면 스펙트럼을 몇 번 측정하여 평균해야 하는가?
- 400
- 80
- 25
- 20
42. 인광이 발생하는 조건으로 가장 옳은 것은?
- 들뜬 단일항 상태에서 바닥상태로 되돌아 올 때
- 바닥 단일항 상태에서 들뜬 바닥상태로 되돌아 올 때
- 바닥 삼중항 상태에서 들뜬 단일항 상태로 되돌아 올 때
- 들뜬 삼중항 상태에서 바닥 단일항 상태로 되돌아 올 때
43. X선을 발생시키는 방법이 아닌 것은?
- 글로우 방전등에서 이온화된 아르곤이온의 충돌에 의해서
- 일차 X선에 물질을 노출시켜서 방사성 동위원소의 붕괴 과정에 의해서
- 방사성 동위원소의 붕괴 과정에 의해서
- 고에너지 전자살로 금속 과녁을 충돌시켜서
44. 원자분광법에서 고체 시료를 원자화하기위해 도입하는 방법은?
- 기체 분무기
- 글로우 방전
- 초음파 분무기
- 수소화물 생성법
45. NMR분광법에서 할로겐화 메틸(Ch3X)의 경우에 양성자의 화학적 이동 값(δ)이 가장 큰 것은?
- CH3Br
- CH3Cl
- CH3F
- CH3l
46. 다음 그래프와 같은 적외선 흡수스펙트럼을 나타낼 수 있는 화합물을 추정하였을 때 가장 적합한 것은?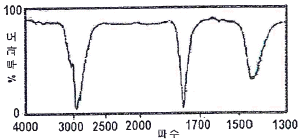
47. 불꽃 및 전열법과 비교한 ICP 원자화 방법의 특징에 대한 설명으로 틀린 것은?
- 하나의 들뜸 조건에서 대부분 원소들의 좋은 방출스펙트럼을 얻을 수 있다.
- 원소 상호간의 화학적 방해가 적다.
- 저렴한 장비를 사용하고 유지비가 적게 든다.
- 텅스텐, 우라늄, 지르코늄 같은 원소들의 낮은 농도를 측정할 수 있다.
48. 파장 500nm의 가시 복사선의 광자에너지는 약 몇 kJ/mol인가? (단, h=6.63×-34Jㆍs)
- 226 kJ/mol
- 239 kJ/mol
- 269 kJ/mol
- 300 kJ/mol
49. 원자 흡수분광법에서의 방해 중 스펙트럼 방해는 화학종의 흡수띠 또는 방출선이 분석선에 가까이 있거나 겹쳐서 발생한다. 스펙트럼 방해에 대한 설명으로 틀린 것은?
- 넓은 흡수띠를 갖는 연소생성물 또는 빛을 산란시키는 입자생성물이 존재할 때 발생한다.
- 시료 매트릭스에 의해 흡수 또는 산란될 때 발생한다.
- 낮은 휘발성 화합물 생성, 해리반응, 이온화와 같은 평형상태에서 발생한다.
- 스펙트럼 방해를 보정하는 방법에는 두선 보정법, 연속 광원 보정법, Zeeman 효과에 의한 바탕보정 등이 있다.
50. 투광도가 0.010인 용액의 흡광도는 얼마인가?
- 0.398
- 0.699
- 1.00
- 2.00
51. ㉮직경이 5.0cm이고 초점거리가 15.0인 렌즈 A의 스피드(f-number)와 ㉯직경이 30.0cm 이고 초점거리가 15.0cm인 렌즈 B의 스피드를 계산하고, ㉰이 둘의 집광력을 비교한 것은?
- ㉮ F=0.3 ㉯ FB=2 ㉰ A가 B보다 6.7배 집광력이 좋다.
- ㉮ F=0.3 ㉯ FB=2 ㉰ B가 A보다 6.7배 집광력이 좋다.
- ㉮ F=3.0 ㉯ FB=0.5 ㉰ A가 B보다 36배 집광력이 좋다.
- ㉮ F=3.0 ㉯ FB=0.5 ㉰ B가 A보다 36배 집광력이 좋다.
52. 자외선-가시선 흡수 분광법에서 사용하는 파장범위는?
- 0.1~100Å
- 10~180nm
- 190~800nm
- 0.78~300μm
53. 전형적인 분광기기의 구성장치가 아닌 것은?
- 안정적인 복사에너지 광원
- 시료 및 표준용액의 자동 이송장치
- 제한된 스펙트럼 영역을 제공하는 장치
- 복사에너지를 신호로 변환시키는 복사선 검출기
54. 자외선-가시선 흡수분광법에서 일반적으로 사용되는 광원의 종류가 아닌 것은?
- 증수소 및 수소 등
- 텅스텐 필라멘트 등
- 크세논 아크 등
- 전극없는 방전 등
55. 다음 어떤 경우에 원자가 가시광선 및 자외선 빛을 방출하는가?
- 전자가 낮은 에너지 준위에서 높은 에너지 준위로 뛸 때
- 원자가 기체에서 액체로 응축될 때
- 전자가 높은 에너지 준위에서 낮은 에너지 준위로 뛸 때
- 전자가 바닥상태에서 원자 궤도함수 안을 돌아다닐 때
56. 정량분석 시 반드시 필요한 표준몰 검정법 중 매트릭스 효과가 있을 가능성이 있는 복잡한 시료를 분석할 때 특히 유용한 방법은?
- 검정곡선법
- 표준물첨가법
- 작업곡선법
- 내부표준물법
57. l2 에탄올(CH3CH2OH)에 용해시켜 밀도가 0.8g/cm3인 용액을 제조하였다. 이 용액을 폭이 1.5cm인 셀에 넣고 Mo의 Ka 광원의 복사선을 투과시키니, 그 투과도가 25.0%였다. I, C, H, O의 각각의 질량흡수계수(cm2/g)가 차례로 39.0, 0.70, 0.00, 0.50이라 할 때 이 용액의 l2함량을 구한 결과 가장 근사치인 것은? (단, 용매에 의한 흡수도는 매우 낮으므로 무시한다.)
- 0.65%
- 1.05%
- 1.3%
- 3.6%
58. 에틸알콜의 NMR 스펙트럼에서 메틸기의 다중선 수는?
- 1개
- 2개
- 3개
- 4개
59. 다음 중 NMR 용매로 가장 적합한 것은?
- H2O
- CCl4
- HCl
- H2NO3
60. 원자 방출분광법의 유도쌍플라스마 광원에 대한 설명으로 틀린 것은?
- 광원은 헬륨 기체가 주로 이용된다.
- 전형적인 광원은 3개의 동심원통형 석영관으로 되어 있는 토치구조이다.
- 시료 도입 방법은 일반적으로 집중 유리 분무기를 사용한다.
- 플라스마 속으로 고체와 액체 시료를 도입하는 방법으로 전열증기화가 있다.
4과목: 기기분석II
61. 전기분해전지에서 구리가 석출되게 하였다. 1.0A의 일정한 전류를 161분 동안 흐르게 하였다면 생성물의 양은 약 몇 g인가? (단, 구리의 원자량은 64g/mol이다.)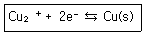
- 1.6g
- 3.2g
- 6.4g
- 12.8g
62. 고성능 액체크로마토그래피에서 사용되는 컬럼에 대한 설명으로 틀린 것은?
- 용리액 세기가 증가할수록 용질은 컬럼으로부터 더욱 빨리 용리된다.
- 액체크로마토그래피에서는 열린관 컬럼이 적당하다.
- 정지상 입자의 크기가 작을수록 충전컬럼의 효율은 증가한다.
- 컬럼의 온도를 높이면 머무름 시간이 감소되고, 분리도를 향상시킬 수 있다.
63. 액체크로마토그래피에서 기울기용리(gradient elution)란 어떤 방법인가?
- 컬럼을 기울여 분리하는 방법
- 단일 용매(이동상)를 사용하는 방법
- 2개 이상의 용매(이동상)를 다양한 혼합비로 섞어 사용하는 방법
- 단일 용매(이동상)의 흐름량과 흐름속도를 점차 증가시키는 방법
64. 연산 증폭기(operational amplifier) 회로를 사용하여 작업전극에 흐르는 전류(current)신호를 전압(voltage) 신호로 변환시켜 측정하고자 한다. 가장 적절한 회로는?
65. 얇은 층 크로마토그래피(TLC)에서 지연인자(Rf)에 대한 설명으로 틀린 것은?
- 단위가 없다.
- 0~1사이의 값을 갖는다.
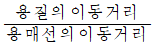 로 나타낸다.
로 나타낸다.- Rf 값은 용매와 온도에 따라 같은 값을 가진다.
66. 2-hexanone의 질량분석 토막패턴으로 검출되지 않는 화학종은?
- CH3-C≡O+
- CH3-CH=CH2+
- (CH2)(CH3)C=OH+
- CH3-CH2-CH2-CH2+
67. 중합체 시료를 기준물질과 함께 가열하면서 두 물질의 온도 차이를 나타낸 다음의 시차 열분석도에 대한 설명이 옳은 것으로만 나열된 것은?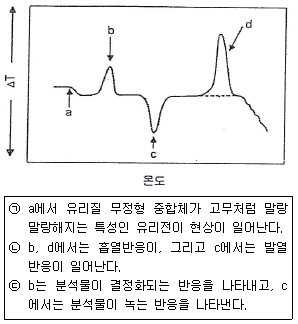
- ㉠, ㉡
- ㉡, ㉢
- ㉠, ㉢
- ㉠, ㉡, ㉢
68. 조절전위 전기분해에서 각각의 기능과 역할에 대한 설명으로 틀린 것은?
- 전류는 대부분 작업 전극과 보조전극 사이에서 흐른다.
- 기준전극에는 무시할 수 있을 만큼 작은 전류가 흐른다.
- 기준전극의 전위는 저항전위, 농도차 분극, 과전위의 영향을 받지 않게 되어 일정한 전위가 유지된다.
- 일정전위기(potentiostat)는 작업, 보조, 기준전극의 전위를 일정하게 하기 위해서 사용한다.
69. 시료의 분해반응 및 산화반응과 같은 물리적 변화 측정에 알맞은 열분석법은?
- DSC
- DTA
- TMA
- TGA
70. 크로마토그래피에서 분류에 대한 설명으로 틀린 것은?
- 고정상 종류에 따라 액체크로마토그래피와 기체크로마토그래피로 분류한다.
- 초임계 유체 크로마토그래피는 분리관법으로 할 수 있다.
- 이온교환 크로마토그래피의 정지상은 이온교환수지이다.
- 액체크로마토그래피는 분리관법 또는 평면법으로 할 수 있다.
71. 질량분석법을 응용한 2차 이온 질량분석법(SIMS)에 대한 설명으로 틀린 것은?
- 고체 표면의 원자와 분자조성을 결정하는데 유용하다.
- 동적 SIMS는 표면 아래 깊이에 따른 조성 정보를 얻기 위하여 사용된다.
- 통상적으로 사용되는 SIMS를 위한 변환기는 전자증배기, 패러데이컵 또는 영상검출기이다.
- 양이온 측정은 가능하나 음이온 측정이 불가능한 분석법이다.
72. 원자질량 분석법에서 원자 이온원(ion source)으로 주로 사용되는 것은?
- Nd-YAG 레이저
- 광 방출 다이오드
- 고온 아르곤 플라스마
- 전자 충격(electron impact)
73. 수소는 물을 전기분해하여 생성시킬 수 있다. 물의 표준생성자유에너지는 △G0f=-237.13kJ/mol이다. 표준조건에서 물을 전기분해할 때 필요한 최소 전압은 얼마인가?
- 0.62V
- 1.23V
- 2.46V
- 3.69V
74. 이온 억제컬럼을 사용하는 이온크로마토 그래피에서 음이온을 분리할 때 사용하는 이동상은 어떤 화학종을 포함하고 있는가?
- NaCl
- NaHCO3
- NaNO3
- Na2SO4
75. 순환 전압전류법(Cyclic voltammetry)에 의해 얻어진 순환 전압전류곡선의 해석에 대한 설명으로 틀린 것은?
- 산화전극과 환원전극의 형태가 대칭성에 가까울수록 전기화학적으로 가역적이다.
- 산화봉우리 전류와 환원봉우리 전류의 비가 1에 가까우면 전기화학 반응은 가역적일 가능성이 높다.
- 산화 및 환원전류가 Nernst식을 만족하면 가역적이며 전기화학반응은 매우 빠르게 일어난다.
- 산화봉우리 전압과 환원봉우리 전압의 차는 가능한 커야 전기화학 반응이 가역적일 가능성이 높다.
76. 기준전극을 사용할 때 주의사항에 대한 설명으로 틀린 것은?
- 전극용액의 오염을 방지하기 위하여 기준전극 내부 용액의 수위가 시료의 수위보다 낮게 유지시켜야 한다.
- 수은, 칼륨, 은과 같은 이온을 정량할 때는 염다리를 사용하면 오차를 줄일 수 있다.
- 기준전극의 염다리는 질산칼륨이나 황산나트륨 같이 전극전위에 방해하지 않는 물질을 포함하면 좋다.
- 기준전극은 셀에서 IR 저항을 감소시키기 위하여 가능한 작업전극에 가까이 위치시킨다.
77. HPLC에 이용되는 검출기 중 가장 널리 사용되는 검출기의 종류는?
- 형광 검출기
- 굴절률 검출기
- 자외선-가시선 흡수 검출기
- 증발 광산란 검출기
78. 아래 그림은 퓨리애변환질량분석기를 이용하여 얻은 Cl3C-CH3Cl(1, 1, 1, 2-사염화에탄)의 스펙트럼이다. 각 스펙트럼의 X-축을 주파수와 질량으로 나타내었다. 여기서 131질량 피크는 35Cl3CCH2 이온 때문에, 133질량 피크는 37Cl35Cl2CCH2 이온 때문에 나타난다. 이 스펙트럼에 대한 설명 중 틀린 것은? (단 동위원소 존재비는 35Cl:37Cl=100:33, 12C:13C=100:1.1, 1H:2H=100:0.02이다.)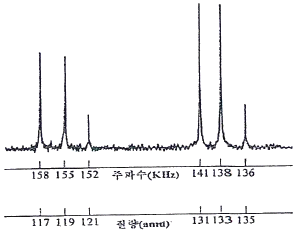
- 135amu 피크는 33Cl75Cl213C13C1H2 이온 때문에 나타난다.
- 117amu 피크는 35Cl3C 이온 때문에 나타난다.
- 119amu 피크는 37Cl35Cl2C 이온 때문에 나타난다.
- 121amu 피크는 37Cl235ClC 이온 때문에 나타난다.
79. 고성능 액체크로마토그래피(HPLC)에서 분석물질의 분리와 머무름 시간을 조절하는 가장 큰 변수는?
- 시료 주입량
- 이동상의 조성
- 이동상의 유량
- 컬럼의 온도
80. 기체크로마토그래피(GC)에서 통상적으로 사용되지 않는 검출기는?
- 열전도도 검출기(TCD)
- 불꽃이온화 검출기(FID)
- 전자포착 검출기(ECD)
- 자외선 검출기(UV detector)






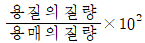



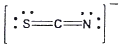
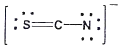

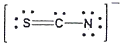
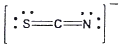 "입니다. 이유는 다음과 같습니다.
"입니다. 이유는 다음과 같습니다.
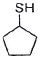
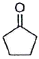 "입니다. 이유는 이중결합을 가진 화합물 중에서 가장 많이 나타나는 흡수선의 위치와 일치하기 때문입니다.
"입니다. 이유는 이중결합을 가진 화합물 중에서 가장 많이 나타나는 흡수선의 위치와 일치하기 때문입니다.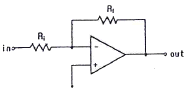
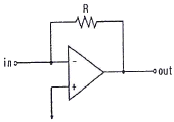

 "이다. 이유는 연산 증폭기는 입력 전압 차이에 따라 출력 전압을 생성하기 때문에 작업전극에 흐르는 전류를 전압으로 변환시키기에 적합하다. "
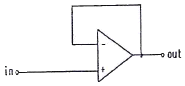
"이다. 이유는 연산 증폭기는 입력 전압 차이에 따라 출력 전압을 생성하기 때문에 작업전극에 흐르는 전류를 전압으로 변환시키기에 적합하다. " "은 비교 연산을 위한 회로이고, "
"은 비교 연산을 위한 회로이고, " "는 반복기능을 가진 회로이다. "
"는 반복기능을 가진 회로이다. " "는 필터 회로이다.
"는 필터 회로이다.
질량 백분율은 용액이나 혼합물에서 각 구성 성분의 질량 비율을 백분율로 나타낸 것이다. 따라서, 각 구성 성분의 질량을 전체 질량으로 나눈 후 100을 곱해주면 된다.
예를 들어, A, B, C 세 가지 성분으로 이루어진 혼합물의 질량 백분율을 구하려면,
A의 질량 백분율 = (A의 질량 ÷ 전체 질량) × 100
B의 질량 백분율 = (B의 질량 ÷ 전체 질량) × 100
C의 질량 백분율 = (C의 질량 ÷ 전체 질량) × 100
따라서, "