1과목: 일반화학
1. 염화칼륨(KCI) 수용액에 질산은(AgNO3) 수용액을 과량으로 가하여 백색 침전이 29.0g 생성되었다. 다음 중 백색 침전의 화학식과 양을 바르게 표기한 것은? (단, 각 원소의 원자량은 Ag:108, N:14, O:16, K:39, CI:35.5이다.)
- KCI, 0.202몰
- KCI, 2.02몰
- AgCI, 0.202몰
- AgCl, 2.02몰
2. 한 수저는 금으로 도금하고, 다른 수저는 구리로 도금하고자 한다. 만약 발전기에서 나오는 일정한 전류를 두 수저를 도금하는데 사용하였다면, 어느 수저에 먼저 1g이 도금되고 그 이유는 무엇인가? (단, 금의 원자량은 197, 구리의 원자량은 63.5이며, 반쪽 환원 반응식은 다음과 같다.)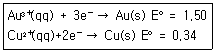
- 금 수저-금의 원자량이 더 크기 때문이다.
- 금 수저-금이 더 많은 전자로 환원되기 때문이다.
- 구리 수저-구리가 기전력으로 더 낮기 때문이다.
- 구리 수저-구리가 더 적은 전자로 환원되기 때문이다.
3. 암모니아를 물에 녹여 0.10M의 용액 1.00L를 만들었다. 이 용액의 OH-의 농도는 1.0×10-3M 이라고 가정할 때, 암모니아의 이온화 평형상수 K는 얼마인가?
- 1.0×10-3
- 1.0×10-4
- 1.0×10-5
- 1.0×10-6
4. 단위가 틀리게 연결된 것은?
- 전하량-coulomb(C)
- 전류-ampere(A)
- 전위(volt)(V)
- 에너지-Watt(W)
5. 다음 알케인의 IUPAC의 이름은 무엇인가?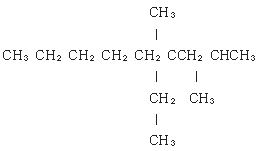
- ethyl-2.4-dimethyloctane
- 2-ethyl-2.4-dimethylnonane
- 4-ethyl-2.4-dimethyloctane
- 4-ethyl-2.4-dimethylnonane
6. 전기화학전지에 관한 패러데이의 연구에 대한 설명 중 옳지 않은 것은?
- 어떤 전지에서나 전극에서 생성되거나 소모된 물질의 양은 전지를 통해 흐른 전하의 양에 반비례한다.
- 일정한 전하량의 전지를 통하여 흐르게 되면 여러 물질들이 이에 상응하는 당량만큼 전극에서 생성되거나 소모된다.
- 페러데이의 법칙은 전기화학 과정에 대한 화학양론을 요약한 것이다.
- 페러데이 상수 F=96.485.37 C/mol이다.
7. 세로토닌은 신경전달물질이다. 세로토닌의 물질량은 176g/mol이다. 5.31g의 세로토닌을 분석하여 탄소 3.62g, 수소 0.362g, 질소 0.844g, 산소 0.482g을 함유한다는 사실을 알았다. 세로토닌의 분자식으로 예상되는 것은?
- C10H12N2O
- C10H26NO
- C11H14NO
- C9H10N3O
8. 화합물 한 쌍을 같은 몰수로 혼합하는 다음 4가지 경우 중 염기성 용액이 되는 경우는 모두 몇 가지인가?
- 4
- 3
- 2
- 1
9. 다음 중 극성 분자가 아닌 것은?
- CCl4
- H2O
- CH3OH
- HCl
10. 메타-다이나이트로벤젠의 구조를 옳게 나타낸 것은?
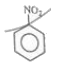
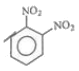
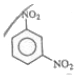
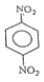 .
.
11. 수용액의 산성도를 나타내는 pH에 대한 설명 중 옳지 않은 것은?
- pH값은 pH=-log10[H3O+]로부터 구할 수 있다.
- pH가 7보다 작은 경우를 산성용액이라 한다.
- 중성용액의 pH는 14이다.
- pH meter를 이용하여 측정할 수 있다.
12. 11.99g의 염산이 녹아있는 5.48M 염산 용액의 부피는 몇 mL인가? (단, 염산의 분자량은 36.45이다.)
- 12.5
- 17.8
- 30.4
- 60.0
13. 다음 작용기에 대한 설명 중 옳지 않은 것은?
- 알코올은 -OH작용기를 가지고 있다.
- 페놀류는 -OH기가 방향족 고리에 직접 붙어 있는 화학물이다.
- 에테르는 -O-로 나타내는 작용기를 가지고 있다.
- 1차 알코올은 -OH기가 결합되어 있는 탄소원자에 다른 탄소원자가 2개 이상 결합되어 있는 것이다.
14. 핵이 분해하여 방사능을 방출하는 방사성 붕괴에 대한 설명으로 틀린 것은?
- 방사성 붕괴는 일반적으로 전형적인 1차 반응 속도식을 따른다.
- 베타 입자는 방사능의 일종으로 헬륨의 핵(nucleus)이다.
- 감마선은 방사능 가운데 유일하게 입자가 아닌 전자기파이다.
- 반감기(half-life)란 방사성 붕괴를 하는 핵종의 수가 처음 값의 반이 되는 데 필요한 시간이다.
15. 전자가 보어모델(Bohr Model)의 n=5 궤도에서 n=3 궤도로 전이할 때 수소원자에서 방출되는 빛의 파장은 얼마인가? (단, 뤼드베리 상수 RH=1.9678×10-2nm-1)
- 434.5bnm
- 486.1nm
- 714.6nm
- 954.6nm
16. 16.0M인 H2SO4 용액 8.00mL를 용액의 최종 부피가 0.125L가 될 때까지 묽혔다면, 묽힌 후 용액의 몰농도는 약 얼마가 되겠는가?
- 102M
- 10.2M
- 1.02M
- 0.102M
17. 기체분자 운동론(kinetic molecular theory)의 기본 가정으로 틀린 것은?
- 기체 입자의 부피는 무시할 수 있다.
- 기체 입자는 계속해서 움직이고 용기의 벽에 입자가 충돌하여 압력이 발생한다.
- 기체 입자들 사이에는 인력이 작용하므로 압력 계산시 고려해야 한다.
- 기체 입자 집합의 평균 운동 에너지는 기체의 절대 온도에 비례한다.
18. 2M NaOH 30mL에는 몇 mg의 NaOH가 존재하는가? (단, Na의 원자량은 23이다.)
- 1200
- 1800
- 2400
- 3600
19. 다음 각 쌍의 2개 물질 중에서 물에 더욱 잘 녹을 것이라고 예상되는 물질을 1개씩 옳게 선택한 것은?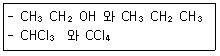
- CH3CH2OH, CHCl3
- CH3CH2OH, CCl4
- CH3CH2CH3, CHCl3
- CH3CH2CH3, CCl4
20. 다음 유기 화합물의 명칭 중 틀린 것은?
- CH2=CH2의 중합체는 폴리스티렌이다.
- CH2=CH-CN의 중합체는 폴리아크릴로니트릴이다.
- CH2=CHOCOCH3의 중합체는 폴리아세트산비닐이다.
- CH2=CHCl의 중합체는 폴리염화비닐이다.
2과목: 분석화학
21. 페러데이 상수는 전류량과 반응한 화합물의 양과의 관계를 알아내는데 사용되는 값으로 96485가 자주 사용되고 있다. 이러한 페러데이 상수의 단위(unit)로 알맞은 것은?
- C/mol
- A/mol
- C/g
- A/g
22. 다음 반응식은 어떠한 평행상태인가?
- 약한 산의 해리
- 약한 염기의 해리
- 착이온의 생성
- 산화-환원 평형
23. 다음 ()안에 가장 적합한 용어는?
- 질산이온(NO3-)
- 암모니아(NH3)
- 황산이온(SO42-)
- 메틸아민(CH3NH2)
24. EDTA에 대한 설명으로 틀린 것은?
- EDTA는 금속이온의 전하와는 무관하게 금속이온과 일정 비율로 결합한다.
- EDTA 적정법은 물의 경도를 측정할 때 사용할 수 있다.
- EDTA는 Li+, Na+, K+와 같이 1가 양이온들 하고만 착물을 형성한다.
- EDTA 적정 시 금속-지시약 착화합물을 금속-EDTA 착화합물보다 덜 안정하다.
25. 아스코브산을 요오드 용액으로 산화-환원 적정할 할 때 주로 사용할 수 있는 지시약은?
- 녹말
- 페놀프탈레인
- 아연 이온
- 리트머스
26. 다음의 증류수 또는 수용액에 고체 Hg2(IO3)2(Ksp=1.3×10-18)를 용해시킬 때, 용해된 Hg22+의 농도가 가장 큰 것은?
- 증류수
- 0.10M KIO3
- 0.20M KNO3
- 0.30M NaIO3
27. 0.850g의 미지시료에는 KBr(몰질량 119g)과 KNO3(몰질량 101g)만이 함유되어 있다. 이 시료를 물에 용해한 후 브롬화물을 완전히 적정하는데 0.0500M AgNO3 80.0mL가 필요하였다. 이 때 고체시료에 있는 KBr의 무게 백분율은?
- 44.0%
- 47.55%
- 54.1%
- 56.0%
28. CaF2의 용해와 관련된 반응식에서 과량의 고체 CaF2가 남아 있는 포화된 수용액에서 Ca2+(qq)의 물농도에 대한 설명으로 옳은 것은? (단, 용해도의 단위는 mol/L이다.)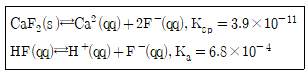
- KF를 첨가하면 몰 농도가 감소한다.
- HCI을 첨가하면 몰 농도가 감소한다.
- KCI을 첨가하면 몰 농도가 감소한다.
- H2O를 첨가하면 몰 농도가 증가한다.
29. 할로겐 음이온을 0.050M Ag+ 수용액으로 적정하였다. AgCl, AgBr, Agl의 용해도곱은 각각 1.8×10-10, 5.0×10-13, 8.3×10-17이다. 당량점이 가장 뚜렷하게 나타나는 경우는?
- 0.05M Cl-
- 0.10M Cl-
- 0.10M Br-
- 0.10M I-
30. 활동도는 용액 중에서 그 화학종이 실제로 작용하는 반응능력을 말한다. 이에 비해 활동도계수는 이온들의 이상적 행동으로부터 벗어나는 정도를 나타낸다. 활동도계수에 대한 설명으로 가장 옳은 것은?
- 활동도계수는 무한히 묽은 용액에서 무한히 작아진다.
- 활동도계수는 공존하는 화학종의 종류보다는 용액의 이온세기에 따라 결정된다.
- 이온의 전하가 커지면 활동도계수가 1로부터 벗어나는 정도가 작아진다.
- 전하를 갖지 않는 중성분자의 활동도계수는 이온세기와는 무관하게 0이다.
31. 황산알루미늄 용액에 여분의 염화바륨을 가하여 0.6978g의 황산바륨 침전을 얻었다. 시료용액에 녹아있는 황산알루미늄의 무게는? (단, 황산알루미늄의 화학식량은 342.23, 황산바륨의 화학식량은 233.4이다.)
- 0.1217g
- 0.3411g
- 0.3651g
- 0.4868g
32. 어떤 유기산 10.0g을 녹여 100mL 용액을 만들면, 이 용액에서는 유기산의 해리도는 2.50%이다. 유기산은 일양성자산이며, 유기산의 Ka가 5.00×10-4이었다면, 유기산의 화학식량은?
- 6.40g/mol
- 12.8g/mol
- 64.0g/mol
- 128g/mol
33. 다음의 지시약에 대한 설명에서 옳은 것만으로 나열된 것은?
- ㉠
- ㉠, ㉡
- ㉡, ㉢
- ㉠, ㉡, ㉢
34. pH 10.00인 100mL 완충용액을 만들려면 NaHCO3(FW84.01)4.00과 몇 g의 Na2CO3(FW105.99)를 섞어야 하는가?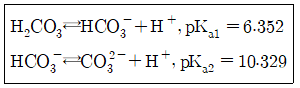
- 1.32g
- 2.09g
- 2.36g
- 2.96g
35. 진한 황산의 무게 백분율 농도는 96%이다. 진한 황산의 물농도는 얼마인가? (단, 진한 황산의 밀도는 1.84kg/L, 황산의 분자량은 98.08g/mol이다.)
- 9.00M
- 12.0M
- 15.0M
- 18.0M
36. 1몰랄(m) 농도 용액에 대한 설명으로 옳은 것은?
- 용액 1000g에 그 용질 1몰이 들어있는 용액
- 용매 1000g에 그 용질 1몰이 들어있는 용액
- 용액 100g에 그 용질 1g이 들어있는 용액
- 용매 1000g에 그 용질 1당량이 들어있는 용액
37. 양성자가 하나인 어떤 산(acid)이 있다. 수용액에서 이 산의 짝산, 짝염기의 평형상수 Ka와 Kb가 존재할 때, 그 관계식으로 옳은 것은? (단, pKω=14.00이라고 가정한다.)
- Ka×Kb=Kω
- Ka/Kb=Kω
- Kb/Ka=Kω
- Ka×Kb×Kω=1
38. Cu(s)+2Ag+⇄Cu2++2Ag(s) 반응의 평형상수 값은 약 얼마인가? (단, 이들 반응을 구성하는 반쪽반응과 표준전극전위는 다음과 같다.)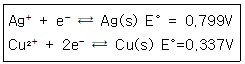
- 2.5×1010
- 2.5×1012
- 4.1×1015
- 4.1×1018
39. 네른스트식은 어떤 양들 사이의 관계식인가?
- 농도, 전위차
- 농도, 삼투압
- 온도, 평형상수
- 엔탈피, 엔트로피, 자유에너지
40. Pbl2(s) ⇄ Pb2+(aq)+2I-(aq)과 같은 용해반응을 나타내고, Ksp는 7.9×10-9일 때 다음 평형반응의 평형상수 값은?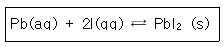
- 7.9×10-9
- 1/(7.9×10-9)
- (7.9×10-9)×1.0×10-4)
- 1.0×10-14)/(7.9×10-9)
3과목: 기기분석I
41. X선 회절법에 대한 설명으로 틀린 것은?
- 1912년 von Laue에 의해 발견되었다.
- 결정성 화합물을 편리하고 실용적으로 정성확인이 가능하다.
- X선 분말(powder) 회절법은 고체에 존재하는 화합물에 대한 정성적인 정보만 제공한다.
- X선 분말 회절법은 각 결정 물질마다 X선 회절 무늬가 톡특하다가는 사실에 기초한다.
42. 기기분석 방법의 정밀도를 나타내는 성능계수 용어가 아닌 것은?
- 평균
- 평균치의 표준편차
- 변동계수(CV)
- 상대표준편차(RSD)
43. 다음 중 전자전이가 일어나지 않는 것은?
- σ-σ+
- π-π+
- n-π+
- σ-π+
44. 아세트산(CH3COOH)의 기준진동방식의 수는?
- 16개
- 17개
- 18개
- 19개
45. 1.41T의 자기장을 걸어주었을 때 수소 핵은 약 몇 MHz의 주파수에 흡수하는가? (단, 질량수가 1인 수소의 자기회전 비는 2.68×108/Tㆍs이다.)
- 30MHz
- 60MHz
- 100MHz
- 600MHz
46. 단색화 장치의 성능을 결정하는 요소로서 가장 거리가 먼 것은?
- 복사선의 순도
- 근접파장 분해능력
- 복사선의 산란효율
- 스펙트럼의 띠 너비
47. 적외선(IR) 흡수 분광법에서 분자의 진동은 신축과 굽힘의 기본범주로 구분된다. 다음 중 굽힘진동의 중류가 아닌 것은?
- 가위질(scissoring)
- 꼬임(twisting)
- 시프팅(shifting)
- 앞뒤 흔듦(wagging)
48. Fourier 변환 적외선 흡수분광기의 장점이 아닌 것은?
- 신호 잡음비 개선
- 일정한 스펙트럼
- 빠른 분석속도
- 바탕보정 불필요
49. 13C NMR의 장점이 아닌 것은?
- 분자의 골격에 대한 정보를 제공한다.
- 봉우리의 겹침이 적다.
- 탄소 간 동종 핵의 스핀-스핀 짝지음이 관측되지 않는다.
- 스핀-격자 이완시간이 길다.
50. 다음 화합물 중 가장 높은 파장의 형광을 나타내는 것은?
- C6H5Br
- C6H5F
- C6H6
- C6H5Cl
51. 적외선분광법에서 한 분자의 구조와 조성에서의 작은 차이는 스펙트럼에서 흡수봉우리의 분포에 영향을 준다. 분자의 성분과 구조에서 특정 기능기에 따라 고유 흡수 파장을 나타내는 영역을 무엇이라 하는가?
- 그룹 영역(group region)
- 원 적외선 영역(far IR region)
- 지문 영역(fingerprint region)
- 근 적외선 영역(near IR region)
52. 인광에 대한 설명으로 틀린 것은?
- 계간전이를 통해서 발생
- 무거운 분자일수록 유리
- 10-4~10초 정도의 평균수명
- 산소와의 충돌이 감소하면 계간전이가 증가
53. 원자흡수분광법과 원자형광분광법에서 기기의 부분 장치 배열에서의 가장 큰 차이는 무엇인가?
- 원자흡수분광법은 광원 다음에 시료잡이가 나오고 원자형광분광법은 그 반대이다.
- 원자흡수분광법은 파장선택기가 광원보다 먼저 나오고 원자형광분광법은 그 반대이다.
- 원자흡수분광법에서는 광원과 시료잡이가 일직선상에 있지만 원자형광분광법에서는 광원과 시료잡이가 직각을 이룬다.
- 원자흡수분광법은 레이저 광원을 사용할 수 없으나 원자형광분광법에서는 사용 가능하다.
54. 원자흡수분광법에서 휘발성이 적은 화합물 생성 등으로 인하여 화학적 방해가 발생한다. 이러한 방해를 방지하는 방법에 해당되지 않는 것은?
- 높은 온도의 불꽃 이용
- 보호제(protective agent)의 사용
- 해방제(releasing agent)의 사용
- 이온화 활성제의 사용
55. 밀집된 상태에 있는 다원자분자의 흡수스펙트럼에 포함되어 있는 에너지의 구성요소가 아닌 것은?
- 몇 개의 결합전자의 에너지 상태로부터 생기는 분자의 전자에너지
- 들뜬 상태의 원자핵 분열과 관련된 양자에너지
- 원자사이의 진동수와 관련된 전체 에너지
- 한 분자 내의 여러 가지 회전운동과 관련된 에너지
56. 전자기 복사선 스펙트럼 영역을 나타낸 표에서 X에 해당하는 복사선은?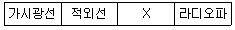
- 감마선
- 자외선
- 마이크로파
- X-선
57. 자외선-가시광선(UV-Vis) 흡수분광법에서 사용되는 광원이 아닌 것은?
- X선관
- 중수소등
- 광-발출 다이오드
- 텅스텐 필라멘트등
58. 유도쌍플라즈마 광원(ICP)의 특징이 아닌 것은?
- 원자가 빛살 진로에 머무르는 시간이 짧다.
- ICPMS의 광원이 될 수 있으므로 충분한 이온화가 생긴다.
- 광원의 온도가 높기 때문에 원소 상호간에 방해가 적다.
- 넓은 농도범위에 걸쳐 검정곡선이 성립한다.
59. 적외선(IR) 흡수분광법에서의 진동 짝지음에 대한 설명으로 틀린 것은?
- 두 신축진동에서 두 원자가 각각 단독으로 존재할 때 신축진동사이에 센 짝지음이 일어난다.
- 짝지음 진동들이 각각 대략 같은 에너지를 가질 때 상호작용이 크게 일어난다.
- 두 개 이상의 결합에 의해 떨어져 진동할 때 상호작용은 거의 일어나지 않는다.
- 짝지음은 같은 대칭성 화학종에서 진동할 때 일어난다.
60. 한번 측정한 스펙트럼의 신호대-잡음비가 6/1이다. 신호대-잡음비를 30/1로 증가시키기 위해서는 몇 번을 측정한 스펙트럼을 평균화하여야 하는가?
- 5
- 10
- 20
- 25
4과목: 기기분석II
61. 초임계 유체 크로마토그래피에 대한 설명으로 틀린 것은?
- 초임계 유체에서는 비휘발성 분자가 잘 용해되는 장점이 있다.
- 비교적 높은 온도를 사용하므로 분석물들의 회수가 어렵다.
- 이산화탄소가 초임계 유체로 널리 사용된다.
- 초임계 유체 크로마토그래피는 기체와 액체 크로마토그래피의 혼성방법이다.
62. 다음 중 분리분석법이 아닌 것은?
- 크로마토그래피
- 추출법
- 증류법
- 폴라로그래피
63. 적하 수은 전극(dropping mercury electrode)을 사용하는 폴라로그래피(polarography)에 대한 설명으로 옳지 않은 것은?
- 확산전류(diffusion current)는 농도에 비례한다.
- 수은이 항상 새로운 표면을 만들어 내어 재현성이 크다.
- 수은의 특성상 환원 반응보다 산화 반응의 연구에 유용하다.
- 반파 전위(half-wave potential)로부터 정성적 정보를 얻을 수 있다.
64. 질량 분석기로서 알 수 없는 것은?
- 시료물질의 원소의 조성
- 구성원자의 동위원소의 비
- 생화학 분자의 분자량
- 분자의 흡광계수
65. 막 지시전극에 사용되는 이온선택성 막의 공통적인 특성에 대한 설명으로 틀린 것은?
- 이온선택성 막은 분석물질 용액에서 용해도가 거의 0 이어야 한다.
- 막은 작아도 약간의 전기전도도를 가져야 한다.
- 막속에 함유된 몇가지 화학종들은 분석물 이온과 선택적으로 결합할 수 있어야 한다.
- 할로겐화은과 같은 낮은 용해도를 갖는 이온성 무기화합물은 막으로 사용될 수 없다.
66. 갈바니 전지에 대한 설명으로 틀린 것은?
- 전기를 발생하기 위해 자발적인 화학반응을 이용한다.
- 산화전극(anode)은 산화가 일어나는 전극이다.
- 전자는 산화전극에서 생성되어 도선을 따라 환원전극으로 흐른다.
- 산화전극을 오른쪽에서 환원전극을 왼쪽에 표시한다.
67. 폴리에틸렌의 등은 결정화 현상을 분석할 때 가장 알맞은 열분석법은?
- DTA
- DSC
- TG
- DMA
68. 얇은 층 크로마토그래피에 대한 설명으로 틀린 것은?
- 얇은 층 크로마토그래피는 제품의 순도를 판별하는 중요한 분석법으로 사용되고 있다.
- 전개판에 시료를 건조시킨 후 전개액에 시료가 잠기도록 해야 한다.
- 전개상자를 이용해 시료를 분리시킬 때 뚜껑을 닫아 전개용매 증기로 상자가 포화되도록 해야 한다.
- 지연인자(Rf)는 정지상의 두께, 온도, 시료의 크기에 의해 영향을 받는다.
69. 기체크로마토그래피에서 기체-액체 크로마토그래피(GLC)의 물질분리의 가장 중요한 가기전(평형의 종류)은 무엇인가?
- 흡착
- 이온교환
- 기체와 액체 사이의 분배
- 서로 섞이지 않는 액체 사이의 분배
70. 액체크로마토그래피에서 사용되는 굴절률검출기에 대한 설명으로 틀린 것은?
- 다른 형태의 검출기보다 비교적 감도가 좋다.
- 거의 모든 용질에 감응한다.
- 흐름의 속도에 영향을 받지 않는다.
- 온도에 민감하여 일정한 온도가 필수적이다.
71. 전기화학분석법에서 포화칼로멜 기준전극에 대하여 전극 전위가 0.115V로 측정이 되었다. 이 전극 전위를 포화 Ag/AgCl 기준전극에 대하여 측정하면 얼마로 나타나겠는가? (단, 표준수소전극에 대한 상대전위는 포화칼로멜 기준전극=0.244V, 포화 Ag/AgCI 기준전극=0.199V이다.)
- 0.16V
- 0.18V
- 0.20V
- 0.22V
72. 질량분석법에서 분자의 전체 스펙트럼(full spectrum)을 알 수 있는 검출방법은?
- MRM 모드
- SCAN 모드
- SIM 모드
- SRM 모드
73. 전기분해 효율이 100%인 전기분해전지가 있다. 산화전극에서는 산소기체가, 환원전극에서는 구리가 석출되도록 0.5A의 일정전류를 10분 동안 흘렸다. 석출된 구리의 무게는 약 얼마인가? (단, 구리의 물질량은 63.5g/mol 이다.)
- 0.05g
- 0.10g
- 0.20g
- 0.40g
74. 크로마토그래피 분석법에서 띠 넓힘에 영향을 주는 인자에 대한 설명으로 가장 옳은 것은?
- 다중통로에 의한 띠 넓힘은 분자가 충전관을 지나가는 통로가 다양하기 때문에 나타난다.
- 세로확산에 의한 띠 넓힘은 이동상과 정지상 사이의 평형이 매우 느릴 때 일어난다.
- 상 사이의 질량이동에 의한 띠 넓힘은 이동상의 속도가 증가하면 감소하는 경향이 있다.
- 세로확산에 의한 띠 넓힘은 이동상의 속도가 증가하면 증가하는 경향이 있다.
75. ICP를 이용한 질량분석장치에서 space charge에 대한 설명으로 가장 거리가 먼 것은?
- 이것이 생기면 이온의 투과율이 감소한다.
- 이것을 감소시키기 위하여 시료를 희석시켜 측정한다.
- 스펙트럼의 모양은 달리지나 질량의 편차는 거의 생기지 않는다.
- 매트릭스에 의한 영향으로 일반적으로 신호가 줄어든다.
76. 고분자량의 글로코오스 계열 화학물을 분리하는데 가장 적합한 크로마토그래피 방법은?
- 이온교환 크로마토그래피
- 크기별 배제 크로마토그래피
- 기체 크로마토그래피
- 분배 크로마토그래피
77. 전기화학 반응에서 일어나는 편극의 종류에 해당하지 않는 것은?
- 농도편극
- 결정화 편극
- 전하이동 편극
- 전압강화 편극
78. 전기화학전지에 사용되는 염다리(salt bridge)에 대한 설명으로 틀린 것은?
- 염다리의 목적은 전지 전체를 통해 전기적으로 양성상태를 유지하는 데 있다.
- 염다리는 양쪽 끝에 반투과성의 막이 있는 이온성 매질이다.
- 염다리는 고농도의 KNO3를 포함하는 젤로 채워진 U자관으로 이루어져 있다.
- 염다리의 농도가 반쪽전지의 농도보다 크기 때문에 염다리 밖으로의 이온의 이동이 염다리 안으로의 이온의 이동보다 크다.
79. 기체크로마토그래피에서 할로겐과 같이 전기음성도가 큰 작용기를 포함하는 분잗에 감도가 좋은 검출기는?
- 불꽃이온화 검출기(FID)
- 전자포착 검출기(ECD)
- 열전도도 검출기(TCD)
- 원자방출 검출기(AED)
80. 시차주사 열량법(DSC)에서 발열(exothermic) 봉우리를 나타내는 물리적 변화는?
- 결정화(crystallization)
- 승화(sublimation)
- 증발(vaporization)
- 용해(melting)






 "입니다. 이유는 메타-다이나이트로벤젠의 구조에서, 두 개의 니트로기(-NO2)가 메타위치에 있기 때문입니다. "
"입니다. 이유는 메타-다이나이트로벤젠의 구조에서, 두 개의 니트로기(-NO2)가 메타위치에 있기 때문입니다. " "와 "
"와 " "는 올바른 구조가 아니며, "
"는 올바른 구조가 아니며, " "는 메타위치에 니트로기가 하나만 있기 때문에 올바른 구조가 아닙니다.
"는 메타위치에 니트로기가 하나만 있기 때문에 올바른 구조가 아닙니다.
또한, 백색 침전의 양을 계산하기 위해 질산 수용액과 반응한 KCI의 몰농도를 계산해야 한다. 질산 수용액이 과량으로 가해졌으므로, KCI가 한정물질이다. 따라서, KCI의 몰농도를 계산하면 된다.
KCI의 몰질량은 K의 원자량(39) + CI의 원자량(35.5) = 74.5g/mol 이다. 따라서, 29.0g의 백색 침전이 생성되었으므로, KCI의 몰수는 29.0g / 74.5g/mol = 0.389몰 이다.
따라서, 정답은 "AgCI, 0.202몰" 이다.