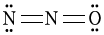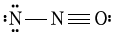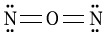1과목: 과목 구분 없음
1. 물과 반응하여 산성을 나타내는 물질은?
- Na2O
- P4O10
- Al2O3
- MgO
- P4O10은 물과 반응하여 인산을 생성하며, 이 과정에서 수소 이온을 방출하여 산성을 나타냅니다. 다른 보기들은 물과 반응하여 염기성을 나타내거나 중성을 유지합니다.
2. 다음 중 화학적 변화만을 모두 고른 것은?
- ㄱ, ㄴ, ㅂ
- ㄴ, ㄷ, ㄹ
- ㄴ, ㄷ, ㅁ
- ㄹ, ㅁ, ㅂ
- 화학적 변화란 원자나 분자의 구성이 변화하는 것을 말합니다. 따라서, 다음 중 화학적 변화만 있는 것은 "ㄴ, ㄷ, ㅁ" 입니다.
- ㄱ: 물체의 위치가 변화하는 것으로 화학적 변화가 아닙니다.
- ㄴ: 물과 염화수소가 반응하여 염산이 생성되는 것으로 화학적 변화입니다.
- ㅂ: 물과 이산화탄소가 반응하여 탄산이 생성되는 것으로 화학적 변화입니다.
- ㄷ: 물과 염화칼슘이 반응하여 칼슘하이드록사이드가 생성되는 것으로 화학적 변화입니다.
- ㄹ: 물과 암모니아가 반응하여 암모늄하이드록사이드가 생성되는 것으로 화학적 변화입니다.
- ㅁ: 물과 수산화나트륨이 반응하여 나트륨하이드록사이드가 생성되는 것으로 화학적 변화입니다.
3. 산의 세기를 비교한 것으로 옳지 않은 것은?
- HCl < HF
- HBrO3 < HClO3
- H2O < H2S
- HClO < HClO2
- 정답은 "HBrO3 < HClO3"이다.
HCl과 HF는 둘 다 산이지만, HF는 H-F 결합이 극성이 크기 때문에 H+ 이온을 더 잘 방출할 수 있다. 따라서 HF가 HCl보다 산성이 강하다.
H2O와 H2S는 둘 다 수소와 산소 또는 황의 결합으로 이루어진 분자이지만, H2S는 황과 수소의 결합이 덜 극성이기 때문에 H+ 이온을 덜 방출할 수 있다. 따라서 H2O가 H2S보다 산성이 강하다.
HClO와 HClO2는 둘 다 염소와 산소, 수소의 결합으로 이루어진 분자이지만, HClO2는 더 많은 산소를 가지고 있기 때문에 H+ 이온을 더 잘 방출할 수 있다. 따라서 HClO2가 HClO보다 산성이 강하다.
HBrO3과 HClO3은 둘 다 브로민과 염소, 산소의 결합으로 이루어진 분자이지만, 브로민의 전자 구조가 더 크기 때문에 브로민과 결합한 산소의 전하가 더 분산되어 있어 H+ 이온을 더 잘 방출할 수 있다. 따라서 HBrO3가 HClO3보다 산성이 강하다.
4. 어떤 화합물에 질량 기준으로 원소 A가 25%, 원소 B가 75% 포함되어 있다. 원소 B의 원자량이 원소 A의 원자량의 2배라면 이 화합물의 실험식은?
- A3B2
- A2B3
- A2B
- AB2
- 이 화합물에서 A와 B의 몰 비율은 각각 1:3이다. B의 원자량이 A의 원자량의 2배이므로, B 한 개의 몰질량은 A 한 개의 몰질량의 2배이다. 따라서, 이 화합물의 분자 내에 A와 B의 원자 수 비율은 2:3이다. 이 비율을 만족하는 화합물의 실험식은 A2B3이다.
보기에서 A3B2는 A와 B의 원자 수 비율이 3:2이므로, 문제에서 주어진 비율과 다르다. A2B는 B의 원자 수 비율이 1:2이므로, 문제에서 주어진 비율과 다르다. AB2는 A와 B의 원자 수 비율이 1:2이므로, 문제에서 주어진 비율과 다르다. 따라서, 정답은 A2B3이다.
5. 기체의 온도(T), 몰수(n), 압력(P), 부피(V) 간의 관계에 대한 설명 중 옳은 것만을 모두 고른 것은?
- ㄱ, ㄴ, ㄷ
- ㄴ, ㄹ
- ㄱ, ㄷ, ㄹ
- ㄱ, ㄷ
- ㄱ. 보일-샤를의 법칙에 따라 기체의 압력과 부피는 역수 관계이다.
ㄷ. 이상 기체 법칙에 따라 온도, 몰수, 압력, 부피는 서로 비례한다.
6. 다음 N2O의 루이스 구조 중 형식전하를 고려할 때 가장 안정한 구조는?
- 가장 안정한 구조는 "
 "이다.
"이다.
이유는 다음과 같다.
1. N2O의 전체 전하는 0이다. 따라서 루이스 구조에서 N과 O의 형식전하의 합은 0이 되어야 한다.
2. " " 구조에서 N은 3개의 결합전자쌍과 1개의 비결합전자쌍을 가지며, O는 1개의 결합전자쌍과 3개의 비결합전자쌍을 가진다. 이는 N의 전자구성이 2s22p3이고 O의 전자구성이 2s22p4임을 나타낸다.
" 구조에서 N은 3개의 결합전자쌍과 1개의 비결합전자쌍을 가지며, O는 1개의 결합전자쌍과 3개의 비결합전자쌍을 가진다. 이는 N의 전자구성이 2s22p3이고 O의 전자구성이 2s22p4임을 나타낸다.
3. "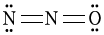 ", "
", "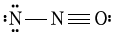 ", "
", "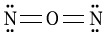 " 구조에서는 N이 4개의 결합전자쌍을 가지게 되어 형식전하가 +1이 된다. 이는 N의 전자구성이 2s22p23s13p1임을 나타낸다. 따라서 이러한 구조는 전하의 분산이 불균형하고 불안정하다.
" 구조에서는 N이 4개의 결합전자쌍을 가지게 되어 형식전하가 +1이 된다. 이는 N의 전자구성이 2s22p23s13p1임을 나타낸다. 따라서 이러한 구조는 전하의 분산이 불균형하고 불안정하다.
따라서 " " 구조가 N2O의 가장 안정한 루이스 구조이다.
" 구조가 N2O의 가장 안정한 루이스 구조이다.
7. 다음 중 개수가 가장 많은 것은?
- 물 1몰 내의 산소 원자 수
- 이산화탄소 1몰 내의 탄소 원자 수와 산소 원자 수의 합
- 6.02 × 1023개의 야구 공
- 암모늄 양이온 1몰 내의 수소 원자 수
- 암모늄 양이온은 NH4+로 구성되어 있으며, 이 중 수소 원자는 4개가 존재합니다. 따라서 암모늄 양이온 1몰 내의 수소 원자 수가 가장 많습니다.
- 물 1몰 내의 산소 원자 수: 물은 H2O로 구성되어 있으며, 산소 원자는 1개가 존재합니다.
- 이산화탄소 1몰 내의 탄소 원자 수와 산소 원자 수의 합: 이산화탄소는 CO2로 구성되어 있으며, 탄소 원자는 1개, 산소 원자는 2개가 존재합니다. 따라서 합은 3입니다.
- 6.02 × 1023개의 야구 공: 야구 공은 분자 구조를 가지지 않으므로 원자 수를 구할 수 없습니다.
8. sp2 혼성화를 이루는 화합물만으로 짝지어진 것은?
- 에테인(C2H6), 사이클로헥세인(C6H12)
- 이산화탄소(CO2), 아세틸렌(C2H2)
- 에틸렌(C2H4), 벤젠(C6H6)
- 오염화인(PCl5), 삼아이오딘화 이온(I2-)
- sp2 혼성화는 탄소 원자가 세 개의 sp2 오비탈과 하나의 p 오비탈을 혼합하여 만든 혼성 오비탈로, 평면 구조를 가지는 화합물에서 주로 나타납니다. 따라서, 에틸렌과 벤젠은 sp2 혼성화를 이루는 화합물이므로 정답입니다.
에테인과 사이클로헥세인은 sp3 혼성화를 이루는 화합물입니다. 이산화탄소와 아세틸렌은 sp 혼성화를 이루는 화합물입니다. 오염화인과 삼아이오딘화 이온은 혼성화를 이루지 않는 화합물입니다.
9. 비극성 분자는?
- CH3Br
- CO2
- H2O
- NH3
- 비극성 분자란 분자 내부의 전자가 균일하게 분포되어 있어서 분자 전체적으로 극성이 없는 분자를 말합니다. 이 중에서 CO2는 중앙의 탄소 원자 주변에 산소 원자가 대칭적으로 위치하고 있어서 전자가 균일하게 분포되어 있습니다. 따라서 CO2는 비극성 분자입니다.
10. Fe2+의 바닥상태 전자배치는? (단, Fe의 원자번호는 26이다)
- [Ne] 3s23p63d64s2
- [Ne] 3s23p64s23d4
- [Ne] 3s23p63d8
- [Ne] 3s23p63d6
- Fe의 전자배치는 [Ar] 3d64s2 이다. Fe2+는 2개의 전자를 잃어버리므로, 3d 궤도에서 먼저 전자를 잃게 된다. 따라서 Fe2+의 전자배치는 [Ar] 3d6 이 된다. [Ar]은 18개의 전자를 가진 아르곤의 전자배치를 나타내며, 3d6은 Fe의 3d 궤도에 6개의 전자가 존재한다는 것을 나타낸다. 따라서, Fe2+의 전자배치는 [Ar] 3d6 이다.
11. 다음 중 산성비의 피해를 가장 많이 입을 수 있는 건축재료는?
- 대리석
- 화강암
- 유리
- 모래
- 대리석은 산성비에 노출되면 화학적 반응으로 인해 부식되기 쉽기 때문에 산성비의 피해를 가장 많이 입을 수 있는 건축재료입니다.
12. 폴리에틸렌(polyethylene)을 제조할 때 사용되는 가장 보편적인 단위체는?
- CH2=CH(C6H5)
- CH2=CHCl
- CH2=CH2
- CH2=CH(CN)
- 폴리에틸렌은 에틸렌(C2H4) 분자의 중합체로, 에틸렌 분자는 CH2=CH2 구조를 가지기 때문에, 폴리에틸렌을 제조할 때 사용되는 가장 보편적인 단위체는 CH2=CH2입니다.
13. 어떤 온도에서 다음 발열반응의 평형상수 Kc=9.6일 때 옳은 것은?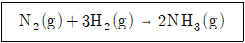
- △G > 0, △H > 0, △S > 0
- △G > 0, △H > 0, △S < 0
- △G < 0, △H < 0, △S > 0
- △G < 0, △H < 0, △S < 0
- 발열반응의 평형상수 Kc=9.6일 때, 이는 생성물 농도가 원료 농도보다 훨씬 높은 것을 의미한다. 따라서, 이 반응은 엔트로피가 증가하는 방향으로 진행한다.
또한, Kc 값이 크므로, 반응물에서 생성물로의 전환은 열역학적으로 유리하다. 따라서, 반응은 엔탈피가 감소하는 방향으로 진행한다.
마지막으로, Gibbs 자유 에너지 변화는 △G = △H - T△S로 표현된다. 여기서 T는 온도를 나타낸다.
따라서, 엔트로피와 엔탈피가 모두 감소하므로, Gibbs 자유 에너지 변화는 음수가 되어야 한다. 따라서, 정답은 "△G < 0, △H < 0, △S < 0"이다.
14. 25°C에서 pH가 5.0인 HCl 수용액을 1,000배 묽힌 용액의 pH에 가장 가까운 값은? (단, log2=0.30이다)
- 6.0
- 7.0
- 7.5
- 8.0
- HCl은 강산이므로 묽히면 pH가 증가한다. 1,000배 묽힌 용액은 원래 용액의 1/1,000 농도이므로 pH는 3단계 상승하여 8.0이 된다. 그러나 pH가 5.0인 용액을 1,000배 묽히면 pH는 2단계 상승하여 7.0이 된다. 따라서 정답은 "7.0"이다.
15. 다음 중 완충용액에 대한 설명으로 옳은 것만을 모두 고른 것은?
- ㄱ
- ㄱ, ㄴ
- ㄱ, ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ, ㄹ
- - ㄱ: 완충용액은 pH가 변화해도 적은 양의 산 또는 염기를 첨가해도 pH가 크게 변하지 않는 용액이다.
- ㄴ: 완충용액은 산과 염기의 중화점에서 가장 효과적으로 작용한다.
- ㄷ: 완충용액은 산 또는 염기를 첨가해도 pH가 거의 변하지 않기 때문에 실험에서 정확한 pH 값을 유지할 수 있다.
- ㄹ: 완충용액은 일정한 농도와 온도에서만 유지되기 때문에 실험 시 이를 유지해야 한다.
16. 이산화질소(적갈색)로부터 사산화이질소(무색)가 생성되는 다음 반응계에 대한 설명으로 옳지 않은 것은?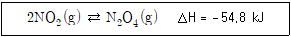
- 정반응은 발열반응이다.
- 온도를 높이면 평형상수가 커진다.
- 반응용기의 부피를 감소시키면 혼합물이 무색에 가까워진다.
- 온도를 낮추면 혼합물이 무색에 가까워진다.
- "반응용기의 부피를 감소시키면 혼합물이 무색에 가까워진다."는 이 반응계에 대한 설명과 관련이 없는 내용이므로 옳지 않은 것이다.
온도를 높이면 발열반응인 이 반응에서 생성되는 사산화이질소의 엔탈피 변화량이 증가하게 되어, 엔트로피 변화량에 비해 열역학적으로 유리한 상황이 되어 평형상수가 커지게 된다. 따라서 온도를 높이면 평형상수가 커지는 것이다.
17. 정촉매의 역할에 대한 설명으로 옳지 않은 것은?
- 반응에 관여하는 분자들의 충돌 횟수를 증가시켜 반응속도를 증가시킨다.
- 정반응 속도와 역반응 속도를 모두 증가시킨다.
- 반응 활성화에너지를 감소시킨다.
- 반응이 진행되어도 촉매의 양은 줄지 않는다.
- 정촉매는 반응 활성화에너지를 감소시켜 반응속도를 증가시키는 역할을 한다. 따라서 "반응에 관여하는 분자들의 충돌 횟수를 증가시켜 반응속도를 증가시킨다."는 설명은 옳다.
18. 산성비의 형성과 관계없는 반응은?
- CO+H2O→HCO2H
- 2NO2+H2O→HNO2+HNO3
- SO3+H2O→H2SO4
- 2SO2+O2→2SO3
- 산성비의 형성과 관계없는 반응은 "2SO2+O2→2SO3"이다.
"CO+H2O→HCO2H"는 수소와 이산화탄소가 결합하여 포름산을 생성하는 반응이다. 이 반응은 산성비의 형성과는 관련이 없다.
"2NO2+H2O→HNO2+HNO3"는 질산과 질산염을 생성하는 반응으로, 산성비의 형성과 관련이 있다.
"SO3+H2O→H2SO4"는 황산을 생성하는 반응으로, 산성비의 형성과 관련이 있다.
따라서, 산성비의 형성과 관련이 없는 반응은 "2SO2+O2→2SO3"이다.
19. 다음 반응식에 따라 A 3몰과 B 2몰이 반응하여 C 4몰이 생성되었다면 이 반응의 퍼센트 수율[%]은?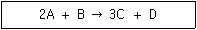
- 67
- 75
- 89
- 100
- 반응식에서 A와 B는 3:2의 몰 비율로 반응하므로, B의 몰 수를 2x로 가정하면 A의 몰 수는 3x가 된다. 따라서, 반응 전 A와 B의 총 몰 수는 3x+2x=5x이다. 반응 후 생성된 C의 몰 수는 4몰이므로, 반응의 몰 수 수율은 (4몰 ÷ 5x몰) × 100% = 80%이다. 하지만, 반응식에서 A와 B는 100% 반응하지 않을 수 있으므로, 이 반응의 퍼센트 수율은 80%보다 작을 것이다. 따라서, 정답은 89%가 될 수 있다.
20. 혼합물로부터 순물질을 분리해내는 방법은?
- 질량 분광
- 적외선 분광
- 크로마토그래피
- X-선 회절
- 크로마토그래피는 혼합물을 구성하는 성분들의 물리적, 화학적 특성에 따라 분리하는 방법으로, 이를 통해 순물질을 분리해낼 수 있습니다. 즉, 혼합물을 흡착제에 흡착시키고 이를 이용해 성분들을 분리하는 방법입니다.