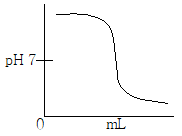1과목: 과목 구분 없음
1. 끓는점이 가장 높은 화합물은?
- 아세톤
- 물
- 벤젠
- 에탄올
- 끓는점은 액체가 기체로 변하는 온도를 말하는데, 물은 분자간 수소결합이 매우 강력하여 끓는점이 매우 높습니다. 따라서, 주어진 보기 중에서 물이 끓는점이 가장 높은 화합물입니다.
2. 25℃에서 1.0M의 수용액을 만들었을 때 pH가 가장 낮은 것은? (단, 25℃에서 산 해리상수(Ka)는 아래와 같다)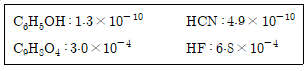
- C6H5OH
- HCN
- C9H8O4
- HF
- HF의 산 해리상수(Ka)가 가장 크기 때문에 pH가 가장 낮게 나온다. 다른 세 가지 화합물의 Ka 값은 모두 HF보다 작기 때문에 더 적은 양의 H+ 이온을 생성하고 더 높은 pH 값을 가지게 된다.
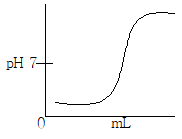
3. 약염기를 강산으로 적정하는 곡선으로 옳은 것은?
- 정답은 "
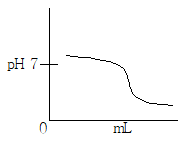 "입니다.
"입니다.
이유는 이 곡선은 약염기를 강산으로 적정하는 과정에서 pH가 변화하는 과정을 나타내며, 적정마침점(pH=pKa)에서 최대 변화율을 보이기 때문입니다. 따라서 이 곡선을 이용하여 적정마침점을 정확하게 찾을 수 있습니다.
4. 수소 원자의 선 스펙트럼을 설명할 수 있는 것만을 모두 고른 것은?
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ, ㄷ
- 선 스펙트럼은 원자가 특정한 파장의 빛을 방출할 때 나타나는 스펙트럼으로, 원자의 전자가 에너지 준위를 변화시키면서 발생합니다. 수소 원자의 경우, 전자가 에너지 준위를 높이면서 발생하는 선 스펙트럼은 특정한 파장을 가지는 라인 스펙트럼으로 나타납니다. 따라서, 수소 원자의 선 스펙트럼을 설명할 수 있는 것은 "ㄱ" 입니다.
5. 0.1M 황산(H2SO4) 용액 1.5L를 만드는 데 필요한 15M 황산의 부피는?
- 0.01L
- 0.1L
- 22.5L
- 225L
- 황산의 몰농도는 15M이고, 용액의 몰농도는 0.1M이므로, 용액을 만들기 위해 필요한 황산의 부피는 다음과 같이 계산할 수 있다.
(0.1M) × (1.5L) = (15M) × (V)
V = (0.1M × 1.5L) / 15M = 0.01L
따라서, 정답은 "0.01L"이다.
6. 1A족 원소(Li, Na, K)의 성질에 대한 설명으로 옳은 것만을 모두 고른 것은?
- ㄱ, ㄴ
- ㄱ, ㄹ
- ㄴ, ㄷ
- ㄷ, ㄹ
- - ㄱ: 1A족 원소들은 전자 구성이 1s2 2s1인데, 이는 외전자가 하나만 존재한다는 것을 의미한다. 따라서 이들은 다른 원소와 결합할 때 외전자를 쉽게 잃어버리고 양이온으로 존재하는 경향이 있다.
- ㄹ: 1A족 원소들은 전기음성도가 낮아 다른 원소와 결합할 때 산화수가 +1인 양이온으로 존재하는 경우가 많다. 이들은 또한 비교적 적은 에너지로 전자를 잃어버리기 때문에 화학반응에서 활발하게 참여한다.
7. 산화수에 대한 설명으로 옳은 것만을 모두 고른 것은?
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄹ
- ㄷ, ㄹ
- 산화수란 원소가 화합물에서 가지는 산화상태를 나타내는 수치이다. 산화수는 원소의 전자 수 변화에 따라 결정되며, 양이온의 경우는 전자를 잃어 산화수가 양수가 되고, 음이온의 경우는 전자를 얻어 산화수가 음수가 된다.
이 그림에서는 산화수가 적혀있는데, 산화수가 양수인 경우는 ㄷ, 음수인 경우는 ㄹ로 표시되어 있다. 따라서 정답은 "ㄷ, ㄹ"이다.
8. 모든 온도에서 자발적 과정이기 위한 조건은?
- ΔH > 0, ΔS > 0
- ΔH = 0, ΔS < 0
- ΔH > 0, ΔS = 0
- ΔH < 0, ΔS > 0
- 자발적 과정이 일어나기 위해서는 엔탈피 변화와 엔트로피 변화가 모두 유리해야 합니다. 즉, 시스템의 엔탈피가 감소하고 엔트로피가 증가해야 합니다. 따라서 ΔH가 음수이고 ΔS가 양수인 경우가 자발적 과정이 일어나는 조건입니다.
9. 다음 반응에서 28.0g의 NaOH(분자량:40.0)이 들어있는 1.0L 용액을 중화하기 위해 필요한 2.0M HCl의 부피는?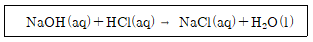
- 150.0mL
- 250.0mL
- 350.0mL
- 450.0mL
- NaOH와 HCl는 1:1 몰비로 중화되므로, NaOH의 몰수를 계산해보자.
몰수 = 질량(g) / 분자량(g/mol) = 28.0g / 40.0g/mol = 0.7mol
따라서, 중화에 필요한 HCl의 몰수도 0.7mol이다. 용액의 부피는 1.0L이므로, HCl의 농도는 0.7M이다.
중화 반응식은 다음과 같다.
NaOH + HCl → NaCl + H2O
따라서, 1mol의 NaOH를 중화하기 위해서는 1mol의 HCl이 필요하다. 우리가 가지고 있는 HCl 용액의 농도는 2.0M이므로, 1L(=1000mL)의 용액에는 2.0mol의 HCl이 들어있다.
따라서, 중화에 필요한 HCl 용액의 부피는 다음과 같이 계산할 수 있다.
2.0mol / 2.0M = 1.0L = 1000mL
하지만, 이렇게 계산한 값은 1mol의 NaOH를 중화하기 위한 HCl 용액의 부피이다. 우리가 가지고 있는 NaOH 용액은 0.7mol의 NaOH가 들어있으므로, 중화에 필요한 HCl 용액의 부피는 다음과 같이 계산할 수 있다.
0.7mol / 2.0M = 0.35L = 350mL
따라서, 정답은 "350.0mL"이다.
10. 다음은 질소(N2) 기체와 수소(H2) 기체가 반응하여 암모니아(NH3) 기체가 생성되는 화학반응식이다. 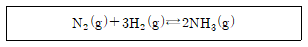
그림은 부피가 1L인 강철용기에 N2!(g) 4몰, H2(g) 8몰을 넣고 반응시킬 때 반응 시간에 따른 N2(g)의 몰수를 나타낸 것이다. 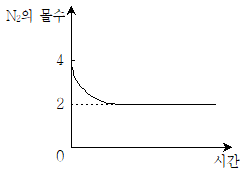
이 반응의 평형상수(K) 값은? (단, 온도는 일정하다)
- 1
- 2
- 4
- 8
- 반응식에서 몰비는 N2:H2:NH3 = 1:3:2 이다. 따라서, H2의 몰수가 8몰이므로, N2의 몰수는 8/3 몰이다.
반응식의 평형상수(K)는 다음과 같이 정의된다.
K = [NH3]/[N2][H2]3
반응 시간이 무한히 길어지면, 반응은 평형에 도달하게 된다. 이때, 반응물과 생성물의 몰수 비율은 K 값으로 결정된다.
따라서, 반응 시간이 무한히 길어졌을 때, NH3의 몰수는 8/3 x K x 32 = 24K/3 = 8K/1 이다.
그림에서 반응 시간이 무한히 길어졌을 때, N2의 몰수는 8/3 몰이므로, K = [NH3]/[N2][H2]3 = (8K/1)/(8/3 x 33) = K/27 이다.
따라서, K = 27K 이므로, K 값은 0 또는 1이다.
반응식에서 생성물인 NH3의 몰수가 많아지기 위해서는 K 값이 커져야 한다. 따라서, K 값이 1일 때, NH3의 몰수가 가장 많아지므로, 정답은 "1"이다.
11. Cr3+의 바닥 상태 전자 배치는? (단, Cr의 원자 번호는 24이다)
- [Ar]4s13d2
- [Ar]4s13d5
- [Ar]4s23d1
- [Ar]3d3
- Cr의 전자 구성은 1s22s22p63s23p64s23d4 이다. Cr3+는 3개의 전자를 잃어버리므로, 전자 구성은 [Ar]3d3이 된다. 이는 3d 궤도에 3개의 전자가 존재하고, 4s 궤도에는 전자가 없음을 나타낸다. 따라서, 정답은 "[Ar]3d3"이다.
12. 다음 표는 원소와 이온의 구성 입자 수를 나타낸 것이다. 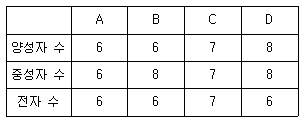
이에 대한 설명으로 옳은 것은? (단, A ~ D는 임의의 원소 기호이다.)
- A와 D는 동위원소이다.
- B와 C는 질량수가 동일하다.
- B의 원자번호는 8이다.
- D는 음이온이다.
- - A와 D는 동위원소이다: A와 D는 같은 원소이지만 전하가 다른 이온으로, 동위원소라고 부른다.
- B와 C는 질량수가 동일하다: B와 C는 같은 원소이지만 전하가 다른 이온으로, 질량수는 전자 수와 상관없이 핵과 전자의 총 질량으로 결정되기 때문에 동일하다.
- B의 원자번호는 8이다: B는 산소(O)이다. 산소의 원자번호는 8이다.
- D는 음이온이다: D는 음전하를 가진 이온이므로 음이온이다.
따라서, B와 C는 같은 원소의 이온으로 질량수가 동일하다. 이유는 질량수는 핵과 전자의 총 질량으로 결정되기 때문이다.
13. 다음 각 화합물의 1M 수용액에서 이온 입자 수가 가장 많은 것은?
- NaCl
- KNO3
- NH4NO3
- CaCl2
- 이온 입자 수는 화학식에서 이온이 되는 원소의 수에 따라 결정된다.
NaCl: Na+와 Cl- 이온으로 이루어져 있으므로 1M 수용액에서 이온 입자 수는 2M이다.
KNO3: K+와 NO3- 이온으로 이루어져 있으므로 1M 수용액에서 이온 입자 수는 2M이다.
NH4NO3: NH4+와 NO3- 이온으로 이루어져 있으므로 1M 수용액에서 이온 입자 수는 2M이다.
CaCl2: Ca2+와 Cl- 이온으로 이루어져 있으므로 1M 수용액에서 이온 입자 수는 3M이다.
따라서, 이온 입자 수가 가장 많은 것은 CaCl2이다.
14. 다음 중 결합 차수가 가장 낮은 것은?
- O2
- F2
- CN-
- NO+
- 결합 차수란 원자가 결합한 다른 원자의 수를 말한다.
O2는 두 개의 산소 원자가 이중 결합으로 결합하여 결합 차수가 2이다.
F2는 두 개의 플루오린 원자가 단일 결합으로 결합하여 결합 차수가 1이다.
CN-는 탄소 원자와 짝을 이루는 질소 원자가 이중 결합으로 결합하고, 탄소 원자와 시안화물 이온을 이루는 결합은 단일 결합으로 결합하여 결합 차수가 3이다.
NO+는 질소 원자와 산소 원자가 이중 결합으로 결합하고, 양전하를 가진 질소 원자와 어느 한 산소 원자가 단일 결합으로 결합하여 결합 차수가 2이다.
따라서, 결합 차수가 가장 낮은 것은 F2이다.
15. 다음 중 무극성 분자는?
- 암모니아
- 이산화탄소
- 염화수소
- 이산화황
- 이산화탄소는 탄소와 산소 원자로 이루어져 있으며, 양성자와 음성자의 전하를 가지고 있지 않기 때문에 무극성 분자입니다. 다른 보기들은 양성자와 음성자의 전하를 가지고 있기 때문에 무극성 분자가 아닙니다.
16. 다음 원자 또는 이온 중 반지름이 가장 큰 것은?
- 11Na+
- 12Mg2+
- 17Cl-
- 18Ar
- 이온의 반지름은 전자 수에 따라 결정되므로, 전자 수가 가장 많은 "17Cl-" 이온이 가장 큰 반지름을 가진다. "11Na+"와 "12Mg2+" 이온은 전자 수가 적기 때문에 "17Cl-" 이온보다 작은 반지름을 가진다. "18Ar" 원자는 전자 수가 "17Cl-" 이온과 같지만, 이온은 전자를 잃어 전자 궤도가 작아지므로 반지름이 더 작아진다. 따라서, "17Cl-" 이온이 가장 큰 반지름을 가진다.
17. 대기 중에서 일어날 수 있는 다음 반응 중 산성비 형성과 관계가 없는 것은?
- O3(g) → O2(g) + O(g)
- S(s) + O2(g) → SO2(g)
- N2(g) + O2(g) → 2NO(g)
- SO3(g) + H2O(ℓ) → H2SO4(aq)
- "SO3(g) + H2O(ℓ) → H2SO4(aq)"는 산성비 형성과 관련이 있습니다.
"O3(g) → O2(g) + O(g)"는 오존 분해 반응으로, 대기 중의 오존이 분해되어 산소와 단원소 산소가 생성됩니다. 이 반응은 산성비 형성과는 직접적인 관련이 없습니다.
18. 다음 표는 반응 2A3(g) → 3A2(g)의 메커니즘과 각 단계의 활성화 에너지를 나타낸 것이다. 
이에 대한 설명으로 옳은 것만을 모두 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- - 단계 1에서는 2A3 분자가 충돌하여 A3 분자 2개로 분해되는데, 이 과정의 활성화 에너지는 200 kJ/mol이다. 따라서, 반응속도를 높이기 위해서는 충돌 빈도를 높이는 것이 중요하다.
- 단계 2에서는 A3 분자와 A2 분자가 충돌하여 A2 분자 2개와 A3 분자가 생성되는데, 이 과정의 활성화 에너지는 100 kJ/mol이다. 따라서, 이 단계에서는 충돌 시 방향성이 중요하다.
- 단계 3에서는 A3 분자와 A2 분자가 충돌하여 A2 분자 3개가 생성되는데, 이 과정의 활성화 에너지는 50 kJ/mol이다. 따라서, 이 단계에서는 충돌 시 방향성이 중요하다.
- 따라서, "ㄱ, ㄴ"이 정답이다.
19. 중심원자의 혼성 궤도에서 s-성질 백분율(percent s-character)이 가장 큰 것은?
- BeF2
- BF3
- CH4
- C2H6
- 중심원자의 혼성 궤도에서 s-성질 백분율이 가장 큰 것은 원자 번호가 작은 원소일수록 크다. 따라서 BeF2가 가장 큰 s-성질 백분율을 가진다. 이유는 Be의 전자 구성이 1s22s2인 반면, BF3의 경우 B의 전자 구성이 1s22s22p1이기 때문이다. CH4와 C2H6의 경우에도 C의 전자 구성이 1s22s22p2이기 때문에 BeF2보다 s-성질 백분율이 작다.
20. 광화학 스모그를 일으키는 주된 물질은?
- 이산화탄소
- 이산화황
- 질소 산화물
- 프레온 가스
- 광화학 스모그는 자동차나 공장 등에서 배출되는 질소 산화물과 태양광 및 열에 의해 생성되는 오존이 반응하여 일어납니다. 따라서 주된 물질은 질소 산화물입니다. 이산화탄소, 이산화황, 프레온 가스는 스모그의 원인이 될 수 있지만, 주된 물질은 아닙니다.