1과목: 과목 구분 없음
1. 다음 중 개수가 가장 많은 것은?
- 순수한 다이아몬드 12g 중의 탄소 원자
- 산소 기체 32g 중의 산소 분자
- 염화암모늄 1몰을 상온에서 물에 완전히 녹였을 때 생성되는 암모늄이온
- 순수한 물 18g 안에 포함된 모든 원자
- 정답은 "순수한 물 18g 안에 포함된 모든 원자"입니다. 이유는 물 분자는 H2O로 구성되어 있으며, 1분자의 물 안에는 2개의 수소 원자와 1개의 산소 원자가 포함되어 있습니다. 따라서 18g의 물 안에는 6.02 x 10^23개의 물 분자가 있으며, 이는 3.61 x 10^24개의 수소 원자와 1.81 x 10^24개의 산소 원자가 포함되어 있다는 것을 의미합니다. 따라서 "순수한 물 18g 안에 포함된 모든 원자"가 개수가 가장 많습니다.
2. 원소들의 전기음성도 크기의 비교가 올바른 것은?
- C < H
- S < P
- S < O
- Cl < Br
- 전기음성도는 원자가 전자를 끌어당기는 능력을 나타내는 지표이다. 전기음성도가 높을수록 원자는 전자를 강하게 끌어당기며, 전기음성도가 낮을수록 전자를 약하게 끌어당긴다.
따라서, Sulfur(S)보다 Oxygen(O)의 전기음성도가 높다.
3. 1MFe(NO3)2 수용액에서 음이온의 농도는? (단, Fe(NO3)2는 수용액에서 100% 해리된다)
- 1M
- 2M
- 3M
- 4M
- Fe(NO3)2는 수용액에서 100% 해리되므로, 1 몰의 Fe(NO3)2는 2 몰의 NO3- 이라는 것을 알 수 있습니다. 따라서, 1MFe(NO3)2 수용액에서 NO3- 음이온의 농도는 2M 입니다.
4. 밑줄 친 원자(C, Cr, N, S)의 산화수가 옳지 않은 것은?
- HCO3-, +4
- Cr2O72-, +6
- NH4+, +5
- SO42-, +6
- "NH4+, +5"이 옳지 않은 것이다. 이유는 질소(N)의 최대 산화수는 +5이기 때문이다. 따라서, NH4+의 질소는 +5의 산화수를 가진다.
5. 90g의 글루코오스(C6H12O6)와 과량의 산소(O2)를 반응시켜 이산화탄소(CO2)와 물(H2O)이 생성되는 반응에 대한 설명으로 옳지 않은 것은? (단, H, C, O의 몰 질량[g/mol]은 각각 1, 12, 16이다)
- x와 y에 해당하는 계수는 모두 6이다.
- 90g 글루코오스가 완전히 반응하는데 필요한 O2의 질량은 96g이다.
- 90g 글루코오스가 완전히 반응해서 생성되는 CO2의 질량은 88g이다.
- 90g 글루코오스가 완전히 반응해서 생성되는 H2O의 질량은 54g이다.
- "90g 글루코오스가 완전히 반응해서 생성되는 CO2의 질량은 88g이다."라는 설명이 옳지 않습니다. 이 반응에서 생성되는 CO2의 질량은 88g이 아니라 88/44 = 2 몰이 됩니다. 따라서 90g의 글루코오스가 반응하여 생성되는 CO2의 질량은 2 x 44g = 88g이 됩니다.
이 반응에서 글루코오스와 산소의 몰비는 1:6입니다. 따라서 90g의 글루코오스가 완전히 반응하려면 6 x 90g = 540g의 산소가 필요합니다. 그러나 문제에서는 "과량의 산소"가 반응에 사용된다고 명시되어 있으므로, 실제로는 540g보다 더 많은 산소가 반응에 사용될 것입니다.
반응식은 다음과 같습니다:
C6H12O6 + 6O2 → 6CO2 + 6H2O
따라서 글루코오스 1 몰에 대해 CO2 1 몰이 생성되므로, 90g의 글루코오스가 반응하여 생성되는 CO2의 질량은 88g이 됩니다. 이는 CO2의 몰 질량이 44g/mol이기 때문입니다.
6. 묽은 설탕 수용액에 설탕을 더 녹일 때 일어나는 변화를 설명한 것으로 옳은 것은?
- 용액의 증기압이 높아진다.
- 용액의 끓는점이 낮아진다.
- 용액의 어는점이 높아진다.
- 용액의 삼투압이 높아진다.
- 설탕을 묽은 설탕 수용액에 더 녹일 때, 설탕 분자가 용매 분자와 상호작용하여 용액의 입자 수가 증가하게 됩니다. 이로 인해 용액의 삼투압이 높아지게 됩니다. 따라서 정답은 "용액의 삼투압이 높아진다." 입니다.
7. 다음의 화합물 중에서 원소 X가 산소(O)일 가능성이 가장 낮은 것은? (단, O의 몰 질량[g/mol]은 16이다)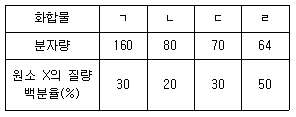
- ㄱ
- ㄴ
- ㄷ
- ㄹ
- 답은 "ㄷ"입니다. 이유는 X의 몰 질량이 40인 화합물은 CaO이고, X의 몰 질량이 44인 화합물은 CO2이기 때문입니다. 따라서 X의 몰 질량이 32인 화합물은 SO2일 가능성이 높습니다.
8. 대기 오염 물질인 기체 A, B, C가 <보기 1>과 같을 때 <보기 2>의 설명 중 옳은 것만을 모두 고른 것은?
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
- 보기 1:
A - 화학공장에서 발생하는 유해가스
B - 자동차와 배기가스에서 발생하는 유해가스
C - 산업단지에서 발생하는 유해가스
보기 2:
ㄱ. 대기 중 미세먼지의 농도가 높아질 수 있다.
ㄴ. 오존과 이산화질소 등의 유해 물질이 생성될 수 있다.
ㄷ. 대기 중 이산화탄소 농도가 높아질 수 있다.
ㄱ은 보기 1의 모든 기체가 대기 오염 물질이기 때문에 대기 중 미세먼지의 농도가 높아질 수 있다는 것이 옳다.
ㄴ은 기체 B와 C가 대기 중 오존과 이산화질소 등의 유해 물질을 생성할 수 있기 때문에 옳다.
따라서 정답은 "ㄱ, ㄴ"이다.
9. 다음 중 분자 구조가 나머지와 다른 것은?
- BeCl2
- CO2
- XeF2
- SO2
- SO2은 다른 분자들과는 달리 이중 결합을 가지고 있어서 분자 구조가 다릅니다. 다른 분자들은 모두 선형 구조를 가지고 있지만, SO2은 각각의 산소 원자와 중심 원자인 황 원자가 모두 평면적으로 배열되어 있습니다. 이중 결합은 분자의 구조와 성질에 큰 영향을 미치기 때문에 SO2은 다른 분자들과 구조적으로 다르며, 냄새와 색깔 등의 물리적 성질도 다릅니다.
10. van der Waals 상태방정식 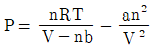 에 대한 설명으로 옳은 것만을 모두 고른 것은? (단, P, V, n, R, T는 각각 압력, 부피, 몰수, 기체상수, 온도이다)
에 대한 설명으로 옳은 것만을 모두 고른 것은? (단, P, V, n, R, T는 각각 압력, 부피, 몰수, 기체상수, 온도이다)
- ㄱ, ㄷ
- ㄴ, ㄹ
- ㄱ, ㄷ, ㄹ
- ㄱ, ㄴ, ㄷ, ㄹ
- - van der Waals 상태방정식은 실제 기체의 분자 크기와 상호작용을 고려한 상태방정식이다.
- (ㄱ)은 상호작용을 고려하지 않은 이상 기체 상태방정식인 이상기체법칙과의 차이점을 나타낸다.
- (ㄴ)은 이상기체법칙에서는 무시되는 기체 분자 간의 부피 제외를 고려한 것이다.
- (ㄷ)는 이상기체법칙에서는 무시되는 기체 분자 간의 상호작용을 고려한 것이다.
- (ㄹ)은 (ㄴ)과 (ㄷ)를 모두 고려한 것이다.
11. 다음 반응에 대한 평형상수는?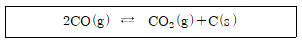
- K=[CO2]/[CO]2
- K=[CO]2/[CO2]
- K=[CO2][C]/[CO]2
- K=[CO]2/[CO2][C]
- 이 반응식에서 반응물인 CO와 CO2의 농도가 분모에 있고 생성물인 C의 농도가 분자에 있기 때문에 K=[CO2]/[CO]^2이다.
12. 질량 백분율이 N 64%, O 36%인 화합물의 실험식은? (단, N, O의 몰 질량[g/mol]은 각각 14, 16이다)
- N2O
- NO
- NO2
- N2O5
- 화합물의 질량 백분율을 이용하여 각 원자의 질량 비율을 구할 수 있다. N의 질량 비율은 14 × 2 = 28, O의 질량 비율은 16 × 3 = 48이다. 이를 가지고 가능한 실험식을 찾아보면, N2O가 가장 적합하다. N2O의 질량은 28 + 16 = 44이므로, N의 질량 백분율은 28/44 × 100 ≈ 63.6%, O의 질량 백분율은 16/44 × 100 ≈ 36.4%가 된다. 따라서 정답은 "N2O"이다.
13. 25°C에서 [OH-]=2.0×10-5M일 때, 이 용액의 pH값은? (단, log2=0.30이다)
- 2.70
- 4.70
- 9.30
- 11.30
- pH와 pOH는 다음과 같은 식으로 연관되어 있다.
pH + pOH = 14
따라서, pOH를 구하기 위해서는 먼저 [OH-]를 구해야 한다.
[OH-] = 2.0×10^-5 M
pOH = -log[OH-] = -log(2.0×10^-5) = 4.70
그리고 pH + pOH = 14 이므로,
pH = 14 - pOH = 14 - 4.70 = 9.30
따라서, 이 용액의 pH값은 9.30이다.
14. 온도가 400K이고 질량이 6.00kg인 기름을 담은 단열 용기에 온도가 300K이고 질량이 1.00kg인 금속공을 넣은 후 열평형에 도달했을 때, 금속공의 최종 온도[K]는? (단, 용기나 주위로 열 손실은 없으며, 금속공과 기름의 비열[J/(kg·K)]은 각각 1.00과 0.50로 가정한다)
- 350
- 375
- 400
- 450
- 열역학 제1법칙에 따라, 열의 에너지는 보존되므로, 기름과 금속공의 열량 변화량은 같아야 한다.
따라서,
(1.00kg)(1.00J/(kg·K))(Tf - 300K) = (6.00kg)(0.50J/(kg·K))(400K - Tf)
Tf = 375K
따라서, 최종 온도는 375K이다.
15. 아래 반응에서 산화되는 원소는?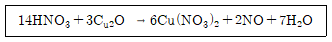
- H
- N
- O
- Cu
- 이 반응에서 산화되는 원소는 "Cu"입니다. 이유는 반응식에서 Cu(s)가 Cu2+(aq)로 산화되었기 때문입니다. Cu(s)가 전자를 잃어 Cu2+(aq)가 되면서 산화되었습니다.
16. 다음 그림은 어떤 반응의 자유에너지 변화(△G)를 온도(T)에 따라 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 모두 고른 것은? (단, △H는 일정하다)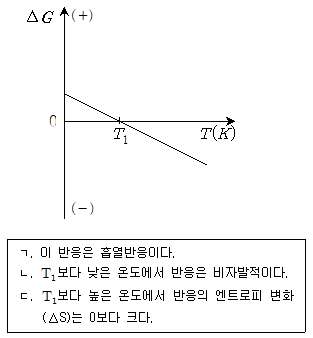
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
- - ㄱ. 이 반응은 엔탈피 변화(△H)가 일정하므로, 온도가 증가하면 엔트로피 변화(△S)가 더 커져서 △G가 감소한다. 따라서, 온도가 증가할수록 반응이 더욱 쉽게 일어난다.
- ㄴ. 반응의 △G가 0이 되는 지점이 온도가 증가함에 따라 이동한다. 따라서, △G가 0이 되는 지점인 역전 온도(inversion temperature)에서는 반응이 일어나지 않는다.
- ㄷ. 반응의 △G가 양수인 경우, 엔탈피 변화(△H)가 양수이므로 열이 흡수되는 반응이다. 따라서, 온도가 낮아질수록 반응이 더욱 쉽게 일어난다.
17. 이온성 고체에 대한 설명으로 옳은 것은?
- 격자에너지는 NaCl이 NaI보다 크다.
- 격자에너지는 NaF가 LiF보다 크다.
- 격자에너지는 KCl이 CaCl2보다 크다.
- 이온성 고체는 표준생성엔탈피(△Hfo)가 0보다 크다.
- 이온성 고체는 이온들이 양과 음의 전하를 가지고 있으며, 격자 구조를 이루고 있다. 격자에너지는 이 이온들이 서로 결합하여 격자를 형성하는 데 필요한 에너지를 말한다. 이 때, 이온의 크기와 전하량이 격자에너지에 영향을 미치며, 이 크기와 전하량이 클수록 격자에너지는 커진다. 따라서 NaCl이 NaI보다 큰 격자에너지를 가지는 이유는 NaCl의 이온 반지름이 NaI보다 작고, 전하량도 같기 때문이다.
18. 철(Fe)로 된 수도관의 부식을 방지하기 위하여 마그네슘(Mg)을 수도관에 부착하였다. 산화되기 쉬운 정도만을 고려할 때, 마그네슘 대신에 사용할 수 없는 금속은?
- 아연(Zn)
- 니켈(Ni)
- 칼슘(Ca)
- 알루미늄(Al)
- 철보다 산화되기 쉬운 금속을 사용하면 철이 부식되는 것을 방지할 수 있습니다. 따라서 아연, 칼슘, 알루미늄, 니켈 중에서 선택해야 합니다. 그 중에서도 니켈은 철보다 산화되기 쉬운 금속이므로 선택할 수 없습니다. 따라서 정답은 "니켈(Ni)"입니다.
19. 다음 반응은 300K의 밀폐된 용기에서 평형상태를 이루고 있다. 이에 대한 설명으로 옳은 것만을 모두 고른 것은? (단, 모든 기체는 이상기체이다)
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄹ
- ㄷ, ㄹ
- - "ㄱ, ㄴ" : 이상기체에서 분자간 상호작용은 없으며, 분자의 운동에 의해 압력이 생긴다. 따라서, 용기 내부의 기체 분자들은 서로 충돌하며 운동하고, 용기 벽면과 충돌하여 압력을 만든다. 이 때, 용기 내부의 기체 분자들은 평형상태를 이루며, 용기 내부의 압력은 일정하다.
- "ㄱ, ㄷ" : 이상기체에서 온도는 분자의 운동에 비례하며, 압력과 부피는 반비례한다. 따라서, 온도가 일정하면 압력과 부피는 서로 반비례적으로 변화한다.
- "ㄴ, ㄹ" : 이상기체에서 분자간 상호작용이 없으므로, 기체 분자들은 서로 독립적으로 운동한다. 따라서, 용기 내부의 기체 분자들은 서로 다른 속도와 운동방향을 가지며, 이에 따라 용기 내부의 기체 분자들은 서로 충돌하며 운동한다.
20. 다음은 화합물 AB의 전자 배치를 모형으로 나타낸 것이다. 이에 대한 설명으로 옳은 것은? (단, A, B는 각각 임의의 금속, 비금속 원소이다)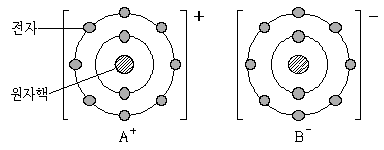
- 화합물 AB의 몰 질량은 20g/mol이다.
- 원자 A의 원자가 전자는 1개이다.
- B2는 이중 결합을 갖는다.
- 원자 반지름은 B가 A보다 더 크다.
- 화합물 AB의 전자 배치를 보면 A 원자가 1개의 전자를 잃어버려 양이온이 되었고, B 원자가 2개의 전자를 받아 음이온이 되었다. 따라서 A 원자의 전자 수는 1개이다.





