1과목: 과목 구분 없음
1. 계의 엔트로피가 증가하는 과정은?
- Ag+(aq)+Cl-(aq)→AgCl(s)
- 4Fe(s)+3O2(g)→2Fe2O3(s)
- HCl(g)+NH3(g)→NH4Cl(s)
- 2SO3(g)→2SO2(g)+O2(g)
2. CN-이온의 루이스 구조에서 N의 형식 전하는?
- 0
- +1
- +2
- +3
- CN- 이온은 N이 형식 전하는 수를 3으로 가지고 있습니다. 이유는 C이온이 4개의 전자를 가지고 있고, N이온이 3개의 전자를 가지고 있기 때문입니다. 따라서 N은 3개의 전자를 C와 공유하여 3개의 공유결합을 형성하고 있습니다. 이에 따라 N의 형식 전하는 수는 3입니다. 따라서 정답은 "0"입니다.
3. 그림에서 설명하는 분자간 힘은?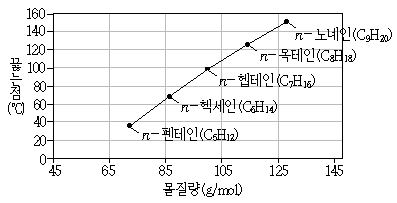
- 쌍극자-쌍극자 힘
- 이온-쌍극자 힘
- 수소 결합
- 분산력
- 그림에서 보이는 분자들은 서로 극성을 가지고 있어 분산력이 발생합니다. 분산력은 분자들의 전자가 서로 인접한 분자의 전자와 상호작용하여 발생하는 힘으로, 분자간 거리가 가까워질수록 강해집니다. 따라서 이 그림에서 설명하는 분자간 힘은 "분산력"입니다. 쌍극자-쌍극자 힘은 극성 분자들 간의 힘이며, 이온-쌍극자 힘은 이온과 극성 분자 간의 힘, 수소 결합은 수소와 극성 분자 간의 힘을 의미합니다.
4. 다음 중 화학 결합의 종류가 다른 것은?
- 염화 소듐(NaCl)
- 물(H2O)
- 일염화 아이오딘(ICl)
- 암모니아(NH3)
- 염화 소듐(NaCl)은 이온결합, 나머지는 공유결합이다. 이온결합은 전자 기부와 수용체의 전자 수용으로 이루어지는 결합이고, 공유결합은 원자간 전자공유로 이루어지는 결합이다.
5. 다음 화합물의 수용액이 산성인 것만을 모두 고른 것은?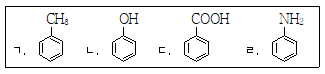
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄴ, ㄹ
- ㄷ, ㄹ
- 주어진 화합물들 중 산성을 띄는 화합물은 HCl과 HNO3이다. 이들은 수용액에 녹으면 H+ 이온을 방출하여 산성을 띄게 된다. 따라서, HCl과 HNO3이 포함된 "ㄴ, ㄷ"이 정답이다.
6. 원자가 껍질 전자쌍 반발(VSEPR) 이론에 의한 ClO3+이온의 기하학적 구조는?
- 굽은형
- 정사면체
- 삼각 평면
- 평면 사각형
- ClO3+이온은 중앙에 Cl 원자가 있고 주위에 세 개의 O 원자가 붙어있다. 이 때, Cl 원자는 3개의 O 원자와 결합하여 전자쌍을 공유하고 있으며, 이 전자쌍들은 모두 Cl 원자 주위에 분포하고 있다. 따라서 ClO3+이온의 전자쌍 배치는 삼각 평면 형태를 띄게 된다. 이는 VSEPR 이론에 따라 전자쌍들이 가능한 한 멀리 떨어져 위치하려는 경향 때문이다.
7. 일양성자 산 1.0M HA용액의 H+농도[M]는? (단, 약산 HA의 산 해리 상수 Kα=4.0×10-10이다)
- 2.0×10-5
- 4.0×10-5
- 2.0×10-10
- 4.0×10-10
- 일양성자 산 HA의 산해리상수 Kα=4.0×10-10이므로,
Kα=[H+][A-]/[HA]
여기서, [A-]/[HA]는 HA용액의 농도가 1.0M이므로 1이라고 볼 수 있다.
따라서,
Kα=[H+]/1.0
[H+]=Kα×1.0=4.0×10-10×1.0=4.0×10-10
따라서, HA용액의 H+농도는 4.0×10-10M이다.
하지만, 문제에서는 소수점 아래 한자리까지만 답을 요구하고 있으므로,
4.0×10-10M=0.0000000004M=4.0×10-11×10M=2.0×10-5M
따라서, 정답은 "2.0×10-5"이다.
8. 다음 전자 배치에 해당하는 원자들에 대한 설명으로 옳은 것만을 모두 고른 것은?
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
- - ㄱ: 수소 (H) 원자는 1개의 전자를 가지고 있으며, 1번 주기에 위치하고 있다.
- ㄴ: 헬륨 (He) 원자는 2개의 전자를 가지고 있으며, 1번 주기에 위치하고 있다.
- ㄷ: 리튬 (Li) 원자는 3개의 전자를 가지고 있으며, 2번 주기에 위치하고 있다.
따라서, ㄱ, ㄴ, ㄷ 모두 옳은 설명이다.
9. 다음 반응식에서 각 반응물의 농도를 달리하며 초기 반응 속도를 측정하여 아래 표와 같은 결과를 얻었다. (단, 반응 온도는 일정하다) 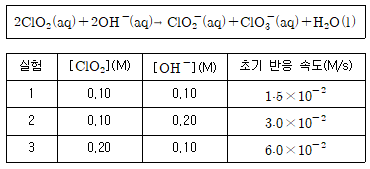
위 반응의 속도 법칙은?
- k[ClO2][OH-]
- k[ClO2]2[OH-]
- k[ClO2][OH-]2
- k[ClO2]2[OH-]2
- 반응식에서 ClO2와 OH-의 지수합이 각각 1이므로 1차 반응으로 추론할 수 있다. 따라서 속도 법칙은 k[ClO2][OH-]가 되며, 실험 결과에서 ClO2의 농도를 고정시키고 OH-의 농도를 변화시켰을 때 초기 반응 속도가 제곱에 비례하는 것을 확인할 수 있다. 따라서 반응 속도는 k[ClO2]의 일차식과 [OH-]의 제곱에 비례하므로, 속도 법칙은 k[ClO2]2[OH-]가 된다. 따라서 정답은 "k[ClO2]2[OH-]"이다.
10. 이산화 탄소(CO2)가 127℃에서 300m/s의 평균 속력으로 움직인다면 1327℃에서의 CO2의 평균 속력[m/s]은? (단, CO2는 두 온도에서 이상 기체의 거동을 보인다고 가정한다)
- 1200
- 900
- 600
- 300
- 이상 기체의 거동을 보이는 CO2의 경우, 온도가 증가하면 분자의 평균 속력이 증가한다. 이는 다음과 같은 식으로 나타낼 수 있다.
v = √(3kT/m)
여기서 v는 분자의 평균 속력, k는 볼츠만 상수, T는 온도, m은 분자의 질량을 나타낸다.
따라서, 127℃에서의 CO2의 평균 속력은 다음과 같다.
v1 = √(3k(127+273)/44) ≈ 300m/s
1327℃에서의 CO2의 평균 속력은 다음과 같다.
v2 = √(3k(1327+273)/44) ≈ 600m/s
따라서, 정답은 "600"이다.
11. 다음 산-염기 반응에 대한 설명으로 옳은 것은?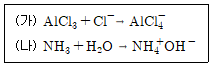
- (가)에서 AlCl3는 아레니우스 산이다.
- (가)에서 Cl-는 루이스 산이다.
- (나)에서 NH3는 루이스 산이다.
- (나)에서 H2O는 브뢴스테드-로우리 산이다.
- 산-염기 반응에서 산은 양성자(H+)를 기부하고, 염기는 음성자(OH-)를 기부합니다. 이 반응에서 AlCl3는 양이온으로 작용하여 양성자를 기부하므로 아레니우스 산입니다. NH3은 루이스 염기로서, H+를 받아들일 수 있는 자유 전자쌍을 가지고 있으므로 루이스 산입니다. H2O는 브론스테드-로우리 산으로서, H+를 기부할 수 있습니다. 따라서, H2O는 양성자를 기부할 수 있는 브론스테드-로우리 산입니다. Cl-는 염기가 아니므로 루이스 산이 아닙니다.
12. 질소 산화물에 대한 설명으로 옳은 것만을 모두 고른 것은?
- ㄱ, ㄷ
- ㄱ, ㄹ
- ㄴ, ㄷ
- ㄴ, ㄹ
- 질소 산화물은 질소와 산소가 결합한 화합물로, 대표적으로 NO, NO2, N2O 등이 있다. 이 중 NO는 대기 중에서 자연적으로 발생하며, 대기오염의 주요 원인 중 하나이다. NO2는 대기 중에서 광화학 반응에 의해 생성되며, 대기오염물질 중 하나이다. 따라서 "ㄴ, ㄷ"가 정답이다.
13. 수산화 소듐(NaOH) 4g을 물에 녹여 200mL의 수산화 소듐 수용액을 만들었다. 이 수용액 20mL를 0.25M HCl로 중화하는데 필요한 HCl의 부피[mL]는? (단, NaOH의 몰질량은 40g/mol이다)
- 20
- 40
- 60
- 80
- NaOH의 몰질량이 40g/mol이므로 4g의 NaOH는 0.1 mol이다. 따라서 200mL의 수용액은 0.1 M의 NaOH 수용액이다. 중화 반응식은 NaOH + HCl → NaCl + H2O 이므로 1 mol의 NaOH를 중화하기 위해서는 1 mol의 HCl이 필요하다. 따라서 20mL의 0.1 M NaOH 수용액을 중화하기 위해서는 0.01 mol의 HCl이 필요하다. HCl의 몰농도가 0.25 M이므로 0.01 mol의 HCl을 얻기 위해서는 0.04 L, 즉 40 mL의 HCl이 필요하다. 따라서 정답은 "40"이다.
14. 커피에서 카페인을 초임계 추출할 때 용매로 사용되는 이산화 탄소의 상을 다음 상도표에서 고르면?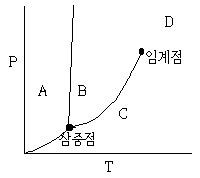
- A
- B
- C
- D
- 이산화 탄소는 상온에서 기체 상태이며, 초임계 상태에서는 액체와 기체의 중간 상태인 초임계 유체 상태가 됩니다. 따라서, 이산화 탄소의 상은 "D"인 초임계 유체입니다.
15. 그림과 같이 아연(Zn)판을 황산구리(CuSO4) 수용액에 넣었을 때 일어나는 반응에 대한 설명으로 옳은 것만을 모두 고른 것은?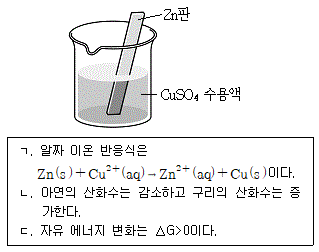
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- - 아연(Zn)은 황산구리(CuSO4) 수용액에 녹지 않는다. (X)
- 아연(Zn)은 황산구리(CuSO4) 수용액에 녹는다. (O)
- 아연(Zn)은 황산구리(CuSO4) 수용액에 반응하여 황색의 구리침(Cu)이 생긴다. (O)
- 아연(Zn)은 황산구리(CuSO4) 수용액에 반응하여 녹색의 구리침(Cu)이 생긴다. (X)
정답: "ㄱ, ㄴ"
아연은 화학적으로 구리보다 활성도가 높기 때문에 황산구리 수용액에 아연을 넣으면 화학 반응이 일어나면서 아연이 구리 이온(Cu2+)을 대체하게 된다. 이 과정에서 아연은 이온화되어 Zn2+ 이온이 되고, 구리 이온은 환원되어 구리침(Cu)이 생긴다. 이때 생기는 구리침은 황색이므로 "ㄱ"이 옳고, 아연은 녹색의 구리침을 만들지 않으므로 "ㄴ"은 틀린 설명이다.
16. 산화-환원 반응이 아닌 것은?
- 2Mg(s)+O2(g)→2MgO(s)
- 4KNO3(s)→2K2O(s)+2N2(g)+5O2(g)
- NaHSO4(aq)+NaOH(aq)→Na2SO4(aq)+H2O(l)
- Fe(s)+Ni(NO3)2(aq)→Fe(NO3)2(aq)+Ni(s)
- NaHSO4(aq)+NaOH(aq)→Na2SO4(aq)+H2O(l)은 산화-환원 반응이 아니다. 이 반응에서는 어떤 원자도 전자를 잃거나 얻지 않고 산소도 추가되거나 제거되지 않는다. 대신, NaHSO4와 NaOH가 반응하여 Na2SO4와 H2O로 변한다. 이러한 반응은 산염기와 산이 반응하여 염과 물을 생성하는 중화 반응이다.
17. 일정한 온도에서 1atm의 H2 2L, 2atm의 O2 3L, 3atm의 N2 4L를 10L의 밀폐된 용기에 넣었을 때의 전체 압력[atm]은? (단, 세 기체는 서로 반응하지 않는 이상 기체라고 가정한다)
- 1
- 2
- 3
- 4
- 각 기체의 압력을 구하려면 이상기체 상태방정식을 이용할 수 있다.
PV = nRT
여기서 P는 압력, V는 부피, n은 몰수, R은 기체상수, T는 절대온도이다.
각 기체의 몰수를 구하기 위해 부피를 몰부피로 변환해야 한다.
H2 : n = PV/RT = (1atm x 2L)/(0.0821 L·atm/mol·K x 273K) = 0.095 mol
O2 : n = PV/RT = (2atm x 3L)/(0.0821 L·atm/mol·K x 273K) = 0.172 mol
N2 : n = PV/RT = (3atm x 4L)/(0.0821 L·atm/mol·K x 273K) = 0.286 mol
따라서 전체 몰수는 0.095 mol + 0.172 mol + 0.286 mol = 0.553 mol 이다.
전체 부피는 10L 이므로 전체 몰수에 대한 전체 압력은 다음과 같다.
P = nRT/V = (0.553 mol x 0.0821 L·atm/mol·K x 273K)/10L = 1.2 atm
따라서 정답은 "2" 이다.
18. 아래 그림은 반응 경로에 따른 에너지 변화를 나타낸 것이다. 이 때 옳은 것만을 모두 고른 것은?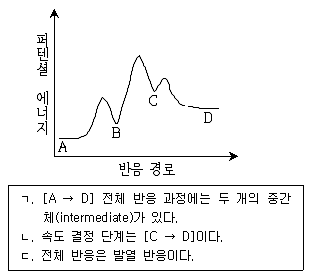
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- 정답은 "ㄱ"이다. 이유는 반응 경로에서 에너지가 가장 적게 필요한 경로가 "A → C → D" 경로이기 때문이다. 이 경로에서는 활성화 에너지가 가장 적으며, 따라서 반응이 빠르게 일어날 수 있다. "ㄷ"는 "A → B → D" 경로에서 활성화 에너지가 높기 때문에 옳지 않다. "ㄱ, ㄴ"은 "A → C → E → D" 경로에서 활성화 에너지가 높기 때문에 옳지 않다. "ㄴ, ㄷ"는 "A → B → E → D" 경로에서 활성화 에너지가 높기 때문에 옳지 않다.
19. 바닥 상태인 2주기 원소 X, Y의 홀전자(unpaired electron) 수는 같고, 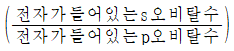 값이 X=1, Y=2/3이다. 이에 대한 설명으로 옳은 것은?
값이 X=1, Y=2/3이다. 이에 대한 설명으로 옳은 것은?
- 원자가 전자(valence electron)수는 X가 Y보다 많다.
- 유효 핵전하는 X가 Y보다 크다.
- 원소 Y가 수소(H)와 결합한 화합물은 YH3이다.
- 화합물 XY2는 직선형이다.
- 정답은 "화합물 XY2는 직선형이다." 이다.
이유는 다음과 같다.
- 원자가 전자(valence electron)수는 X가 Y보다 많다: 문제에서 X와 Y의 홀전자 수가 같다고 했기 때문에 이는 옳지 않은 설명이다.
- 유효 핵전하는 X가 Y보다 크다: 문제에서 유효 핵전하는 값이 X=1, Y=2/3이므로 이는 옳지 않은 설명이다.
- 원소 Y가 수소(H)와 결합한 화합물은 YH3이다: 이는 문제와 관련이 없는 설명이다.
- 화합물 XY2는 직선형이다: 문제에서 X와 Y의 홀전자 수가 같고, 유효 핵전하는 값이 X=1, Y=2/3이므로 이를 만족하는 화합물은 XY2이다. 이 화합물은 직선형 분자 구조를 가지게 된다.
20. 다음 반응식의 균형을 맞추었을 때, H2O의 계수는?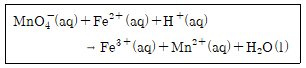
- 2
- 3
- 4
- 6
- 이 반응식에서 산화제인 K2Cr2O7가 환원제인 FeSO4에 전자를 양도하면서 Cr6+이 Cr3+으로 환원되고, Fe2+가 Fe3+으로 산화되는 것을 알 수 있습니다. 이때, Cr2O7의 산화수가 6에서 3으로 감소하므로 1분자당 전자 6개가 전달되어야 합니다. FeSO4의 경우, 1분자당 전자 1개가 받아들여지므로, Cr2O7과 FeSO4의 계수 비율은 6:1이 됩니다. 이를 위해 Cr2O7에 6을, FeSO4에 1을 곱해주면, Cr2O7 + FeSO4 → Cr2(SO4)3 + Fe2(SO4)3 + H2O의 계수는 각각 6, 6, 3이 됩니다. 이때, H2O의 계수는 3으로 나누어도 되지만, 최소공배수인 6으로 나누어주면 모든 계수가 정수가 되므로, H2O의 계수는 4가 됩니다. 따라서 정답은 4입니다.






2SO3(g)→2SO2(g)+O2(g)는 분자 수가 변하지 않지만, SO3 분자는 선형 분자이고 SO2 분자는 굽은 형태를 띄므로 분자의 무질서도가 증가합니다. 따라서 이 과정은 엔트로피가 증가하는 과정입니다.