1과목: 과목 구분 없음
1. 다음 중 산화-환원 반응이 아닌 것은?
- 2Al+6HCl→3H2+2AlCl3
- 2H2O→2H2+O2
- 2NaCl+Pb(NO3)2→PbCl2+2NaNO3
- 2NaI+Br2→2NaBr+I2
2. 주기율표에서 원소들의 주기적 경향성을 설명한 내용으로 옳지 않은 것은?
- Al의 1차 이온화 에너지가 Na의 1차 이온화 에너지보다 크다.
- F의 전자 친화도가 O의 전자 친화도보다 더 큰 음의 값을 갖는다.
- K의 원자 반지름이 Na의 원자 반지름보다 작다.
- Cl의 전기음성도가 Br의 전기음성도보다 크다.
3. 온도와 부피가 일정한 상태의 밀폐된 용기에 15.0mol의 O2와 25.0mol의 He가 들어있다. 이 때, 전체 압력은 8.0atm이었다. O2 기체의 부분 압력[atm]은? (단, 용기에는 두 기체만 들어 있고, 서로 반응하지 않는 이상 기체라고 가정한다)
- 3.0
- 4.0
- 5.0
- 8.0
4. Al과 Br2로부터 Al2Br6가 생성되는 반응에서, 4mol의 Al과 8mol의 Br2로부터 얻어지는 Al2Br6의 최대 몰수는? (단, 가 유일한 생성물이다)
- 1
- 2
- 3
- 4
5. 이온 결합과 공유 결합에 대한 설명으로 옳지 않은 것은?
- 격자 에너지는 이온 화합물이 생성되는 여러 단계의 에너지를 서로 곱하여 계산한다.
- 이온의 공간 배열이 같을 때, 격자 에너지는 이온 반지름이 감소할수록 증가한다.
- 공유 결합의 세기는 결합 엔탈피로부터 측정할 수 있다.
- 공유 결합에서 두 원자 간 결합수가 증가함에 따라 두 원자 간 평균 결합 길이는 감소한다.
6. 0.100M의 NaOH수용액 24.4mL를 중화하는데 H2SO4수용액 20.0mL를 사용하였다. 이 때, 사용한 H2SO4수용액의 몰 농도는?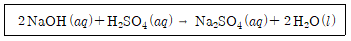
- 0.0410
- 0.0610
- 0.122
- 0.244
7. 다음 반응은 500°C에서 평형 상수 K=48이다. 
같은 온도에서 10L 용기에 H2 0.01mol, I2 0.03mol, HI 0.02mol로 반응을 시작하였다. 이 때, 반응 지수 Q의 값과 평형을 이루기 위한 반응의 진행 방향으로 옳은 것은?
- Q=1.3, 왼쪽에서 오른쪽
- Q=13, 왼쪽에서 오른쪽
- Q=1.3, 오른쪽에서 왼쪽
- Q=13, 오른쪽에서 왼쪽
8. 다음 알코올 중 산화 반응이 일어날 수 없는 것은?
9. 다음은 어떤 갈바니 전지(또는 볼타 전지)를 표준 전지 표시법으로 나타낸 것이다. 이에 대한 설명으로 옳은 것은?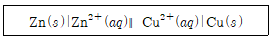
- 단일 수직선(|)은 염다리를 나타낸다.
- 이중 수직선(
 ) 왼쪽이 환원 전극 반쪽 전지이다.
) 왼쪽이 환원 전극 반쪽 전지이다. - 전지에서 CU2+는 전극에서 Cu로 환원된다.
- 전자는 외부 회로를 통해 환원 전극에서 산화 전극으로 흐른다.
10. 다음은 25℃, 수용액 상태에서 산의 세기를 비교한 것이다. 옳은 것만을 모두 고른 것은?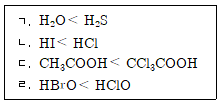
- ㄱ, ㄴ
- ㄷ, ㄹ
- ㄱ, ㄷ, ㄹ
- ㄴ, ㄷ, ㄹ
11. 화석 연료는 주로 탄화수소(CnH2n+2)로 이루어지며, 소량의 황, 질소 화합물을 포함하고 있다. 화석 연료를 연소하여 에너지를 얻을 때, 연소 반응의 생성물 중에서 산성비 또는 스모그의 주된 원인이 되는 물질이 아닌 것은?
- CO2
- SO2
- NO
- NO2
12. 다음 원자들에 대한 설명으로 옳은 것은? (순서대로 원자 번호, 양성자 수, 전자 수, 중성자 수, 질량수)
13. 다음 화학 반응식을 균형 맞춘 화학 반응식으로 만들었을 때, 얻어지는 계수 a, b, c, d의 합은? (단, a, b, c, d는 최소 정수비를 가진다)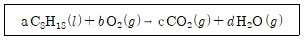
- 60
- 61
- 62
- 63
14. 다음은 중성 원자 A~D의 전자 배치를 나타낸 것이다. A~D에 대한 설명으로 옳은 것은? (단, A~D는 임의의 원소 기호이다)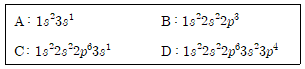
- A는 바닥 상태의 전자 배치를 가지고 있다.
- B의 원자가 전자 수는 4개이다.
- C의 홀전자 수는 D의 홀전자 수보다 많다.
- C의 가장 안정한 형태의 이온은 C+이다.
15. 메테인(CH4)과 에텐(C2H4)에 대한 설명으로 옳은 것은?
- ∠H-C-H의 결합각은 메테인이 에텐보다 크다.
- 메테인의 탄소는 sp2혼성을 한다.
- 메테인 분자는 극성 분자이다.
- 에텐은 Br2와 첨가 반응을 할 수 있다.
16. 0.100 M CH3COOH(Ka=1.80×10-5) 수용액 20.0mL에 0.100 M NaOH 수용액 10.0mL를 첨가한 후, 용액의 pH를 구하면? (단, log1.80=0.255이다)
- 2.875
- 4.745
- 5.295
- 7.875
17. 다음은 오존(O3)층 파괴의 주범으로 의심되는 프레온-12(CCl2F2)와 관련된 화학 반응의 일부이다. 이에 대한 설명으로 옳지 않은 것은?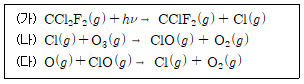
- (가) 반응을 통해 탄소(C)는 환원되었다.
- (나) 반응에서 생성되는 ClO에는 홀전자가 있다.
- 오존(O3) 분자 구조내의 π결합은 비편재화되어 있다.
- 오존(O3) 분자 구조내의 결합각 ∠O-O-O은 180°이다.
18. 몰질량이 56g/mol인 금속 M 112g을 산화시켜 실험식이 MxOy인 산화물 160g을 얻었을 때, 미지수 x, y를 각각 구하면? (단, O의 몰질량은 16g/mol이다)
- x=2, y=3
- x=3, y=2
- x=1, y=5
- x=1, y=2
19. H2와 ICl이 기체상에서 반응하여 I2와 HCl을 만든다. 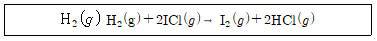
이 반응은 다음과 같이 두 단계 메커니즘으로 일어난다. 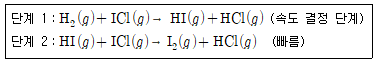
전체 반응에 대한 속도 법칙으로 옳은 것은?
- 속도=k[H2][ICl]2
- 속도=k[HI][ICl]2
- 속도=k[H2][ICl]
- 속도=k[HI][ICl)
20. 다음 화합물들에 대한 설명으로 옳은 것은?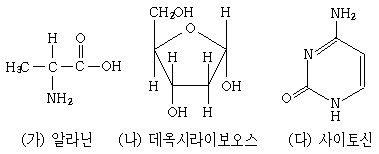
- (가)는 뉴클레오타이드를 구성하는 기본 단위이다.
- (가)는 브뢴스테드-로우리 산과 염기로 모두 작용할 수 있다.
- (나)는 단백질을 구성하는 기본 단위이다.
- 데옥시라이보핵산(DNA)에서 (다)는 인산과 직접 연결되어 있다.






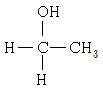
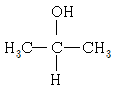
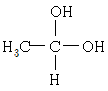
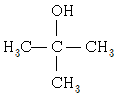
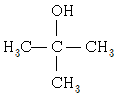 "이다. 이것은 알코올이 아니라 알데하이드이기 때문이다. 알데하이드는 산화되지 않는다.
"이다. 이것은 알코올이 아니라 알데하이드이기 때문이다. 알데하이드는 산화되지 않는다.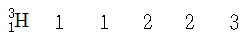
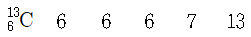
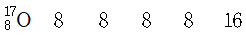

2NaCl+Pb(NO3)2→PbCl2+2NaNO3은 이중치환반응이다. Pb(NO3)2의 Pb와 NaCl의 Cl이 치환되어 PbCl2와 NaNO3가 생성된다. 산화-환원 반응은 전자의 이동으로 인해 일어나는 반응인데, 이 반응에서는 전자의 이동이 일어나지 않으므로 산화-환원 반응이 아니다.