1과목: 과목 구분 없음
1. 유효 숫자를 고려한 (13.59×6.3)÷12의 값은?
- 7.1
- 7.13
- 7.14
- 7.135
- 먼저 괄호 안의 계산을 수행하면 85.617이 나옵니다. 그러나 이 문제에서는 유효 숫자를 고려해야 합니다. 13.59와 6.3 중에서 소수점 이하 첫째 자리에서 반올림한 값은 각각 1자리입니다. 따라서 곱한 결과인 85.617도 소수점 이하 첫째 자리에서 반올림한 값인 8.6이 됩니다. 이제 이 값을 12로 나누면 7.1이 됩니다. 따라서 정답은 "7.1"입니다.
2. 다음 바닥상태의 전자 배치 중 17족 할로젠 원소는?
- 1s22s22p63s23p5
- 1s22s22p63s23p63d74s2
- 1s22s22p63s23p64s1
- 1s22s22p63s23p6
- 17족 할로젠 원소는 3p 궤도에 7개의 전자를 가지고 있습니다. 따라서 3p 궤도에 5개의 전자를 가진 1s22s22p63s23p5가 정답입니다.
3. 결합의 극성 크기 비교로 옳은 것은? (단, 전기 음성도 값은 H=2.1, C=2.5, O=3.5, F=4.0, Si=1.8, Cl=3.0이다)
- C-O > Si-O
- O-F > O-Cl
- C-H > Si-H
- C-F > Si-F
- 원자의 전기 음성도가 높을수록 결합에서 전자를 더 많이 끌어당기므로 결합극성이 커진다. 따라서, C와 Si의 전기 음성도를 비교하면 C가 더 크므로 C-H 결합의 극성이 Si-H 결합의 극성보다 크다. 따라서, "C-H > Si-H"가 옳다.
4. 샤를의 법칙을 옳게 표현한 식은? (단, V, P, T, n은 각각 이상 기체의 부피, 압력, 절대온도, 몰수이다)
- V=상수/P
- V=상수×n
- V=상수×T
- V=상수×P
- 샤를의 법칙은 "P×V=n×R×T"로 표현된다. 이 식에서 R은 기체 상수이다. 이를 V에 대해 정리하면 V=(n×R×T)/P가 된다. 이때 n×R은 상수이므로 V와 T는 비례하게 된다. 따라서 V=상수×T가 성립하게 된다.
5. 4몰의 원소 X와 10몰의 원소 Y를 반응시켜 X와 Y가 일정비로 결합된 화합물 4몰을 얻었고 2몰의 원소 Y가 남았다. 이때, 균형 맞춘 화학 반응식은?
- 4X+10Y→X4Y10
- 2X+8Y→X2Y8
- X+2Y→XY2
- 4X+10Y→4XY2
- 반응식에서 X와 Y가 일정비로 결합된 화합물을 만들었으므로, 화합물의 분자식은 XY2가 됩니다. 또한, 4몰의 화합물을 만들기 위해서는 X와 Y가 4:10의 비율로 반응해야 합니다. 따라서, 반응식은 X+2Y→XY2가 됩니다. 이 반응식에서 X와 Y의 비율은 1:2이므로, 2몰의 Y가 반응에 참여하면 1몰의 X와 결합하여 2몰의 XY2를 만들게 됩니다. 따라서, 4몰의 화합물을 만들기 위해서는 2몰의 Y가 10몰의 Y의 절반인 5몰이 더 필요합니다. 따라서, 전체 반응식은 X+2Y→XY2 (4mol) + Y (2mol) → XY2 (4mol) + Y (5mol)이 됩니다.
6. 온실 가스가 아닌 것은?
- CH4(g)
- N2(g)
- H2O(g)
- CO2(g)
- 온실 가스란 대기 중에서 태양으로부터 받은 열을 지구로 돌려보내는 기체를 말합니다. 이 중에서 N2(g)는 대기 중에서 가장 많은 기체 중 하나이지만, 온실 가스가 아닙니다. 이는 N2(g)가 분자 구조상 이중 결합을 가지지 않아서, 자외선을 흡수하지 않기 때문입니다. 따라서 N2(g)는 온실 효과를 유발하지 않습니다.
7. 용액의 총괄성에 대한 설명으로 옳은 것만을 모두 고르면?
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄹ
- ㄷ, ㄹ
- 용액의 총괄성은 용액 내의 이온들이 서로 상호작용하여 용액 전체의 특성을 결정하는 것을 말한다.
ㄱ. "이온들이 서로 상호작용하여 용액 전체의 특성을 결정하는 것"이 총괄성의 핵심 개념이므로, 이를 설명하는 "ㄱ"은 옳다.
ㄴ. "이온들의 농도와 종류에 따라 용액의 전기적 특성이 결정된다"는 설명은 일부 맞지만, 총괄성을 설명하는 것은 아니므로 "ㄴ"은 틀린 설명이다.
ㄷ. "이온들이 서로 상호작용하여 용액 전체의 특성을 결정하는 것"이 총괄성의 핵심 개념이므로, 이를 설명하는 "ㄷ"는 옳다.
ㄹ. "용액의 총괄성은 용액 내의 이온들의 농도와 종류, 온도, 압력 등의 조건에 따라 달라질 수 있다"는 설명은 일부 맞지만, 총괄성을 설명하는 것은 아니므로 "ㄹ"은 틀린 설명이다.
8. 고분자(중합체)에 대한 설명으로 옳은 것만을 모두 고르면?
- ㄱ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
- - ㄱ. 고분자는 단량체(모노머)들이 반응하여 결합한 대형 분자이다.
- ㄴ. 고분자는 일반적으로 유연하고 끈적거리며, 높은 인장강도와 내구성을 가진다.
9. 팔전자 규칙(octet rule)을 만족시키지 않는 분자는?
- NO
- F2
- CO2
- N2
- "NO"는 팔전자 규칙을 만족시키지 않는 분자입니다. 이는 질소(N) 원자와 산소(O) 원자가 결합하여 이루어진 분자이기 때문입니다. 질소는 외곽 전자궤도에 5개의 전자를 가지고 있고, 산소는 외곽 전자궤도에 6개의 전자를 가지고 있습니다. 이들이 결합하여 "NO" 분자를 이룰 경우, 질소는 외곽 전자궤도에 7개의 전자를 가지게 되고, 산소는 외곽 전자궤도에 7개의 전자를 가지게 됩니다. 이는 팔전자 규칙을 위반하는 것이므로 "NO"는 팔전자 규칙을 만족시키지 않는 분자입니다.
10. 수용액에서 HAuCl4(s)를 구연산(citric acid)과 반응시켜 금 나노입자 Au(s)를 만들었다. 이에 대한 설명으로 옳은 것만을 모두 고르면?
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄴ, ㄹ
- - 금 나노입자는 구연산이 환원제로 작용하여 Au3+ 이온을 Au(s)로 환원시키면서 생성된다. 따라서 "ㄴ"은 옳다.
- 반응식은 3HAuCl4 + C6H8O7 → Au(s) + 3H+ + 3Cl- + 6CO2이다. 이 반응에서 구연산은 금 이온을 환원시키는 역할을 하기 때문에 "ㄷ"도 옳다.
- "ㄱ"은 옳지 않다.
- "ㄹ"은 금 나노입자의 크기와 관련된 내용이므로 이 문제와는 직접적인 연관성이 없다.
11. 전해질(electrolyte)에 대한 설명으로 옳은 것은?
- 물에 용해되어 이온 전도성 용액을 만드는 물질을 전해질이라 한다.
- 설탕(C12H22O11)을 증류수에 녹이면 전도성 용액이 된다.
- 아세트산(CH3COOH)은 KCl보다 강한 전해질이다.
- NaCl 수용액은 전기가 통하지 않는다.
- 전해질은 물에 용해되어 이온 전도성 용액을 만드는 물질이다. 이온 전도성 용액은 전기가 통하는 용액을 말한다. 따라서 "물에 용해되어 이온 전도성 용액을 만드는 물질을 전해질이라 한다."가 옳은 설명이다. 나머지 보기는 모두 틀린 설명이다.
12. CH2O(g)+O2(g)→CO2(g)+H2O(g) 반응에 대한 △H°값[kJ]은?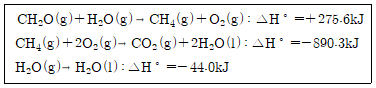
- -658.7
- -614.7
- -570.7
- -526.7
- 이 문제는 엔탈피 변화(△H°)를 구하는 문제입니다.
먼저, 주어진 반응식을 균형 상태로 만들어줍니다.
CH2O(g) + O2(g) → CO2(g) + H2O(g)
이 반응식에서 계수를 고려하여 각 물질의 엔탈피 변화를 더해줍니다.
△H° = [△H°(CO2)] + [△H°(H2O)] - [△H°(CH2O)] - [△H°(O2)]
여기서, △H°(CO2)와 △H°(H2O)는 각각 표준 생성 엔탈피(standard enthalpy of formation) 값으로 대체할 수 있습니다.
△H°(CO2) = -393.5 kJ/mol
△H°(H2O) = -241.8 kJ/mol
하지만, CH2O와 O2는 원소 상태이므로 표준 생성 엔탈피 값이 없습니다. 따라서, 이들의 엔탈피 변화를 다른 방법으로 구해야 합니다.
여기서는 이들의 평균 분자간 엔탈피를 사용합니다.
△H°(CH2O) = -166 kJ/mol
△H°(O2) = 0 kJ/mol
따라서,
△H° = [-393.5 kJ/mol + (-241.8 kJ/mol)] - [-166 kJ/mol + 0 kJ/mol] = -526.7 kJ
따라서, 정답은 "-526.7"입니다.
13. 다음 열화학 반응식에 대한 설명으로 옳지 않은 것은?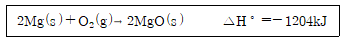
- 산-염기 중화 반응
- 결합 반응
- 산화-환원 반응
- 발열 반응
- 이 반응은 산과 염기가 서로 중화되어 염과 물을 생성하는 "산-염기 중화 반응"이다. 이 반응에서는 산성 수소 이온(H+)과 염기성 수산화물(OH-)이 결합하여 물(H2O)을 생성하고, 이어서 양이온과 음이온이 결합하여 염을 생성한다. 따라서 "결합 반응", "산화-환원 반응", "발열 반응"은 이 반응과 관련이 없다.
14. 화학 반응 속도에 영향을 주는 인자가 아닌 것은?
- 반응 엔탈피의 크기
- 반응 온도
- 활성화 에너지의 크기
- 반응물들의 충돌 횟수
- 반응 엔탈피의 크기는 반응물들이 반응하여 생성되는 생성물들의 엔탈피와 반응물들의 엔탈피의 차이를 나타내는 값이다. 따라서 반응 엔탈피의 크기는 반응물들이 충돌하여 반응하는 속도나 활성화 에너지와는 직접적인 연관성이 없다. 따라서 "반응 엔탈피의 크기"가 영향을 주는 인자가 아니다.
15. 다음 그림은 NOCl2(g)+NO(g)→2NOCl(g) 반응에 대하여 시간에 따른 농도 [NOCl2]와 [NOCl]를 측정한 것이다. 이에 대한 설명으로 옳은 것만을 모두 고르면?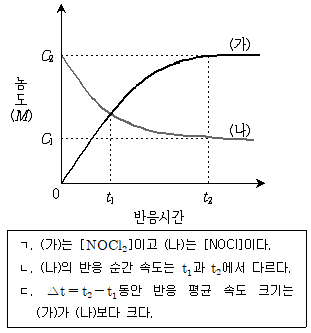
- ㄱ
- ㄴ
- ㄷ
- ㄴ, ㄷ
- ① 초기 농도 [NOCl2]가 [NOCl]보다 높았기 때문에 반응 초기에는 [NOCl2]가 빠르게 감소하고 [NOCl]가 빠르게 증가한다. ② 반응이 진행됨에 따라 [NOCl2]가 감소하면서 [NOCl]의 생성 속도도 감소하게 되어 [NOCl]의 증가 속도가 느려진다. ③ 반응이 일정 시간 이후에는 [NOCl2]와 [NOCl]의 농도가 일정한 값을 유지하게 된다. ㄴ. 반응 속도 상수는 반응물 농도에 따라 달라지지 않는다. ㄷ. 반응 초기에는 [NOCl2]가 빠르게 감소하고 [NOCl]가 빠르게 증가하므로, 초기 반응 속도는 [NOCl2]의 변화율에 따라 결정된다.
16. 다음 설명 중 옳지 않은 것은?
- CH4는 사면체 분자이며 C의 혼성오비탈은 sp3이다.
- NH3는 삼각뿔형 분자이며 N의 혼성오비탈은 sp3이다.
- XeF2는 선형 분자이며 Xe의 혼성오비탈은 sp이다.
- CO2는 선형 분자이며 C의 혼성오비탈은 sp이다.
- 이거 답 sp가아니라 sp^3d 결합입니다.
- XeF2는 선형 분자이며 Xe의 혼성오비탈은 sp이다. (옳은 설명)
이유: XeF2는 Xe와 F가 결합한 분자로, Xe는 8개의 전자를 가지고 있으므로 2개의 F와 결합하여 전자쌍 3쌍을 가진다. 이때 Xe의 전자구성은 5s25p6인데, 이전자들은 5s, 5px, 5py, 5pz 오비탈에 존재한다. 이들 오비탈 중 5s와 5px, 5py 오비탈은 3쌍의 전자쌍을 가진 F와 결합하여 혼성오비탈을 형성하게 되고, 이 혼성오비탈은 sp 형태를 띈다. 따라서 XeF2는 선형 분자이며 Xe의 혼성오비탈은 sp이다.
17. KMnO4에서 Mn의 산화수는?
- +1
- +3
- +5
- +7
- KMnO4에서 K의 산화수는 +1이고, O의 산화수는 -2입니다. 이를 이용하여 전체 화학식의 전하를 계산하면 다음과 같습니다.
(+1) + Mn + 4(-2) = 0
Mn의 산화수를 구하기 위해 위 식을 정리하면,
Mn = +7
따라서, KMnO4에서 Mn의 산화수는 +7입니다.
18. 구조 (가)~(다)는 결정성 고체의 단위 세포를 나타낸 것이다. 이에 대한 설명으로 옳은 것만을 모두 고르면?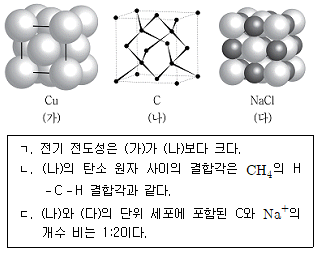
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄴ, ㄷ
- - 구조 (가)~(다)는 결정성 고체의 단위 세포를 나타낸다.
- (가)는 결정성 고체의 입자가 가장 밀집한 위치를 나타내며, (다)는 입자가 가장 드문 위치를 나타낸다.
- 따라서, (가)는 세포의 핵과 같이 입자가 가장 밀집한 위치를 나타내고, (다)는 세포막과 같이 입자가 가장 드문 위치를 나타낸다.
- 이에 따라, (ㄱ)은 세포의 핵을 나타내고, (ㄴ)은 세포막을 나타내므로, 정답은 (ㄱ, ㄴ)이다.
19. 아세트산(CH3COOH)과 사이안화수소산(HCN)의 혼합 수용액에 존재하는 염기의 세기를 작은 것부터 순서대로 바르게 나열한 것은? (단, 아세트산이 사이안화수소산보다 강산이다)
- CH3COO- < H2O < CN-
- CN- < CH3COO- < H2O
- H2O < CN- < CH3COO-
- H2O < CH3COO- < CN-
- 아세트산은 사이안화수소산보다 강산이므로, 아세트산은 HCN을 중화시킬 수 있다. 따라서, 아세트산과 HCN의 혼합 수용액에서는 아세트산이 중성화되면서 CH3COO- 이 생성된다. 이때, HCN은 약산이므로 CN- 이 생성된다. 따라서, 염기의 세기를 작은 것부터 순서대로 나열하면 "H2O < CH3COO- < CN-" 이 된다. H2O는 중성이므로 가장 세기가 작고, CH3COO-은 약염기, CN-은 강염기이므로 순서대로 나열된다.
20. 팔면체 철 착이온 [Fe(CN)6]3-, [Fe(en)3]3+, [Fe(en)2Cl2]+에 대한 설명으로 옳은 것만을 모두 고르면? (단, en은 에틸렌다이아민이고 Fe는 8족 원소이다)
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ, ㄷ
- - [Fe(CN)6]3- : 이온의 전하는 3-이다. CN-은 단면체 구조를 가지며, 이온 전체는 옥타에드럴 구조를 가진다. 이온 내부의 Fe-CN 결합은 이온 전체의 구조를 유지하는 중요한 역할을 한다.
- [Fe(en)3]3+ : 이온의 전하는 3+이다. en은 이중결합을 가진 직선 구조를 가지며, 이온 전체는 옥타에드럴 구조를 가진다. en은 이온 내부의 Fe-en 결합을 형성하는 리간드로 작용한다.
- [Fe(en)2Cl2]+ : 이온의 전하는 1+이다. 이온 전체는 사각평면 구조를 가진다. en은 이온 내부의 Fe-en 결합을 형성하는 리간드로 작용하며, Cl-는 이온 내부의 Fe-Cl 결합을 형성하는 리간드로 작용한다.
- "ㄱ" : [Fe(CN)6]3-와 [Fe(en)3]3+은 모두 옥타에드럴 구조를 가지며, 리간드로는 각각 CN-과 en을 사용한다. 하지만 전하가 다르기 때문에 이온 내부의 Fe-리간드 결합도 다르다.
- "ㄴ" : [Fe(en)3]3+와 [Fe(en)2Cl2]+은 모두 en을 리간드로 사용하지만, 전하가 다르기 때문에 이온 전체의 구조도 다르다. 전하가 다르기 때문에 이온 내부의 Fe-리간드 결합도 다르다.
- "ㄷ" : [Fe(CN)6]3-, [Fe(en)3]3+, [Fe(en)2Cl2]+ 모두 Fe를 중심으로 한 리간드 필드 이론에 따라 분석할 수 있다. 이론에 따르면, 이온 내부의 Fe-리간드 결합은 이온 전체의 구조와 성질을 결정하는 중요한 역할을 한다.






