1과목: 과목 구분 없음
1. 25℃에서 측정한 용액 A의 [OH-]가 1.0×10-6M일 때, pH값은? (단, [OH-]는 용액 내의 OH- 몰농도를 나타낸다)
- 6.0
- 7.0
- 8.0
- 9.0
2. 32g의 메테인(CH4)이 연소될 때 생성되는 물(H2O)의 질량[g]은? (단, H의 원자량은 1, C의 원자량은 12, O의 원자량은 16이며 반응은 완전연소로 100% 진행된다)
- 18
- 36
- 72
- 144
3. 원자 간 결합이 다중 공유결합으로 이루어진 물질은?
- KBr
- Cl2
- NH3
- O2
4. N2O 분해에 제안된 메커니즘은 다음과 같다. 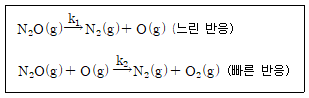
위의 메커니즘으로부터 얻어지는 전체반응식과 반응속도 법칙은?
5. 일정 압력에서 2몰의 공기를 40℃에서 80℃로 가열할 때, 엔탈피 변화(△H)[J]는? (단, 공기의 정압열용량은 20Jmol-1℃-1이다)
- 640
- 800
- 1,600
- 2,400
6. 다음은 원자 A~D에 대한 양성자 수와 중성자 수를 나타낸다. 이에 대한 설명으로 옳은 것은? (단, A~D 는 임의의 원소기호이다)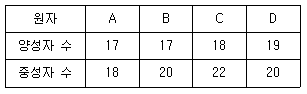
- 이온 A- 와 중성원자 C의 전자수는 같다.
- 이온 A- 와 이온 B+의 질량수는 같다.
- 이온 B- 와 중성원자 D의 전자수는 같다.
- 원자 A~D 중 질량수가 가장 큰 원자는 D이다.
7. 단열된 용기 안에 있는 25℃의 물 150g에 60℃의 금속 100g을 넣어 열평형에 도달하였다. 평형 온도가 30℃일 때, 금속의 비열[Jg-1℃-1]은? (단, 물의 비열은 4Jg-1℃-1이다)
- 0.5
- 1
- 1.5
- 2
8. 주기율표에 대한 설명으로 옳지 않은 것은?
- O2-, F-, Na+ 중에서 이온반지름이 가장 큰 것은 O2-이다.
- F, O, N, S 중에서 전기음성도는 F가 가장 크다.
- Li과 Ne 중에서 1차 이온화 에너지는 Li이 더 크다.
- Na, Mg, Al 중에서 원자반지름이 가장 작은 것은 Al이다.
9. 화합물 A2B의 질량 조성이 원소 A 60%와 원소 B 40%로 구성 될 때, AB3를 구성하는 A와 B의 질량비는?
- 10%의 A, 90%의 B
- 20%의 A, 80%의 B
- 30%의 A, 70%의 B
- 40%의 A, 60%의 B
10. 25℃ 표준상태에서 다음의 두 반쪽 반응으로 구성된 갈바니 전지의 표준 전위[V]는? (단, E°는 표준 환원 전위 값이다)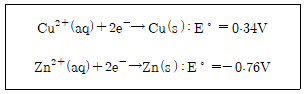
- -0.76
- 0.34
- 0.42
- 1.1
11. 반응식 P4(s)+10Cl2(g)→4PCl5(s)에서 환원제와 이를 구성하는 원자의 산화수 변화를 옳게 짝 지은 것은? (순서대로 환원제, 반응 전 산화수, 반응 후 산화수)
- P4(s), 0, +5
- P4(s), 0, +4
- Cl2(g), 0, +5
- Cl2(g), 0, -1
12. 프로페인(C3H8)이 완전연소할 때, 균형 화학 반응식으로 옳은 것은?
- C3H8(g)+3O2(g)→4CO2(g)+2H2O(g)
- C3H8(g)+5O2(g)→4CO2(g)+3H2O(g)
- C3H8(g)+5O2(g)→3CO2(g)+4H2O(g)
- C3H8(g)+4O2(g)→2CO2(g)+H2O(g)
13. 중성원자를 고려할 때, 원자가전자 수가 같은 원자들의 원자번호끼리 옳게 짝 지은 것은?
- 1, 2, 9
- 5, 6, 9
- 4, 12, 17
- 9, 17, 35
14. 물 분자의 결합 모형을 그림처럼 나타낼 때, 결합 A와 결합 B에 대한 설명으로 옳은 것은?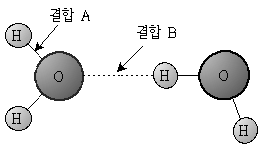
- 결합 A는 결합 B보다 강하다.
- 액체에서 기체로 상태변화를 할 때 결합 A가 끊어진다.
- 결합 B로 인하여 산소 원자는 팔전자 규칙(octet rule)을 만족한다.
- 결합 B는 공유결합으로 이루어진 모든 분자에서 관찰된다.
15. 다음 중 산화-환원 반응은?
- HCl(g)+NH3(aq)→NH4Cl(s)
- HCl(aq)+NaOH(aq)→H2O(l)+NaCl(aq)
- Pb(NO3)2(aq)+2KI(aq)→PbI2(s)+2KNO3(aq)
- Cu(s)+2Ag+(aq)→2Ag(s)+Cu2+(aq)
16. 아세트알데하이드(acetaldehyde)에 있는 두 탄소(ⓐ와 ⓑ)의 혼성 오비탈을 옳게 짝 지은 것은? (순서대로 ⓐ, ⓑ)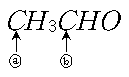
- sp3, sp2
- sp2, sp2
- sp3, sp
- sp3, sp3
17. 용액에 대한 설명으로 옳지 않은 것은?
- 용액의 밀도는 용액의 질량을 용액의 부피로 나눈 값이다.
- 용질 A의 몰농도는 A의 몰수를 용매의 부피(L)로 나눈 값이다.
- 용질 A의 몰랄농도는 A의 몰수를 용매의 질량(kg)으로 나눈 값이다.
- 1ppm은 용액 백만 g에 용질 1g이 포함되어 있는 값이다.
18. 바닷물의 염도를 1kg의 바닷물에 존재하는 건조 소금의 질량(g)으로 정의하자. 질량 백분율로 소금 3.5%가 용해된 바닷물의 염도[G/KG]는?
- 0.35
- 3.5
- 35
- 350
19. 25℃ 표준상태에서 아세틸렌(C2H2(g))의 연소열이 -1,300kJmol-1 일 때, C2H2의 연소에 대한 설명으로 옳은 것은?
- 생성물의 엔탈피 총합은 반응물의 엔탈피 총합보다 크다.
- C2H2 몰의 연소를 위해서는 1,300kJ이 필요하다.
- C2H2 몰의 연소를 위해서는 O2 5몰이 필요하다.
- 25℃의 일정 압력에서 C2H2이 연소될 때 기체의 전체 부피는 감소한다.
20. 물질 A, B, C에 대한 다음 그래프의 설명으로 옳은 것만을 모두 고르면?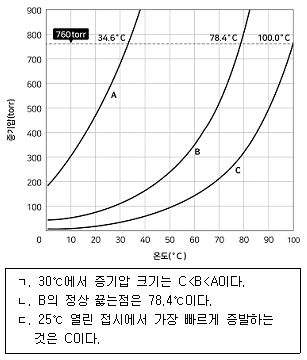
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ






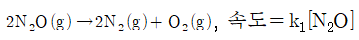
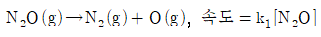
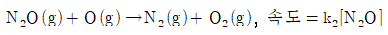
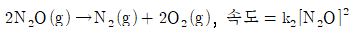
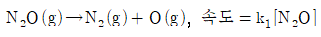 "이다.
"이다.
pH + pOH = 14
따라서, pOH = 14 - pH 이다.
[OH-]와 pOH는 다음과 같은 관계식을 가진다.
[OH-] = 10^-pOH
따라서, [OH-] = 10^-6 이므로, pOH = 6이다.
따라서, pH = 14 - pOH = 14 - 6 = 8.0 이다.