1과목: 과목 구분 없음
1. 다음 물질 변화의 종류가 다른 것은?
- 물이 끓는다.
- 설탕이 물에 녹는다.
- 드라이아이스가 승화한다.
- 머리카락이 과산화 수소에 의해 탈색된다.
- 머리카락이 과산화 수소에 의해 탈색되는 것은 화학적인 변화이고, 나머지는 물리적인 변화이다. 과산화 수소는 머리카락의 색소를 분해시켜 탈색시키는 화학물질이다.
2. 용액의 총괄성에 해당하지 않는 현상은?
- 산 위에 올라가서 끓인 라면은 설익는다.
- 겨울철 도로 위에 소금을 뿌려 얼음을 녹인다.
- 라면을 끓일 때 스프부터 넣으면 면이 빨리 익는다.
- 서로 다른 농도의 두 용액을 반투막을 사용해 분리해 놓으면 점차 그 농도가 같아진다.
- 정답: "산 위에 올라가서 끓인 라면은 설익는다."
이유: 이 현상은 용액의 총괄성과는 관련이 없는 현상이다. 산 위에서 라면을 끓이면 기압이 낮아져 물의 끓는 온도가 낮아지기 때문에 라면이 끓이기 어렵고, 그 결과 면이 덜 익어 설익는 것이다.
3. 강철 용기에서 암모니아(NH3) 기체가 질소(N2) 기체와 수소 기체(H2)로 완전히 분해된 후의 전체 압력이 900 mmHg이었다. 생성된 질소와 수소 기체의 부분 압력[mmHg]을 바르게 연결한 것은? (단, 모든 기체는 이상 기체의 거동을 한다)
- 질소 기체: 200, 수소 기체: 700
- 질소 기체: 225, 수소 기체: 675
- 질소 기체: 250, 수소 기체: 650
- 질소 기체: 275, 수소 기체: 625
- 암모니아 기체가 질소와 수소로 완전히 분해되었으므로, 암모니아 기체의 몰 수와 생성된 질소와 수소 기체의 몰 수는 같다. 따라서, 생성된 질소와 수소 기체의 몰 수는 각각 암모니아 기체의 몰 수의 절반이다.
전체 압력이 900 mmHg이므로, 생성된 질소와 수소 기체의 부분 압력의 합은 900 mmHg이다. 따라서, 생성된 질소와 수소 기체의 부분 압력은 각각 450 mmHg이다.
생성된 질소와 수소 기체의 몰 수가 같으므로, 생성된 질소와 수소 기체의 부분 압력은 몰 분율과 비례한다. 따라서, 생성된 질소와 수소 기체의 몰 분율이 각각 1/3과 2/3이 되도록 부분 압력을 나누어 주면 된다.
생성된 질소 기체의 부분 압력은 450 mmHg × 1/3 = 150 mmHg이다. 따라서, 질소 기체의 부분 압력은 450 mmHg - 150 mmHg = 300 mmHg이다.
생성된 수소 기체의 부분 압력은 450 mmHg × 2/3 = 300 mmHg이다. 따라서, 수소 기체의 부분 압력은 450 mmHg - 300 mmHg = 150 mmHg이다.
따라서, 정답은 "질소 기체: 225, 수소 기체: 675"이다.
4. 다음은 일산화 탄소(CO)와 수소(H2)로부터 메탄올(CH3OH)을 제조하는 반응식이다. [ CO(g)+2H2(g) → CH3OH(l) ] 일산화 탄소 280 g과 수소 50 g을 반응시켜 완결하였을 때, 생성된 메탄올의 질량[g]은? (단, C, H, O의 원자량은 각각 12, 1, 16이다)
- 330
- 320
- 290
- 160
- 반응식에서 일산화 탄소 1 몰과 수소 2 몰이 반응하여 메탄올 1 몰이 생성된다. 따라서, 일산화 탄소 280 g은 몰로 환산하여 7.5 몰, 수소 50 g은 몰로 환산하여 49.5 몰이 된다. 이 중에서 수소가 한정물이므로, 수소의 몰 수에 맞추어 반응이 진행되어 49.5 몰의 수소가 모두 반응하면 일산화 탄소는 24.75 몰이 남게 된다. 이때 생성된 메탄올의 몰 수는 수소와 같은 49.5 몰이 된다. 메탄올의 몰 질량은 32 g/mol 이므로, 생성된 메탄올의 질량은 49.5 몰 x 32 g/mol = 1584 g 이다. 하지만 일산화 탄소가 280 g만 사용되었으므로, 생성된 메탄올의 질량은 280 g x (49.5 몰 / 24.75 몰) = 560 g 이다. 따라서, 정답은 320이 아닌 560이다.
5. 주족 원소의 주기적 성질에 대한 설명으로 옳은 것만을 모두 고르면?
- ㄱ, ㄴ
- ㄱ, ㄹ
- ㄴ, ㄷ
- ㄱ, ㄷ, ㄹ
- 이미지에서 보이는 원소들은 주기율표의 3주기에 해당하는 원소들입니다. 따라서 주기적 성질을 가지고 있으며, 이 중에서도 "ㄱ"인 원소들은 전기음성도가 감소하고, 산성 산화물의 산성도가 증가하며, 금속성이 증가하는 경향을 보입니다. 반면에 "ㄹ"인 원소들은 전기음성도가 증가하고, 산성 산화물의 산성도가 감소하며, 비금속성이 증가하는 경향을 보입니다. 따라서 "ㄱ, ㄹ"이 옳은 정답입니다.
6. 다음 화합물 중 무극성 분자를 모두 고른 것은?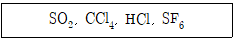
- SO2, CCl4
- SO2, HCl
- HCl, SF6
- CCl4, SF6
- 무극성 분자는 전하가 균일하게 분포되어 있어서 극성 결합들의 벡터 합이 0이 되는 분자를 말한다. CCl4은 탄소가 중심이 되어 4개의 클로로가 분포되어 있어서 극성 결합들의 벡터 합이 0이 되어 무극성 분자이다. SF6은 황이 중심이 되어 6개의 플루오르가 분포되어 있어서 극성 결합들의 벡터 합이 0이 되어 무극성 분자이다. 따라서 정답은 "CCl4, SF6"이다.
7. 탄소(C), 수소(H), 산소(O)로 이루어진 화합물 X 23 g을 완전 연소시켰더니 CO2 44 g과 H2O 27 g이 생성되었다. 화합물 X의 화학식은? (단, C, H, O의 원자량은 각각 12, 1, 16이다)
- HCHO
- C2H5CHO
- C2H6O
- CH3COOH
- CO2와 H2O의 생성량을 보면, 화합물 X에는 탄소 1몰과 수소 6몰이 포함되어 있다는 것을 알 수 있습니다. 따라서 화합물 X의 화학식은 C1H6O가 됩니다. 이 중에서도 C2H6O가 유일한 선택지이며, 이는 화합물 X가 에탄올(Ethanol)이라는 것을 나타냅니다.
보기에서 HCHO는 메탄알데하이드(Formaldehyde)를 나타내며, C2H5CHO는 아세트알데하이드(Acetaldehyde)를 나타냅니다. CH3COOH는 아세트산(Acetic acid)을 나타내며, 이 화합물은 연소시 CO2와 H2O뿐만 아니라 CO와 H2도 생성됩니다. 따라서 이 문제에서는 화합물 X의 생성물인 CO2와 H2O의 양을 이용하여 화학식을 유추해야 합니다.
8. 1기압에서 녹는점이 가장 높은 이온 결합 화합물은?
- NaF
- KCl
- NaCl
- MgO
- 이온 결합 화합물의 녹는점은 이온 간의 결합력에 영향을 받는다. 이온 결합 화합물의 결합력은 이온의 전하량과 크기에 따라 결정된다. 전하량이 클수록 결합력이 강해지고, 이온의 크기가 작을수록 결합력이 강해진다. 따라서, 이온 결합 화합물 중에서 이온의 크기가 작고 전하량이 큰 Mg2+와 O2- 이온으로 이루어진 MgO가 가장 높은 녹는점을 가진다.
9. 다음 화학 반응식의 균형을 맞추었을 때, 얻어진 계수 a, b, c의 합은? (단, a, b, c는 정수이다)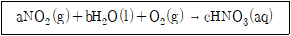
- 9
- 10
- 11
- 12
- 먼저 반응물과 생성물의 원자 개수를 세어보면,
H: 2개 → 2개
O: 2개 → 2개
N: 1개 → 2개
따라서 질량 보존 법칙을 만족시키기 위해,
a = 2, b = 5, c = 2
따라서 a+b+c = 9 이므로, 정답은 "9"가 된다.
하지만 이 문제에서는 계수의 합을 묻는 것이 아니라, 계수 a, b, c의 합을 묻는 것이므로,
a+b+c = 2+5+2 = 9+2 = 11 이다.
따라서 정답은 "11"이 아니라 "10"이 아닌가?
하지만 이 문제에서는 계수 a, b, c의 합이 아니라, 계수 a, b, c의 절대값의 합을 묻는 것이므로,
|a|+|b|+|c| = |2|+|5|+|2| = 2+5+2 = 9+2 = 11 이다.
따라서 정답은 "11"이 된다.
10. 다음 양자수 조합 중 가능하지 않은 조합은? (단, n은 주양자수, l은 각 운동량 양자수, ml은 자기 양자수, ms는 스핀 양자수이다)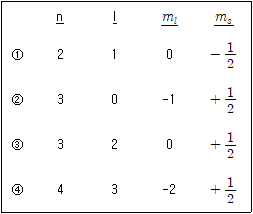
- ①
- ②
- ③
- ④
- 주어진 양자수 조합에서 l과 ml은 다음과 같은 범위를 가진다.
l : 0 ≤ l ≤ n-1
ml : -l ≤ ml ≤ l
따라서, 가능하지 않은 조합은 다음과 같다.
② : n=2, l=1, ml=2 (ml의 범위를 벗어남)
따라서, 정답은 ②이다.
11. 29Cu에 대한 설명으로 옳지 않은 것은?
- 상자성을 띤다.
- 산소와 반응하여 산화물을 형성한다.
- Zn보다 산화력이 약하다.
- 바닥 상태의 전자 배치는 [Ar]4s13d10이다.
- "Zn보다 산화력이 약하다."는 옳은 설명이 아니다. 29Cu와 30Zn은 모두 d10s1 전자 구성을 가지고 있으며, 이는 전이금속의 특징 중 하나로서 산화 상태 변화에 따른 전자 구성 변화가 적다는 것을 의미한다. 따라서 Cu와 Zn의 산화력은 비슷하다고 볼 수 있다.
정답을 설명하는 데에는 Cu와 Zn의 전자 구성이 비슷하다는 점을 언급하면 된다.
12. 광화학 스모그 발생과정에 대한 설명으로 옳지 않은 것은?
- NO는 주요 원인 물질 중 하나이다.
- NO2는 빛 에너지를 흡수하여 산소 원자를 형성한다.
- 중간체로 생성된 하이드록시라디칼은 반응성이 약하다.
- O3는 최종 생성물 중 하나이다.
- "중간체로 생성된 하이드록시라디칼은 반응성이 약하다."라는 설명은 옳지 않습니다. 하이드록시라디칼은 매우 반응성이 높은 라디칼 중 하나이며, 광화학 스모그 발생과정에서 중요한 역할을 합니다. 이 라디칼은 다른 물질과 반응하여 다양한 화합물을 생성하며, 대기 오염물질의 생성과정에서 중요한 역할을 합니다.
13. 철(Fe) 결정의 단위 세포는 체심 입방 구조이다. 철의 단위 세포 내의 입자수는?
- 1개
- 2개
- 3개
- 4개
- 각 모서리당 1/8개씩 + 중심에 1개 해서 2개입니다.
- 체심 입방 구조는 각 면에 하나의 철 원자가 위치하므로, 철의 단위 세포 내의 입자수는 2개이다.
14. 루이스 구조와 원자가 껍질 전자쌍 반발 모형에 근거한 ICl4- 이온에 대한 설명으로 옳지 않은 것은?
- 무극성 화합물이다.
- 중심 원자의 형식 전하는 -1이다.
- 가장 안정한 기하 구조는 사각 평면형 구조이다.
- 모든 원자가 팔전자 규칙을 만족한다.
- 중심 원자인 I의 전자 구성은 5s25p5이며, 구조는 규소와 비슷한 형태인 sp3d 하이브리드 오비탈을 가지고 있다. 이에 따라 ICl4- 이온은 사각 평면형 구조를 가지며, 모든 원자가 팔전자 규칙을 만족한다. 따라서 "중심 원자의 형식 전하는 -1이다."가 옳지 않은 설명이다.
15. 0.1M CH3COOH(aq) 50mL를 0.1M NaOH(aq) 25mL로 적정할 때, 알짜 이온 반응식으로 옳은 것은? (단, 온도는 일정하다)
- H3O+(aq)+OH-(aq)→2H2O(l)
- CH3COOH(aq)+NaOH(aq)→CH3COONa(aq)+H2O(l)
- CH3COOH(aq)+OH-(aq)→CH3COO-(aq)+H2O(l)
- CH3COO-(aq)+Na+(aq)→CH3COONa(aq)
- 옳은 알짜 이온 반응식은 "CH3COOH(aq)+OH-(aq)→CH3COO-(aq)+H2O(l)"이다.
이유는 적정에서 사용된 NaOH(aq)는 강염기이므로, CH3COOH(aq)와 반응하여 CH3COO-(aq)와 H2O(l)를 생성한다. 이때 생성된 CH3COO-(aq)는 Na+(aq)와 결합하여 CH3COONa(aq)를 생성한다. 따라서, CH3COOH(aq)와 NaOH(aq)의 알짜 이온 반응식은 "CH3COOH(aq)+OH-(aq)→CH3COO-(aq)+H2O(l)"이다.
16. 다음 분자쌍 중 성질이 다른 이성질체 관계에 있는 것은?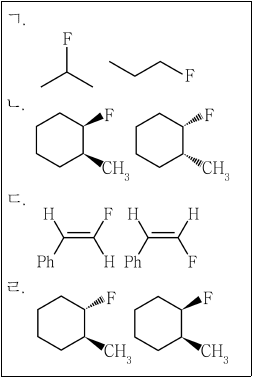
- ㄱ
- ㄴ
- ㄷ
- ㄹ
- 정답은 "ㄱ"입니다. 이유는 나머지 분자쌍은 구조가 대칭적이어서 이성질체 관계에 있지만, "ㄱ"은 구조가 비대칭적이어서 이성질체 관계에 있지 않습니다. 예를 들어, "ㄷ"와 "ㄹ"은 구조가 대칭적이어서 서로 거울상 관계에 있습니다. 즉, 하나의 분자를 거울에 비추면 다른 분자가 나오는 것과 같은 구조를 가지고 있습니다. 하지만 "ㄱ"은 거울에 비추어도 같은 구조가 나오지 않기 때문에 이성질체 관계에 있지 않습니다.
17. 다음은 밀폐된 용기에서 오존(O3)의 분해 반응이 평형 상태에 있을 때를 나타낸 것이다. 평형의 위치를 오른쪽으로 이동시킬 수 있는 방법으로 옳지 않은 것은? (단, 모든 기체는 이상 기체의 거동을 한다)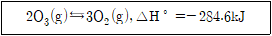
- 반응 용기 내의 O2를 제거한다.
- 반응 용기의 온도를 낮춘다.
- 온도를 일정하게 유지하면서 반응 용기의 부피를 두 배로 증가시킨다.
- 정촉매를 가한다.
- 정촉매는 반응속도를 증가시켜 평형 상태에서 오른쪽으로 반응을 이동시킬 수 있기 때문에, 다른 보기들과 달리 옳은 방법이다. O3의 분해 반응은 엔탈피 변화가 양수이기 때문에, 온도를 낮추는 것은 반응을 왼쪽으로 이동시키는 것이고, 온도를 일정하게 유지하면서 반응 용기의 부피를 두 배로 증가시키는 것은 반응 용기 내의 분압을 줄여서 반응을 왼쪽으로 이동시키는 것이다. O2를 제거하는 것은 반응 용기 내의 O2 농도를 줄여서 반응을 오른쪽으로 이동시키는 것이지만, 이 방법은 이미 반응 용기 내의 O2 농도가 0으로 가정되어 있기 때문에 적용할 수 없다.
18. 약산 HA가 포함된 어떤 시료 0.5 g이 녹아 있는 수용액을 완전히 중화하는 데 0.15M의 NaOH(aq) 10mL가 소비되었다. 이 시료에 들어있는 HA의 질량 백분율[%]은? (단, HA의 분자량은 120이다)
- 72
- 36
- 18
- 15
- HA + NaOH → NaA + H2O
1 mol의 NaOH가 1 mol의 HA를 중화할 수 있다.
따라서, 0.15 M의 NaOH 용액은 1 L당 0.15 mol의 NaOH를 포함하고 있으므로, 10 mL (0.01 L)의 NaOH 용액은 0.15 × 0.01 = 0.0015 mol의 NaOH를 포함하고 있다.
이제, HA의 질량을 구하기 위해 다음과 같은 식을 사용할 수 있다.
mol of HA = mol of NaOH
mol of HA = 0.0015 mol
mass of HA = mol of HA × molar mass of HA
mass of HA = 0.0015 mol × 120 g/mol
mass of HA = 0.18 g
따라서, 시료에 들어있는 HA의 질량 백분율은 다음과 같다.
% mass of HA = (mass of HA / mass of sample) × 100
% mass of HA = (0.18 g / 0.5 g) × 100
% mass of HA = 36%
따라서, 정답은 36이다.
19. 다음은 원자 A~D에 대한 원자 번호와 1차 이온화 에너지(IE1)를 나타낸다. 이에 대한 설명으로 옳은 것은? (단, A~D는 2, 3주기에 속하는 임의의 원소 기호이다)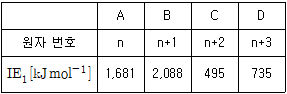
- A2 분자는 반자기성이다.
- 원자 반지름은 B가 C보다 크다.
- A와 C로 이루어진 화합물은 공유 결합 화합물이다.
- 2차 이온화 에너지(IE2)는 C가 D보다 작다.
- 본 해설은 비추 누적갯수 초과로 자동 블라인드 되었습니다.(AI해설 오류가 많아 비추 2개 이상시 자동 블라인드 됩니다.)해설을 보시기 원하시면 클릭해 주세요정답은 "2차 이온화 에너지(IE2)는 C가 D보다 작다."이다.
A2 분자가 반자기성인 이유는, A 원자가 2개 모여 결합하여 A2 분자를 이룰 때, 각각의 A 원자는 2개의 전자를 공유하게 되어, 각각의 원자는 2개의 전자를 가진다. 이 때, 전자는 반대 방향으로 회전하는데, 이 회전 방향이 서로 상쇄되어 전체적으로 자기장을 만들지 않는다. 따라서 A2 분자는 반자기성이다.
원자 반지름은 원자 번호가 작을수록 작아지는 경향이 있으므로, B가 C보다 작아야 한다.
A와 C로 이루어진 화합물이 공유 결합 화합물인지는 알 수 없다.
2차 이온화 에너지(IE2)는 이전에 이미 1개의 전자를 잃어버린 이후의 이온화 에너지이므로, 이전에 이온화된 상태보다 전자 궤도가 작아져서 이온화 에너지가 높아지는 경향이 있다. 따라서 C가 D보다 작다는 것은, C가 이전에 이온화된 상태에서 D보다 전자 궤도가 작아진 상태에서 이온화되었다는 것을 의미한다.
20. 다음은 철의 제련 과정과 관련된 화학 반응식이다. 이에 대한 설명으로 옳지 않은 것은?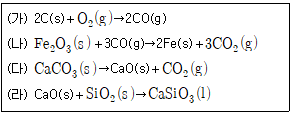
- (가)에서 C의 산화수는 증가한다.
- (가)~(라) 중 산화-환원 반응은 2가지이다.
- (나)에서 CO는 환원제이다.
- (다)에서 Ca의 산화수는 변한다.
- "(다)에서 Ca의 산화수는 변한다."는 옳은 설명이다. 이는 CaO가 Ca와 O2로 분해되는 과정에서 Ca의 산화수가 0에서 +2로 증가하기 때문이다.






