1과목: 과목 구분 없음
1. Dulong 식으로 폐기물 발열량 계산 시 포함되지 않는 원소는?
- 수소
- 산소
- 황
- 질소
2. 슬러지 처리 공정에서 호기성 소화에 비해 혐기성 소화의 장점이 아닌 것은?
- 운영비가 저렴하다.
- 슬러지가 적게 생산된다.
- 체류시간이 짧다.
- 메탄을 에너지화 할 수 있다.
3. 암모니아 1mg/L를 질산성 질소로 모두 산화하는데 필요한 산소농도[mg/L]는?
- 3.76
- 3.56
- 4.57
- 4.27
4. 집진 장치의 효율이 99.8%에서 95%로 감소하였다. 효율 저하 전후의 배출 먼지 농도 비율은?
- 1:10
- 1:15
- 1:20
- 1:25
5. 10m 간격으로 떨어져 있는 실험공의 수위차가 20cm일 때, 실질 평균선형유속[m/day]은? (단, 투수 계수는 0.4m/day이고 공극률은 0.5이다)
- 0.008
- 0.18
- 0.004
- 0.016
6. 어떤 물질 A의 반응차수를 구하기 위한 실험결과이다. 이에 대한 설명으로 옳지 않은 것은? (단, C는 A의 농도이고 t는 시간, k는 반응속도 상수, n은 반응차수이다)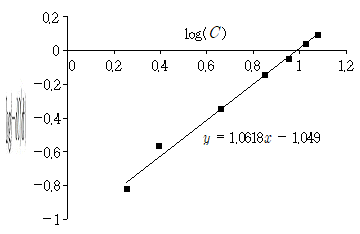
- 단순선형 회귀분석 방법을 이용하여 자료를 해석하였다.
- 일반적인 반응속도식인
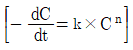 을 이용하여 반응차수인 n값을 구한 것이다.
을 이용하여 반응차수인 n값을 구한 것이다. - 반응차수는 1.049이다.
- 실험 자료의 유효성은 결정 계수로 판단할 수 있다.
7. 다음은 용해된 염소가스가 수중에서 해리되었을 때 차아염소산과 염소산이온 간의 상대적인 분포를 pH에 따라 나타낸 그래프이다. 이에 대한 설명으로 옳지 않은 것은?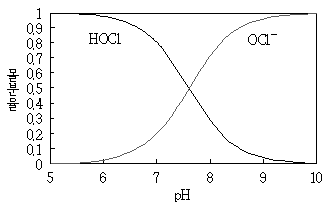
- pH가 6일 때 HOCl 농도는 0.99mg/L이고 OCl-보다 소독력이 크다.
- pH가 7.6일 때 HOCl 농도와 OCl- 농도는 같다.
- 염기성일 때, 산성에서보다 소독력이 떨어진다.
- 온도에 따라 일정 pH에서 두 화학종의 몰분율이 달라진다.
8. 다음 실험 결과에서 처리 전과 처리 후의 BOD 제거율[%]은? (단, 희석수의 BOD값은 0이다)
- 33.3
- 50.0
- 58.3
- 61.4
9. 길이가 30m, 폭이 15m, 깊이가 3m인 침전지의 유량이 4,500m3/day이다. 유입 BOD 농도가 600mg/L이고 총 고형 물질 농도가 1,200mg/L일 때, 수리학적 표면 부하율[m3ㆍm-2ㆍday-1]은?
- 10
- 30
- 50
- 90
10. 대기 중 부유성 입자와 침강성 입자를 분류하는 입경(particle diameter) 기준은?
- 2.5㎛
- 10㎛
- 50㎛
- 100㎛
11. 입자상 물질을 제거하는 장치로 가장 거리가 먼 것은?
- 사이클론 집진기
- 전기집진기
- 백 하우스
- 유동상 흡착장치
12. 물리량의 차원으로 옳지 않은 것은?
- 확산 계수 [L2T-1]
- 동점성 계수 [L3T-1]
- 압력 [ML-1T-2]
- 밀도 [ML-3]
13. 고형물이 40%인 유기성 폐기물 10ton을 수분 함량 20%가 되도록 건조시킬 때 건조 후 수분 중량[ton]은? (단, 유기성 폐기물은 고형물과 수분만으로 구성되어 있다고 가정한다)
- 1
- 2
- 4
- 6
14. 지하수 대수층의 부피가 2,500m33, 공극률이 0.4, 공극수 내 비반응성 물질 A의 농도가 50mg/L일 때, 공극수 내 물질 A의 질량[kg]은?
- 25
- 40
- 50
- 100
15. 80% 효율의 펌프로 1m3/sec의 물을 5m의 총수두로 양수 시 필요한 동력[kW]은? (단, 소수점 첫째 자리에서 반올림한다)
- 34
- 40
- 61
- 70
16. 다음 미생물 비증식 속도식에 대한 설명으로 옳지 않은 것은? (단, μ는 비증식 속도, μmax는 최대 비증식 속도, Ks는 미카엘리스 상수, S는 기질 농도이다)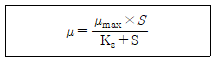
- 1/μ과 1/S의 그래프에서 기울기 값이 μmax이다.
- μ는 S가 증가함에 따라 기질 흡수 기작이 포화될 때까지 증가한다.
- Ks는 그래프 상에서 μ가 μmax의 1/2일 때의 값이다.
- S≫Ks일 때 μ∝μmax이다.
17. 위생 매립지에 유입된 미확인 물질을 원소 분석한 결과, 질량 기준으로 탄소 40.92%, 수소 4.58%, 산소 54.50%로 구성되어 있을 경우 이 물질의 실험식은?
- CH3O
- C3H4O3
- C2H6O2
- C6H8O6
18. Kow(옥탄올-물 분배 계수) 100인 유기화합물 A가 물 시료 중에 50mg/L 농도로 용해되어 있다. 이 시료 1L에 옥탄올 100mL를 넣고 교반하였다. 평형에 도달한 후 물에 용해되어 있는 A의 농도[mg/L]는?
- 1.45
- 2.25
- 3.10
- 4.55
19. 어떤 지점에서 기계에 의한 음압레벨이 80dB, 자동차에 의한 음압레벨이 70dB, 바람에 의한 음압레벨이 50dB인 경우 총음압레벨[dB]은? (단, log1.1=0.04, log2.2=0.34, log3.1=0.49이다)
- 66.7
- 74.9
- 80.4
- 93.4
20. 질소 순환에 대한 설명으로 옳지 않은 것은?
- 질산화 과정 중 나이트로박터는 아질산성 질소를 질산성 질소로 산화시킨다.
- 아질산염은 NADH의 촉매작용으로 질산염이 된다.
- 탈질화 과정에서 N2가 생성된다.
- N2가 질소 고정반응을 통해 암모니아를 생성한다.






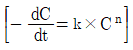 을 이용하여 반응차수인 n값을 구한 것이다." 그리고 "반응차수는 1.049이다."이다. 이는 실험 결과에서 얻은 농도-시간 데이터를 이용하여 반응속도식을 만들고, 이를 단순선형 회귀분석 방법으로 해석하여 반응차수를 구한 것이다.
을 이용하여 반응차수인 n값을 구한 것이다." 그리고 "반응차수는 1.049이다."이다. 이는 실험 결과에서 얻은 농도-시간 데이터를 이용하여 반응속도식을 만들고, 이를 단순선형 회귀분석 방법으로 해석하여 반응차수를 구한 것이다.