1과목: 과목구분없음
1. 다음은 임의의 원소 A~D에 대한 설명이다. 
위를 참고하여 다음 표를 완성하였을 때, (가)+(나)+(다)의 값은?
- 57
- 58
- 59
- 60
- 61
2. 다음은 어떤 물질을 물 100g에 녹인 용액 (가)~(다)에 대한 설명이다. 
그림의 용액 A~E 중, 위의 설명에 맞는 것을 바르게 짝지은 것은? (순서대로 가, 나, 다)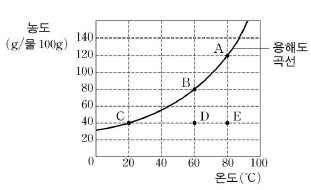
- A, C, D
- B, C, D
- B, D, E
- C, A, E
- C, B, A
3. 다음은 여러 가지 조건으로 기체 상태를 변화시킨 것이다. 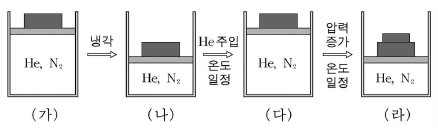
이에 대한 설명으로 옳은 것은? (단, 그림에서 (가)와 (다)의 부피가 같고, (나)와 (라)의 부피가 같다.) [3점]
- (가)에서 He의 평균 분자 운동 에너지는 N2 보다 크다.
- (나)보다 (다)에서 N2의 부분 압력이 크다.
- (나)와 (라)에서 He의 부분 압력은 같다.
- (나)보다 (다)에서 He의 평균 속력은 크다.
- (라)의 온도가 (가)와 같아지면 (라)의 부피가 (가)와 같아진다.
4. 다음은 메탄(CH4)과 염소(Cl2)의 반응을 분자 모형으로 나타낸 것이다. 
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]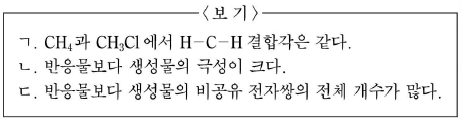
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
5. 그림은 수은 기둥 위에 물, 1m 설탕물, 1m 소금물을 각각 1 mL씩 넣었을 때의 수은 기둥의 높이 변화를 나타낸 것이다. 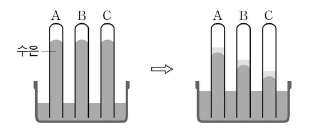
시험관 A, B, C에 넣은 물질을 바르게 짝지은 것은? (순서대로 A, B, C)
- 물, 설탕물, 소금물
- 물, 소금물, 설탕물
- 설탕물, 물, 소금물
- 설탕물, 소금물, 물
- 소금물, 설탕물, 물
6. 다음은 물의 증기 압력을 측정하는 장치와 물의 상평형 그림이다. 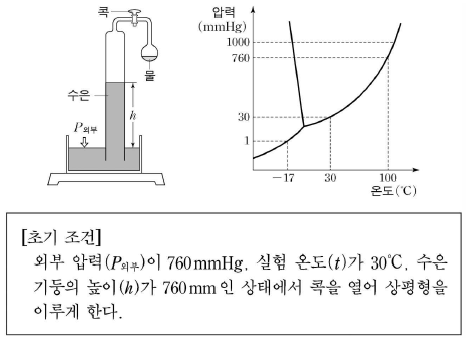
위의 상태에서 다음과 같은 실험 조건만 변화되었을 때, 실험 결과에 대한 설명으로 옳지 않은 것은? (단, 실험에서 장치를 포함한 모든 물질의 열팽창은 무시한다.)
- t 가 100℃이면 h 는 0 mm이다.
- t 가 -17℃이면 h 는 759 mm이다.
- P외부가 30 mmHg이면 h 는 0 mm이다.
- 초기 조건에서 물의 양을 증가시키면 h 는 줄어든다.
- P외부가 1000 mmHg, t 가 100℃이면 h 는 240mm이다.
7. 그림 (가)는 어떤 기체를 밀폐된 용기에 넣고 조건을 변화시킨 것을 나타낸 것이고, 그림 (나)는 이 기체의 압력과 PVm/RT 과의 관계를 나타낸 것이다. 여기서Vm은 몰당 부피이다. 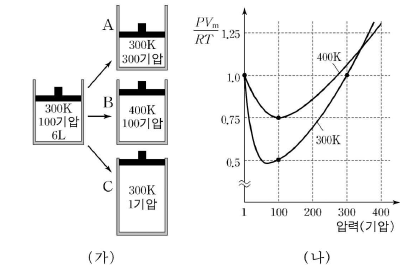
그림 (나)의 자료를 이용하여 그림 (가)의 최종 상태 A, B, C의 부피를 구한 것으로 옳은 것은? (순서대로 A, B, C) [3점]
- 2L, 8L, 600L
- 2L, 12L, 600L
- 2L, 12L, 1200L
- 4L, 8L, 1200L
- 4L, 12L, 1200L
8. 다음은 임의의 원소 A~E가 이온 상태일 때의 전자 배치를 나타낸 것이다. 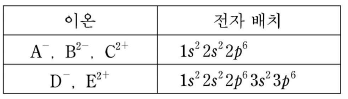
이에 대한 설명으로 옳지 않은 것은?
- A2의 결합 에너지는 B2보다 크다.
- CB의 녹는점은 EB보다 높다.
- CD2는 전해질이다.
- D2의 끓는점은 A2보다 높다.
- E는 용융 상태에서 전기를 통한다.
9. 그림은 초기 농도와 반응 온도가 다른 조건에서 물질 X가 분해되는 반응의 농도 변화를 나타낸 것이다. 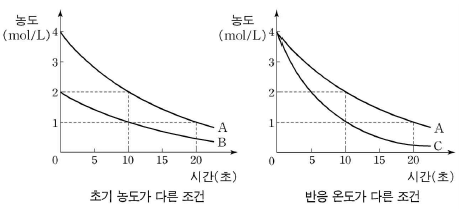
이 반응에 대한 설명으로 옳지 않은 것은? [3점]
- 일정 온도에서 농도가 클수록 반응 속도가 빠르다.
- 이 반응은 X의 농도에 대하여 1차 반응이다.
- A에서 30초 일 때 X의 농도는 0.5mol/L이다.
- C보다 A의 반응 온도가 높다.
- B와 C의 반응 속도 상수는 다르다.
10. 러더퍼드는 그림 (가)와 같은 톰슨의 원자 모형을 검증하기 위하여 그림 (나)와 같이 실험을 하였다. 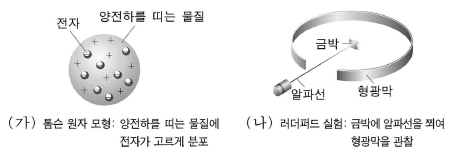
톰슨의 원자 모형이 옳다면, 금박에 알파선을 쬐었을 때 예상한 결과로 가장 적절한 것은?
11. 표는 25℃, 1기압에서 여러 가지 물질의 생성열 (ΔHf)을 나타낸 것이다. 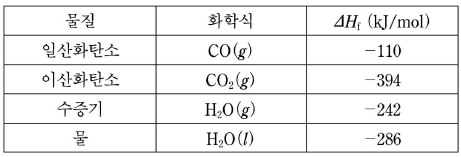
이 자료로부터 추론한 것으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
12. 그림 (가)는 세 가지 결합 유형을 나타낸 것이고, 그림 (나)는 전기 음성도 차이와 결합의 이온성과의 관계를 나타낸 것이다. 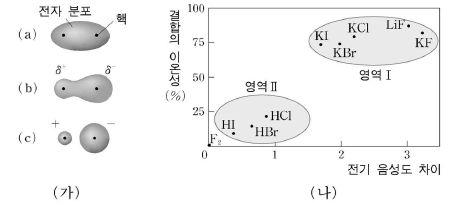
이에 대한 설명으로 옳은 것은?
- KI는 (a)와 같은 결합을 한다.
- F2는 (c)와 같은 결합을 한다.
- KBr과 KCl의 위치는 서로 바뀌어 있다.
- 영역II에 위치하는 화합물은 (b)와 같은 결합을 한다.
- 전기 음성도의 차이가 작을수록 결합의 이온성이 증가하는 경향이 있다.
13. 다음은 염화나트륨과 염화칼륨이 형성되는 과정을 나타낸 것이다. 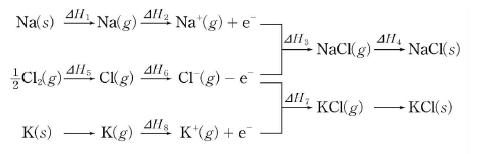
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
14. 그림은 다이아몬드와 흑연의 결합 모형 및 엔탈피 변화를 나타낸 것이다. 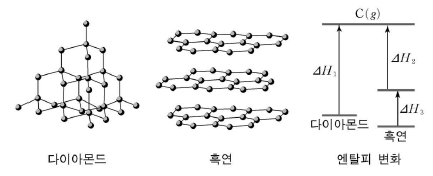
다이아몬드와 흑연에서 C-C결합 에너지를 368kJ/mol이라고 할 때 옳은 것을 <보기>에서 모두 고른 것은? (단, 흑연은 다이아몬드보다 2.4kJ/mol더 안정하며 ⊿H2는 흑연 1몰의 모든 C-C 결합을 끊는데 필요한 에너지이다.)
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
15. 그림은 산 HA와 HB를 각각 50mL 취하여, 0.1M NaOH 수용액으로 적정한 중화 적정 곡선이고, 표는 25℃에서 산의 이온화 상수(Ka)와 지시약의 변색 범위를 나타낸 것이다. 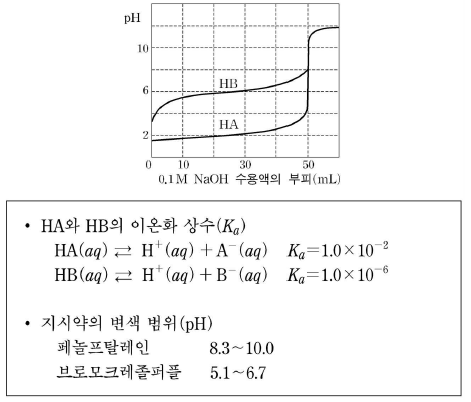
이에 대한 설명으로 옳지 않은 것은? [3점]
- HA의 농도는 0.1M이다.
- 산의 Ka 값이 작으면 중화점의 pH는 크다.
- 중화점에서 생성된 염 NaA와 NaB의 농도는 각각 0.1M이다.
- HA의 중화 적정 지시약으로 브로모크레졸퍼플을 사용할 수 있다.
- HB의 중화 적정 지시약으로 페놀프탈레인을 사용할 수 있다.
16. 묽은 염산에 구리의 염화물 A와 B를 각각 녹인 수용액을 그림과 같은 장치로 9650초 동안 0.1A의 전류를 흘려 전기 분해하였더니, 각각 0.64g, 0.32g의 구리가 석출되었다. 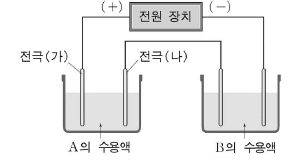
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 구리 1몰은 64g, 1F는 96500C 전극은 백금을 사용하였다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
17. 다음은 진한 염산으로 묽은 염산 250mL를 만드는 실험 과정이다. 
위의 묽은 염산에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, HCl 1몰은 36.5g이며 묽은 염산의 밀도는 1.0g/mL로 가정한다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
18. 다음은 25℃의 인산(H3PO4) 수용액에서 일어나는 이온화 평형을 나타낸 것이다. 
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
19. 영희는 다음의 산화-환원 반응식을 아래와 같은 단계로 완성하려고 한다. 
이에 대한 설명으로 옳지 않은 것은? [3점]
- 1단계의 산화 반응은 Co2+(aq) → Co3+(aq)이다.
- 2단계의 환원 반응은
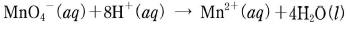 이다.
이다. - 3단계에서는 각 반쪽에서 전자를 첨가하여 전하의 균형을 맞춘다.
- 4단계에서 잃거나 얻은 전자의 몰수는 각각 10몰이다.
- 5단계에서 ⸘속의 계수는 5이다.
20. 그림은 A와 B가 반응하여 C를 생성하는 반응에서 시간에 따른 각 물질의 농도를 나타낸 것이다. 이 반응이 평형에 도달한 후 A, B, C를 각 1몰씩 더 넣어 주었다. 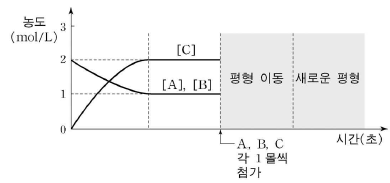
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, A~C는 기체이고 반응 용기의 부피는 1L 온도는 일정하다고 가정한다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ








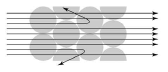

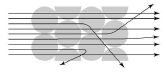
 "이다.
"이다.
|---|---|---|---|---|
| A | 0 | 2 | 3 | 4 |
| B | 2 | 0 | 5 | 6 |
| C | 3 | 5 | 0 | 7 |
| D | 4 | 6 | 7 | 0 |
(가) A에서 B로 가는 최단 경로는 A → B이고, 가중치는 2이다.
(나) B에서 C로 가는 최단 경로는 B → A → C이고, 가중치는 3+3=6이다.
(다) C에서 D로 가는 최단 경로는 C → A → B → D이고, 가중치는 3+2+6=11이다.
따라서 (가)+(나)+(다)=2+6+11=19이므로 정답은 "59"가 된다.