1과목: 과목구분없음
1. 그림은 273K에서 기체 A, B, C 각각 1몰에 대하여 압력에 따른 PV/RT를 나타낸 것이다. 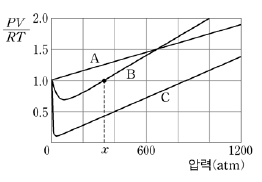
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
2. 그림과 같이 두 용기 (가), (나)에 헬륨(He)과 네온(Ne)이 각각 들어 있다. 온도를 일정하게 유지하면서 콕을 열어 평형에 도달하게 하였다. 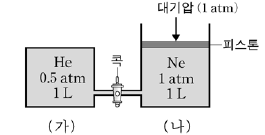
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 피스톤과 용기 사이의 마찰과 피스톤의 무게는 없고, He과 Ne은 이상 기체라고 가정한다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
3. 그림은 원자 번호가 연속인 원소의 1차 이온화 에너지를 나타낸 것이다. 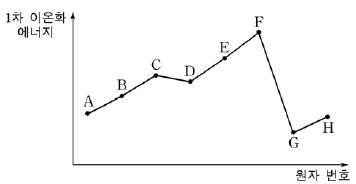
이에 대한 설명으로 옳은 것은? (단, A~H는 임의의 원소 기호이고, 2~3주기 원소이다.) [3점]
- 화합물 GE의 녹는점은 HD보다 높다.
- 전자 친화도가 가장 큰 원소는 F이다.
- G와 H의 안정한 이온은 전자수가 같다.
- 홑원소 물질의 끓는점은 C가 G보다 높다.
- A의 바닥 상태 전자 배치는 1s22s22p2이다.
4. 다음은 일정한 온도에서 A와 B가 반응하여 C가 생성되는 반응에서 반응 속도식을 구하기 위한 실험 설계이다. 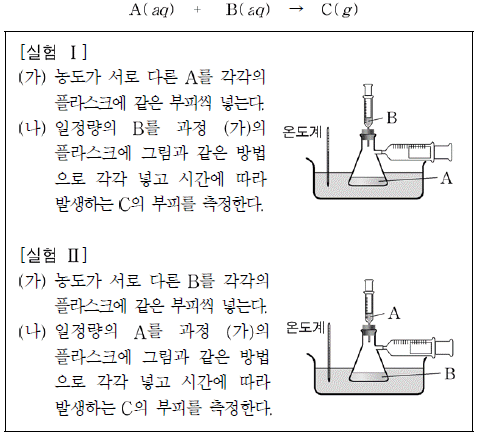
이 실험에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
5. 표는 네 종류의 기체 A, B, 산소, 질소의 성질을 나타낸 것이다. 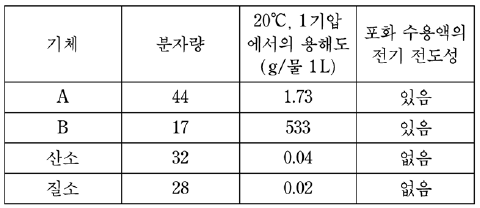
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
6. 그림은 물과 얼음의 증기 압력 곡선을 나타낸 것이다. 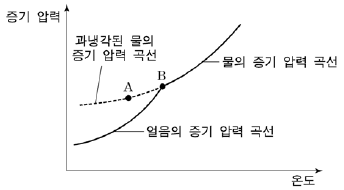
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
7. 그림은 25℃에서 산소의 압력과 용해도의 관계를 나타낸 것이다. 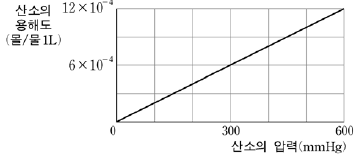
25℃ 물의 용존 산소량을 이상으로 유지하기 위한 산소의 최소 압력은 몇 mmHg인가? (단, 산소의 분자량은 32이다.)
- 75mmHg
- 80mmHg
- 85mmHg
- 90mmHg
- 95mmHg
8. 그림은 일정한 온도에서 용질의 몰분율에 따른 두 용액 (가)와 (나)의 증기 압력을 나타낸 것이다. 여기서 A와 B는 용매이고 C는 용질이다. 
이에 대한 설명으로 옳지 않은 것은? [3점]
- 증기 압력은 A가 B보다 높다.
- 분자 사이의 힘은 B가 A보다 크다.
- C는 비휘발성 물질이다.
- 몰분율 x에서 (나)의 증기 압력 내림은 PB-PB'이다.
- 몰분율이 각각 0.5일 때 (가)의 끓는점이 (나)보다 높다.
9. 그림은 수소 원자의 몇 가지 궤도 함수를 나타낸 것이다. 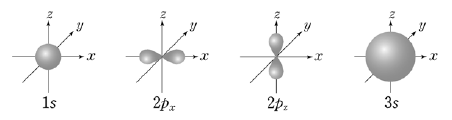
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
10. 그림은 할로겐 원소의 원자 번호에 따른 할로겐화수소 A, B, C의 끓는점을 나타낸 것이다. 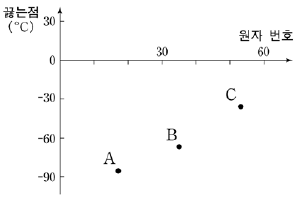
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
11. 다음은 플루오르화수소(HF)와 사염화탄소(CCl4)의 반응으로 만들어지는 세 종류의 화합물 (가), (나), (다)의 루이스 구조식이다. 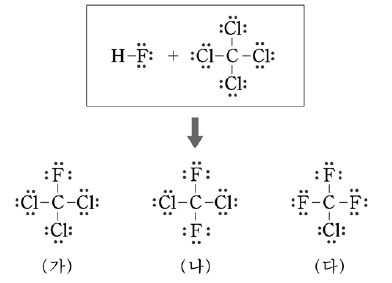
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄱ, ㄴ, ㄷ
12. 그림은 표준 상태에서 몇 가지 반응의 엔탈피 관계를 비교한 것이고, 표는 몇 가지 반응의 반응열을 나타낸 것이다. 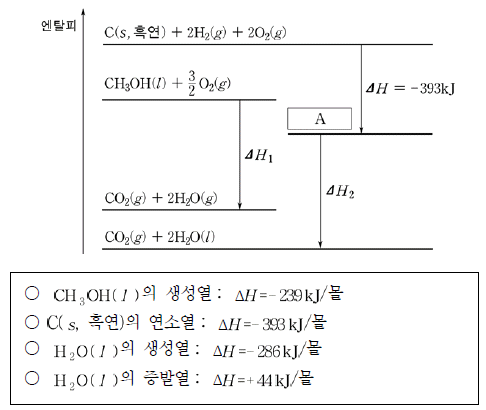
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄱ, ㄴ, ㄷ
13. 다음은 포도당에 대한 자료이다. 
체중 70kg인 어떤 사람이 운동으로 체내의 포도당 (C6H12O6) 45g을 연소하여 소모하였다. 이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 체중 70kg인 사람의 열용량은 286kJ/℃이고, 포도당의 연소 과정에서 발생한 에너지의 20%만 체온을 올리는 데 쓰인다고 가정한다.)
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
14. 다음은 각각 10몰의 A와 B를 반응 용기에 넣고 반응시켰을 때 C가 생성되는 화학 반응식이다. 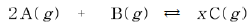
그림 (가)는 일정한 압력에서 온도에 따른 평형에서의 반응물과 생성물의 몰분율을 나타낸 것이고, 그림 (나)는 일정한 온도에서 압력에 따른 평형에서의 생성물의 몰분율을 나타낸 것이다. 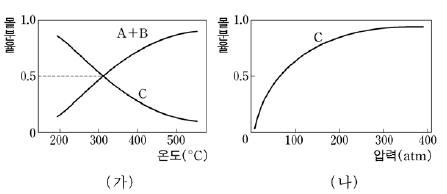
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄱ, ㄴ, ㄷ
15. 마그네슘 조각 0.24g을 0.1M AgNO3 수용액 100mL에 넣어 충분히 반응시켰다. 이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, Mg의 원자량은 24이다.) 
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄱ, ㄴ, ㄷ
16. 다음은 흰색 앙금인 ZnS의 용해에 관한 실험과 H2S의 이온화 평형에 대한 자료이다. 
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
17. 그림은 어떤 반응의 두 가지 반응 경로 A, B의 에너지 변화를 나타낸 것이다. 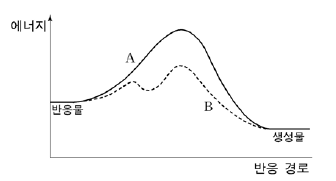
이에 대한 설명으로 옳지 않은 것은? [3점]
- B는 발열 반응이다.
- A와 B의 평형 상수는 같다.
- 전체 반응 속도 상수는 A가 B보다 크다.
- A와 B의 반응 경로가 다른 것은 촉매 때문이다.
- B에서 온도를 높이면 전체 반응 속도 상수가 커진다.
18. 표는 어떤 아세트산 수용액에서 온도에 따른 아세트산의 이온화 상수(Ka)를 나타낸 것이다. 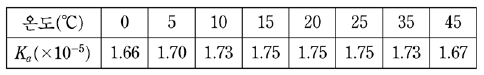
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
19. 그림 (가)는 25℃에서 농도가 0.10M인 산 HA와 HB를 50mL씩 취하여 0.10M NaOH 수용액으로 각각 적정한 중화 적정 곡선이고, 그림 (나)는 HA, HB 수용액과 그림 (가)의 어떤 지점에 있는 용액의 농도에 따른 pH 변화 곡선이다. 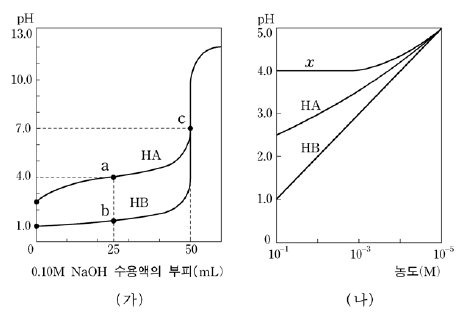
이에 대한 설명으로 옳지 않은 것은? [3점]
- 점 c에서 [OH-]는 1.0×10-7M이다.
- 점 b에서 B-의 양은 2.5×10-3몰이다.
- HA의 이온화 상수 (Ka)는 1.0×10-4이다.
- 그림 (나)의 HB 수용액에서 [H+]=[B-]이다.
- 곡선 x는 점 a 수용액의 농도를 변화시킨 것이다.
20. 그림은 금속 철(Fe)을 전극으로 사용한 화학 전지를, 표는 표준 환원 전위를 나타낸 것이다. 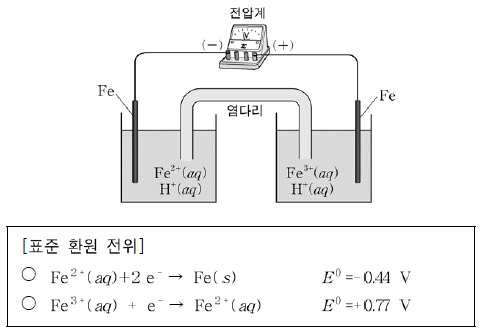
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?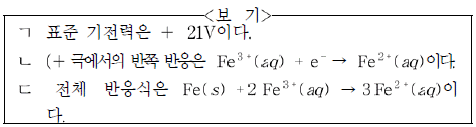
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ





