1과목: 과목구분없음
1. 그림과 같이 0.5m과 1.0m의 염화나트륨 수용액이 각각 100g씩 담긴 비커를 수증기로 포화된 용기에 넣고 밀폐시켰다. 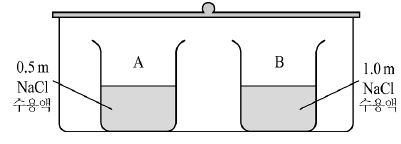
밀폐된 시점부터 용기 내에서 일어나는 변화에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 온도는 일정하게 유지하였다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
2. 그림은 비전해질이며 비휘발성인 X와 Y의 용해도 곡선이다. 분자량은 X가 Y보다 크다. 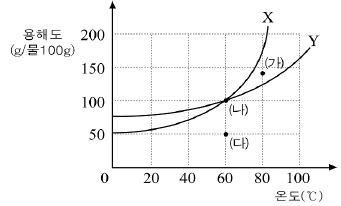
이에 대한 설명으로 옳은 것은?
- 점 (가)의 Y수용액에 Y를 더 넣으면 녹는다.
- 점 (나)의 Y수용액은 점 (나)의 X수용액보다 끓는점이 높다.
- 점 (다)의 X수용액을 20℃로 낮추면 X가 석출된다.
- 점 (나)와 (다)의 X수용액은 퍼센트 농도가 같다.
- X 60g과 Y 60g의 혼합물을 80℃의 물 50g에 녹인 후 20℃로 냉각시키면 X만 석출된다.
3. <그림 1>은 일정한 온도에서 압력에 따른 H2O의 부피 변화를 나타낸 것이고 <그림 2>는 H2O의 상평형 그림이다. 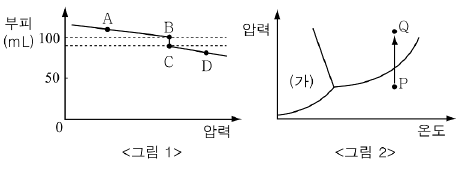
그림에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄴ, ㄹ
- ㄷ, ㄹ
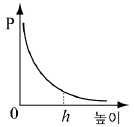
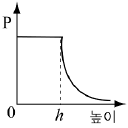
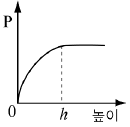
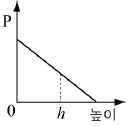
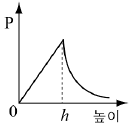
4. 소량의 물을 실린더에 넣고 그림과 같이 피스톤이 수면에 밀착된 상태에서 피스톤을 충분히 느리게 끌어 올렸더니 높이 h에서 물이 모두 증발하였다. 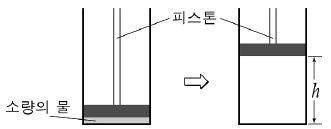
피스톤의 높이에 따른 실린더 내부 기체의 압력(P) 변화를 나타낸 그래프로 가장 적절한 것은? (단, 온도는 일정하며, 물이 차지하는 부피는 무시한다.) [3점]
5. 그래프는 300K에서 1몰의 기체 A, B에 대하여 압력 변화에 따른 PV/RT 값을 나타낸 것이다. 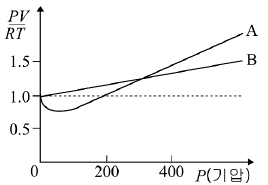
기체 A, B에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
6. 그림과 같이 콕으로 연결된 강철 용기에 수소와 헬륨이 들어 있다. 콕을 열고 두 기체가 충분히 혼합된 후 온도를 300K로 유지했다. 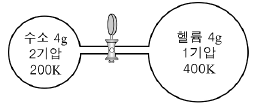
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 원자량은 H=1, He=4이며 수소와 헬륨은 이상 기체로 간주한다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
7. 표는 3주기 원소 A, B의 순차적 이온화에너지를 나타낸 것이다. 
원소 A, B에 대한 설명으로 옳은 것은? (단, A, B는 임의의 기호이다.)
- A는 금속이고 B는 비금속이다.
- A는 B보다 원자 반지름이 작다.
- A는 B보다 물과의 반응성이 작다.
- 원자 A와 B의 양성자 수를 더하면 23이다.
- A와 B는 각각 산소와 결합하여 분자성 물질을 만든다.
8. 그림은 수소 원자의 전자 전이를 나타낸 것이다. 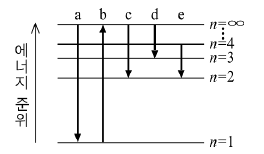
전자 전이 a~e에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 수소 원자의 에너지 준위는 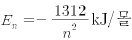 이다.)
이다.)
- ㄱ, ㄷ
- ㄱ, ㄹ
- ㄴ, ㄹ
- ㄱ, ㄴ, ㄷ
- ㄴ, ㄷ, ㄹ
9. 그림은 2px오비탈을 나타낸 것이다. 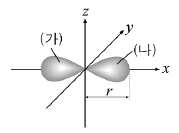
2px 오비탈에 대한 설명으로 옳은 것은? [3점]
- 전자는 오비탈의 경계면을 따라 운동한다.
- (가)와 (나)는 전자가 발견될 확률은 같다.
- 핵으로부터 거리가 같은 지점에서 전자가 발견될 확률은 같다.
- 전자 1개가 채워질 때는 (가) 또는 (나) 어느 한 쪽에만 들어간다.
- 핵으로부터의 거리가 r보다 먼 지점에는 전자가 존재하지 않는다.
10. 다음은 물질 (가)~(라)의 화학식과 끓는점이다. 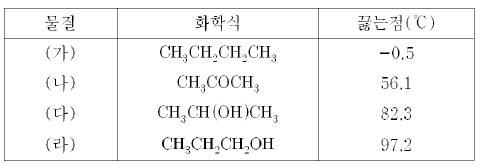
(가)~(라)의 끓는점의 차이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
11. 그림은 중성 원자 A~D의 전자 배치를 나타낸 것이다. 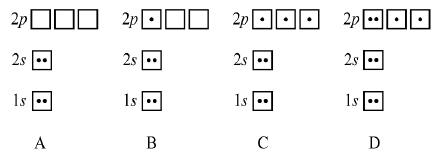
A~D의 플루오르 화합물 AF2, BF3, CF3, DF2에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, A~D는 임의의 기호이다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
12. 다음은 포름산의 분해 반응 (가)와 (나)의 반응 메커니즘과 반응 경로에 따른 에너지 변화를 나타낸 것이다. 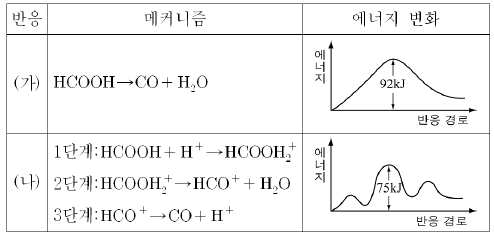
포름산의 분해 반응에 대한 설명으로 옳지 않은 것은? [3점]
- (가)와 (나)의 최종 생성물은 다르다.
- (가)의 반응 속도는 (나)보다 느리다.
- (나)에서 H+는 정촉매로 사용되었다.
- (나)에서 속도 결정 단계는 2단계이다.
- (가)의 활성화 에너지는 (나)보다 크다.
13. 표의 (가)~(라)는 일정량의 질소와 수소를 반응시킬 때의 여러 가지 조건이다. 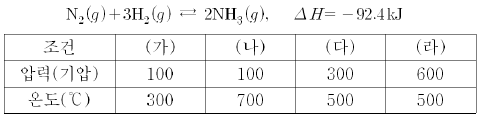
(가)~(라)에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄷ
- ㄴ, ㄷ
14. 다음은 메탄과 염소의 화학 반응식과 그 반응이 일어날 때의 에너지 관계를 나타낸 것이다. 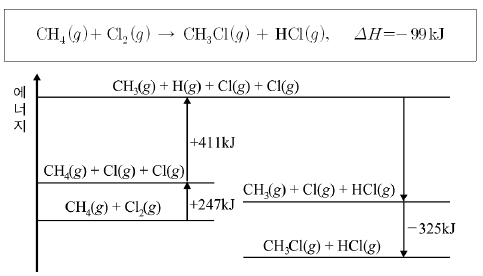
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ, ㄴ
- ㄱ, ㄹ
- ㄴ, ㄷ
- ㄱ, ㄷ, ㄹ
- ㄴ, ㄷ, ㄹ
15. 다음은 반응물과 생성물이 모두 기체인 어떤 반응의 화학 반응식이다. 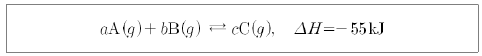
그래프는 밀폐된 용기에 반응물을 넣어 평형 상태에 도달했을 때 반응 조건을 변화시킨 후 시간에 따른 A, B, C의 농도를 나타낸 것이다. 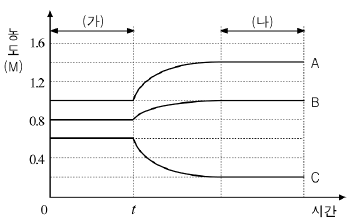
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
16. 그림과 같이 1L의 용기에 N2O4 0.3몰과 NO2 0.2몰을 넣었더니 NO2 0.16몰이 남은 상태에서 평형에 도달하였다. 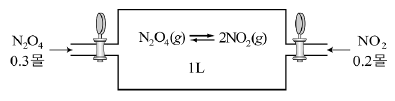
위 평형 상태에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 온도는 일정하게 유지된다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
17. 그래프는 산 HA의 수용액 40mL에 염기 0.1M BOH의 수용액을 가하며 pH를 측정한 결과를 나타낸 것이다. 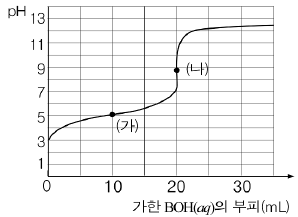
이에 대한 설명으로 옳은 것은? (단, A, B는 임의의 기호이며 A-와 B+는 반응하지 않는다.)
- HA의 초기 농도는 0.2M이다.
- HA의 이온화도는 BOH보다 크다.
- 점 (가)에서 [A-]는 0.05M이다.
- 점 (나)에서 [A-]는 [B+]보다 크다.
- 점 (나)에서 [OH-]는 [H+]보다 크다.
18. 25℃에서 아세트산은 물에 녹아 다음과 같은 평형을 이룬다. 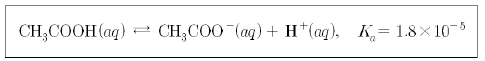
0.10M의 아세트산 수용액에 수산화나트륨(NaOH) 수용액을 가하여 수용액의 pH가 7이 되었을 때 수용액의 [CH3COO-]와 [CH3COOH]의 비는? (단, 온도는 25℃로 일정하다.) [3점]
- 1 : 180
- 1 : 18
- 1 : 1
- 18 : 1
- 180 : 1
19. 다음은 금속 A, B와 전해질 수용액을 이용한 실험이다. 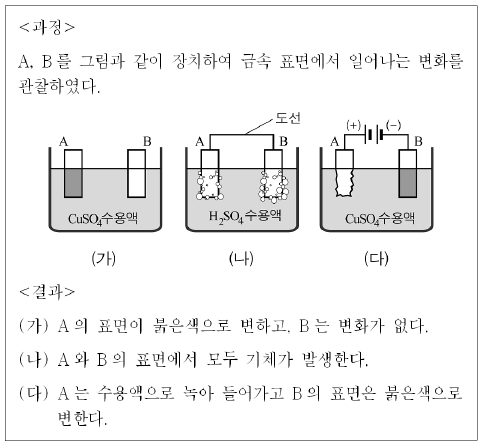
실험에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, A, B는 임의의 원소 기호이다.)
- ㄱ, ㄴ
- ㄱ, ㄹ
- ㄴ, ㄷ
- ㄴ, ㄹ
- ㄷ, ㄹ
20. 그림과 같은 장치에서 세 가지 물질의 1.0M수용액을 25℃에서 각각 전기 분해했을 때 두 전극에서의 생성물은 표와 같다. 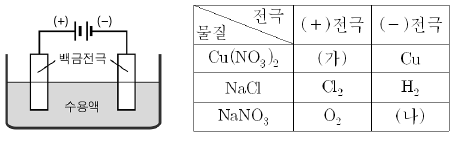
위 자료에 대한 설명으로 옳은 것은? [3점]
- Na+의 표준 환원 전위는 Cu2+보다 크다.
- (가)와 (나)를 반응시키면 NaOH이 생성된다.
- NaCl수용액을 전기 분해하면 수용액의 pH가 감소한다.
- Cu(NO3)2수용액의 전기 분해에서는 구리 이온이 산화된다.
- NaNO3 수용액을 전기 분해할 때 (+)극에서 물이 산화된다.






- 0.5m 염화나트륨 수용액은 농도가 낮기 때문에 수증기압이 낮다. 따라서 수증기압이 높은 1.0m 염화나트륨 수용액에서 수증기가 0.5m 염화나트륨 수용액으로 이동하게 된다. 이로 인해 0.5m 염화나트륨 수용액의 농도가 증가하고, 1.0m 염화나트륨 수용액의 농도가 감소한다. 이 과정에서는 열이 방출되지 않으므로 온도는 일정하게 유지된다.
- 수증기압이 높은 1.0m 염화나트륨 수용액에서 수증기가 0.5m 염화나트륨 수용액으로 이동하면서, 1.0m 염화나트륨 수용액의 부피가 감소하고 0.5m 염화나트륨 수용액의 부피가 증가한다. 이로 인해 용기 내 총 부피는 변하지 않는다.