1과목: 과목구분없음
1. 표는 0℃, 1기압에서 세 가지 분자성 물질에 대한 자료이다. 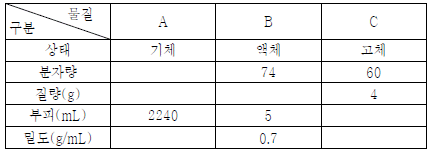
물질 A, B, C의 분자수를 옳게 비교한 것은?
- A > B > C
- A > C > B
- B > A > C
- C > A > B
- C > B > A
2. 그래프는 일정량의 물에 용질 A와 B를 각각 녹인 수용액의 어는점을 용질의 질량에 따라 나타낸 것이다. 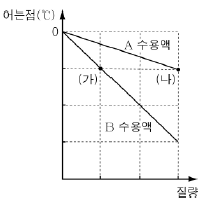
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, A와 B는 비휘발성이며, 비전해질이다.)
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄷ
- ㄴ, ㄷ
3. 다음은 탄소(C)의 상평형 그림을 나타낸 것이다. 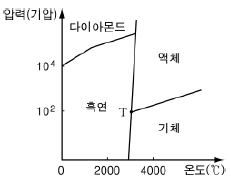
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ᄀ
- ᄂ
- ᄀ, ᄃ
- ᄂ, ᄃ
- ᄀ, ᄂ, ᄃ
4. 다음은 일정한 온도에서 기체의 성질을 알아보는 실험이다. 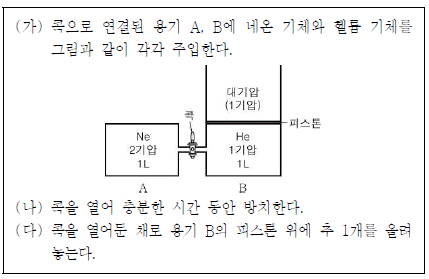
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 피스톤의 마찰과 무게 및 연결관의 부피는 무시하며, 추 1개의 압력은 0.5기압이다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
5. 그림 (가)의 실험 Ⅰ은 그림 (나)와 같이 일정한 온도에서 소량의 액체 A를 실린더에 넣고 피스톤을 천천히 끌어 올리면서 압력을 측정한 것이다. 실험 Ⅱ는 A 대신에 같은 질량의 액체 B를 사용하여 실험 Ⅰ과 같은 방법으로 측정한 것이다. 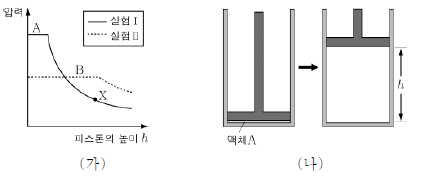
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
6. 그림은 서로 다른 조건에서 물이 담긴 실린더에 산소 기체를 넣어 준 모습을 나타낸 것이다. 0℃와 22℃에서 물의 수증기압은 각각 5mmHg와 20mmHg이며, 대기압은 760mmHg, 추에 의한 압력은 740mmHg이다. 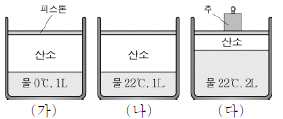
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 산소 기체는 헨리의 법칙을 만족하며, 피스톤의 무게와 마찰은 무시한다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
7. 그림 (가)와 (나)는 각각 수소 원자의 2s오비탈과 2p오비탈에서 원자핵으로부터의 거리에 따른 전자 발견 확률을 나타낸 것이다. 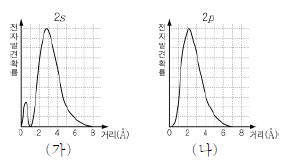
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
8. 그림은 반응 2NO2 + F2 → 2NO2F의 반응 메커니즘을 모형으로 나타낸 것이다. 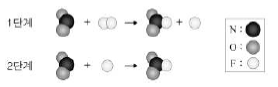
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
9. 표는 원자번호가 연속적인 3주기 세 가지 원소의 순차적 이온화 에너지(En)에 관한 자료이며, A, B, C는 원자번호 순서와 관계없이 임의로 나타낸 것이다. 
A ~ C에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
10. 그림은 상온에서 고체 상태로 존재하는 4가지 물질을 주어진 기준에 따라 구분한 것이다. 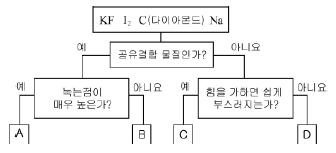
A ~ D에 대한 설명으로 옳지 않은 것은?
- A는 입체적인 그물 구조를 갖는다.
- B는 물보다 헥산에 잘 녹는다.
- B와 D가 반응할 때 전자의 이동이 일어난다.
- C는 고체 상태에서 전기전도성이 있다.
- D에는 자유 전자가 존재한다.
11. 그림은 할로겐 원소 X, Y, Z가 기체 상태의 이원자 분자를 형성할 때 핵간 거리에 따른 에너지를 나타낸 것이다. 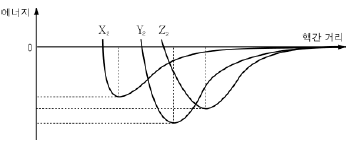
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, X, Y, Z는 임의의 기호이다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
12. 그림은 ‘자체 냉각’ 음료수 캔의 구조를 간단히 나타낸 것이다. 이 캔은 음료수를 담은 A 부분과 고체 탄산나트륨이 들어있는 B부분으로 이루어져 있다. B 부분에 물을 부으면 다음과 같은 반응이 일어나면서 음료수가 시원해진다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
13. 표는 3가지 질소 화합물의 분자 모양과 끓는점을 나타낸 것이다. 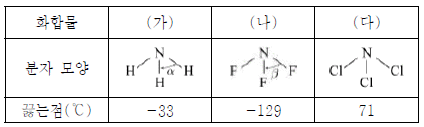
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
14. 그림은 기체 A의 분해 반응 (가)와 기체 B의 분해 반응 (나)에서 시간에 따른 기체 A와 기체 B의 농도 변화를 나타낸 것이다. 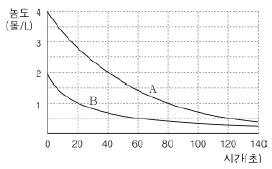
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
15. 다음은 기체 A가 분해되어 기체 B를 생성하는 열화학 반응식과 반응 시간에 따른 A(g)와 B(g)의 농도를 나타낸 것이다. 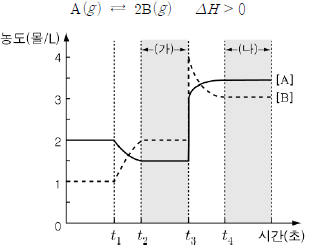
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
16. 다음은 몇 가지 열화학 반응식을 나타낸 것이다. 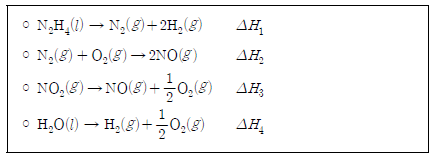
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
17. 그림은 25℃에서 산HA와 HB를 30mL씩 취하여 0.1M NaOH 수용액으로 각각 적정한 중화적정 곡선이다. 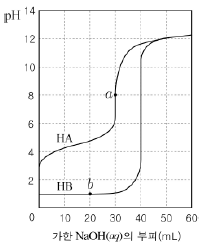
이에 대한 설명으로 옳은 것은? [3점]
- 산의 세기는 HA > HB 이다.
- 산의 농도는 HA > HB 이다.
- a점에서 [Na+] > [A-]이다.
- b점의 용액은 완충 용액이다.
- 중화점까지 생성된 물의 양은 HA와 HB가 같다.
18. 다음은 약한 산 HA와 HB의 이온화 평형과 이온화 상수를 나타낸 것이다. 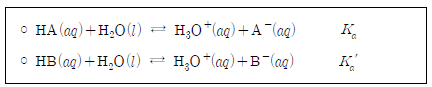
HA수용액과 NaB수용액을 혼합하였더니 다음과 같은 평형을 이루었다. 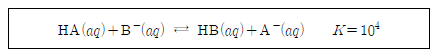
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
19. 다음은 표백제 속에 들어 있는 OCl-의 양을 구하기 위한 실험 방법과 관련 반응식을 나타낸 것이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
20. 그림과 같은 장치를 이용하여 CuCl2 수용액과 Mg(NO3)2 수용액에 9650초 동안 0.1A의 전류를 흘려주었다. 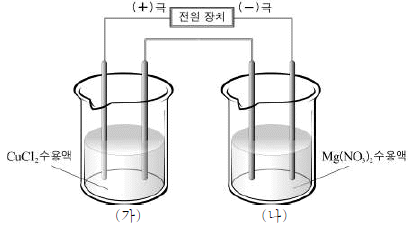
이에 대한 설명으로 옳은 것은? (단, Cu와 Mg의 원자량은 각각 64와 24이며, 1F는 96500C, 전극은 백금을 사용하였다.)
- (가)의 (+)극에서 환원 반응이 일어난다.
- (가)의 (-)극의 질량은 0.64g 증가한다.
- (나)의 두 전극에서 생성되는 물질의 몰 수는 같다.
- (나)의 (+)극 주변 용액의 pH는 감소한다.
- (나)의 (-)극의 질량은 0.12g 증가한다.






이유는 분자의 크기는 분자량과 밀도에 영향을 받는데, 이 표에서는 물질 A가 가장 높은 분자량과 가장 높은 밀도를 가지고 있고, 물질 B가 가장 낮은 분자량과 가장 낮은 밀도를 가지고 있으며, 물질 C는 그 중간에 위치하고 있다. 따라서 A > C > B 순으로 분자수가 많다고 볼 수 있다.