1과목: 과목구분없음
1. 그림 (가)와 같이 실린더에 기체 A와 B를 넣고, 피스톤의 고정 장치를 풀었더니 (나)와 같이 되었다. 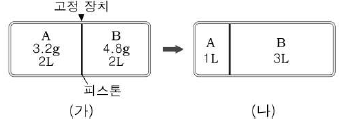
기체 A와 B의 분자량 비는? (단, 온도는 일정하게 유지된다.)
- 1 : 1
- 1 : 2
- 1 : 3
- 2 : 1
- 2 : 3
2. 다음은 기체의 성질을 알아보기 위한 실험이다. 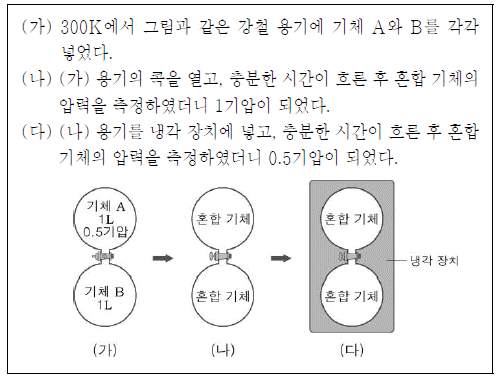
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 기체 A, B는 서로 반응하지 않으며 상태 변화는 없다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
3. 다음은 2A(g) + B(g) → 2C(g) 반응에서 기체의 양적 관계를 확인하기 위한 실험이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 기체 상수 R은 0.082기압ㆍL/몰ㆍK이고, 반응전후 온도 변화는 없다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
4. 그림은 일정한 압력에서 1몰의 이상 기체와 기체 A의 온도에 따른 부피를 나타낸 것이다. 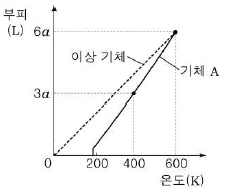
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
5. 그림은 실린더에 들어 있는 기체 A가 분출되는 모습을, 표는 기체 A~C의 분자량과 분자의 평균 운동 속력을 나타낸 것이다. 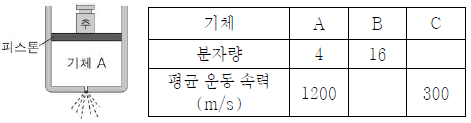
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 기체가 분출되는 동안 실린더 내부의 온도와 압력은 변하지 않고, 피스톤의 질량과 마찰은 무시한다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
6. 그림 (가) ~ (다)는 서로 다른 조건에서 동일한 용기 속에 들어 있는 기체가 물에 녹아 용해 평형을 이루었을 때의 모습을 나타낸 것이다. 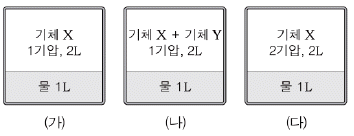
(가) ~ (다)에서 물 1L에 용해된 기체 X의 질량을 옳게 비교한 것은? (단, 온도는 동일하고, 물의 증기 압력은 무시하며, 기체 X와 Y는 헨리의 법칙을 따른다.)
- (가) = (나) = (다)
- (가) = (다) > (나)
- (다) > (가) = (나)
- (다) > (가) > (나)
- (다) > (나) > (가)
7. 그림 (가)는 석영과 석영 유리의 구조를, (나)는 석영과 석영 유리의 온도에 따른 밀도를 나타낸 것이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
8. 그림은 1기압, 400K의 헬륨(He) 1L를 온도와 부피를 차례로 변화 시켰을 때, 시간에 따른 1/압력을 나타낸 것이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
9. 다음은 서로 다른 두 액체의 증기 압력을 비교하기 위한 실험이다. 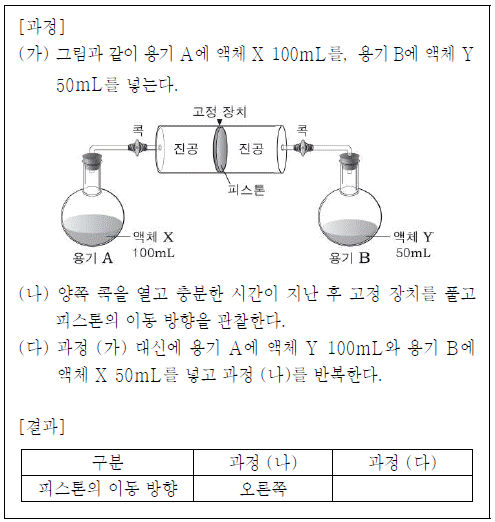
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 온도는 일정하게 유지되며, 피스톤의 마찰은 무시한다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
10. 그림은 부피가 같은 용기 (가)~(다)에 두 기체 X와 Y가 서로 다른 조건으로 채워져 있는 모습을 나타낸 것이다. 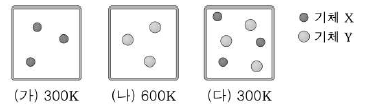
용기 속 기체에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 기체 Y의 분자량은 X의 2배이고, 기체 X와 Y는 반응하지 않는다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
11. 그림은 물(H2O)과 에탄올(C2H5OH)에 아세트산(CH3COOH)을 각각 녹여 만든 용액을 나타낸 것이다. 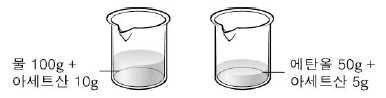
두 용액의 물리량이 같은 것만을 <보기>에서 있는 대로 고른 것은? [3점]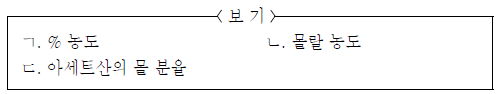
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
12. 그림은 물100g에 최대로 녹을 수있는 용질 A와 B의 몰수를 온도에 따라 나타낸 것이다. 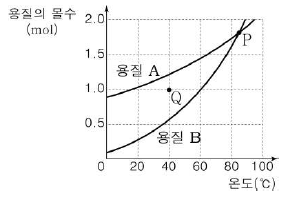
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, A와 B의 화학식량은 각각 85, 101이다.) [3점]
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄱ, ㄴ, ㄷ
13. 그림은 물과 에탄올을 사용하여 동일한 사인펜 색소 성분을 같은 시간 동안 분리한 모습을 각각 나타낸 것이다. 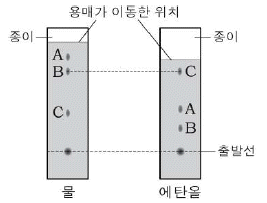
성분 A~C에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 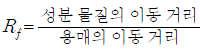 이다.)
이다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
14. 다음은 고체 X와 Y의 혼합물에서 순수한 고체 X를 얻기 위한 과정과 온도에 따른 고체의 용해도를 나타낸 것이다. 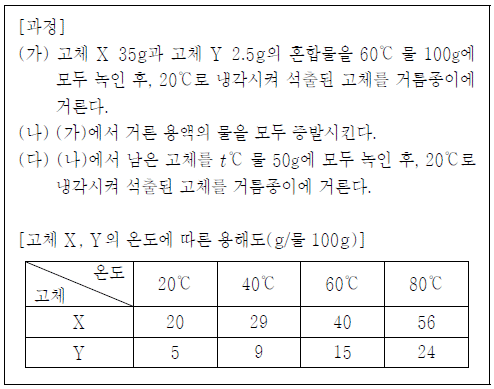
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 고체 X와 Y의 용해도는 서로에 영향을 주지 않는다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
15. 다음과 같이 수산화나트륨(NaOH) 수용액을 만들었다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, NaOH의 화학식량은 40이고, 물의 증발은 무시한다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
16. 그림은 1기압에서 벤젠 100g에 용질 0.1몰을 녹인 용액에 벤젠을 추가하였을 때, 추가한 벤젠의 질량에 따른 용액의 어는점을 나타낸 것이다. 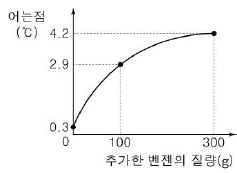
벤젠의 어는점은? (단, 용질은 비휘발성이다.) [3점]
- 4.5℃
- 4.8℃
- 5.2℃
- 5.5℃
- 5.8℃
17. 그림은 서로 다른 온도 T1, T2에서 일정한 양의 물에 녹아 있는 용질 A와 B의 질량에 따른 수용액의 증기 압력을 나타낸 것이다. 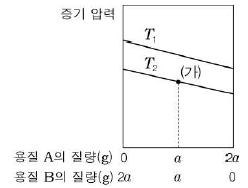
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 용질 A와 B는 비휘발성이고 비전해질이며, 모든 용액은 라울의 법칙을 따른다.) [3점]
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄱ, ㄴ, ㄷ
18. 다음은 물질 X의 상평형 그림을 나타낸 것이다. 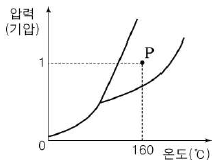
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
19. 수용액 (가) ~ (라)에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 물의 끓는점은 100℃이다.) [3점](19번 공통지문 문제)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ





