1과목: 과목구분없음
1. 그림은 고체 (가)와 (나)의 결정 구조를 모형으로 나타낸 것이다. 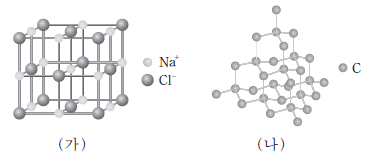
(가)와 (나) 결정의 종류로 옳은 것은? (순서대로 가, 나)
- 금속 결정, 공유 결정
- 분자 결정, 금속 결정
- 분자 결정, 이온 결정
- 이온 결정, 공유 결정
- 이온 결정, 금속 결정
2. 그림은 3 가지 원자 모형을 나타낸 것이다. 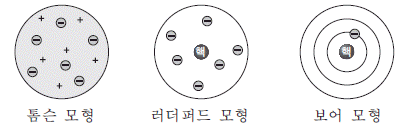
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
3. 표는 임의의 원자 또는 이온 X~Z 에 대한 자료이다. 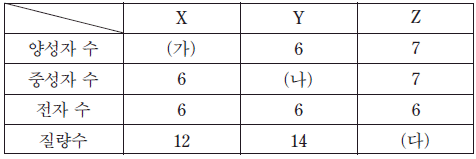
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
4. 다음은 영희가 기체 용해도와 관련된 어떤 가설을 검증하기 위해 설계한 실험 과정을 나타낸 것이다. 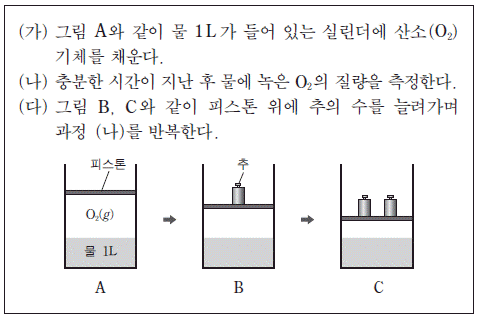
실험을 통해 검증하고자 하는 가설로 가장 적절한 것은? (단, 온도와 대기압은 일정하다.)
- 물의 양이 증가하면 물에 녹는 기체의 질량은 증가한다.
- 기체의 극성이 클수록 물에 녹는 기체의 질량이 증가한다.
- 기체의 압력이 증가하면 물에 녹는 기체의 질량은 증가한다.
- 기체의 온도가 증가하면 물에 녹는 기체의 질량은 감소한다.
- 같은 조건에서 기체의 종류에 따라 물에 녹는 질량이 달라진다.
5. 그림은 성분이 A~C인 혼합물의 종이 크로마토그래피 실험 결과를, 표는 각 성분의 Rƒ 값을 나타낸 것이다. 이 실험에서 물을 용매로 사용하였고, (가)~(다)는 각각 A~C 중 하나이다. 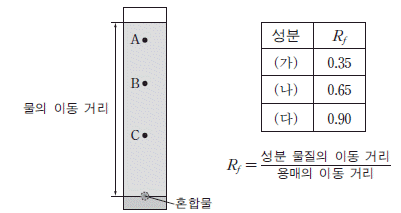
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 물과 성분 물질 사이의 인력 차이는 무시한다.) [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄷ
- ㄴ, ㄷ
6. 표는 할로겐화수소 화합물 A~C에 관한 자료이다. 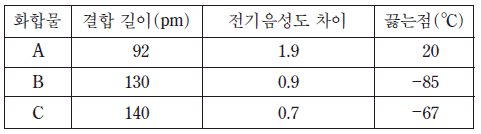
A~C에 대한 설명으로 옳은 것은? [3점]
- 분자량은 A가 C보다 크다.
- 분산력은 B가 C보다 크다.
- 극성의 크기는 B가 A보다 크다.
- 분자 간 인력은 C가 B보다 크다.
- 전기음성도 차이가 클수록 끓는점이 높아진다.
7. 그림 (가)는 이온 화합물에서 핵간 거리(r)에 따른 에너지를, (나)는 이온 화합물 A~C의 녹는점을 나타낸 것이다. A~C는 각각 NaF, NaCl, NaBr 중 하나이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
8. 그림은 온도에 따라 액체 A, B의 증기 압력(P)을 물의 증기 압력(Pw)으로 나눈 값을 나타낸 것이다. 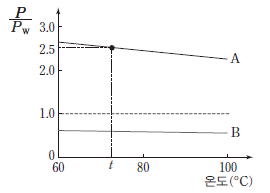
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, t℃에서 물의 증기 압력은 240mmHg이다.)
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
9. 그림은 고체 A와 B의 물에 대한 용해도를 온도에 따라 나타낸 것이고, 표는 A 수용액 (가)와 B 수용액 (나)에 대한 자료이다. 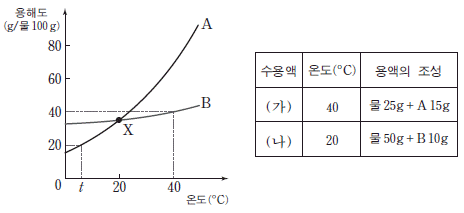
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
10. 그림은 2, 3 주기에 속하는 원소 A~D의 원자가 전자 수에 따른 전자 친화도를 나타낸 것이고, 표는 각 원소의 원자 반지름을 나타낸 것이다. 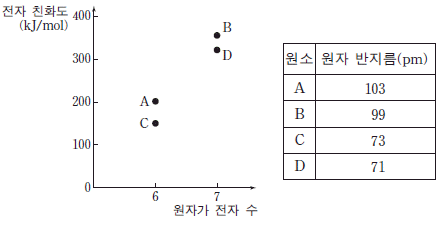
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, A~D는 임의의 원소 기호이다.)
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
11. 그림은 1 기압에서 물 100 g 에 용질 A를 a g 녹여 만든 수용액을 일정한 열원으로 가열했을 때 시간에 따른 수용액의 온도를 나타낸 것이다. 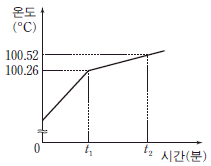
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, A 는 비전해질, 비휘발성이고 물의 몰랄 오름 상수 Kb=0.52℃/m이다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
12. 그림은 5 가지 분자를 주어진 기준에 따라 분류한 것이다. 
(가)와 (나)로 옳은 것은? (순서대로 가, 나)
- CH2Cl2, BF3
- CH2Cl2, CH4
- H2O, BF3
- H2O, CH4
- H2O, CO2
13. 그림은 바닥 상태에 있는 2 주기 중성 원자 A~D의 양성자 수에 따른 홀전자 수를 나타낸 것이다. 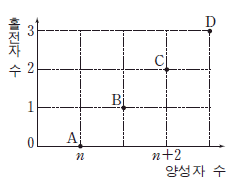
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, A~D는 임의의 원소 기호이다.) [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
14. 그림은 25℃에서 진공 상태의 두 용기에 용질 A와 B의 수용액을 각각 넣고 평형에 도달한 상태를 나타낸 것이다. 두 수용액의 퍼센트 농도는 같다. 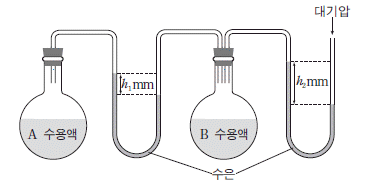
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, A 와 B 는 비전해질, 비휘발성이고 대기압은 760mmHg이다.) [3점]
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄱ, ㄴ, ㄷ
15. 그림은 어떤 산 HA 시약병에 붙어 있는 표지를 나타낸 것이다. 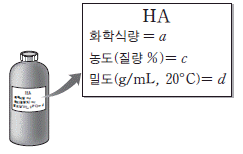
영희는 20℃ 에서 다음과 같은 실험을 수행하였다. 
(나)에서 만든 용액의 몰 농도(M)로 옳은 것은?
16. 그림은 아크릴로니트릴(C3H3N)의 구조식으로 비공유 전자쌍과 다중 결합은 나타내지 않았다. ㉠~㉢은 결합 길이이고 a, b는 결합각이다. 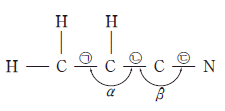
루이스 구조식과 전자쌍 반발 모형에 근거하여 이 분자에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
17. 그림은 용기에 들어 있는 기체 A~C를 나타낸 것이고, 표는 각 기체에 대한 분자량과 상태를 나타낸 것이다. 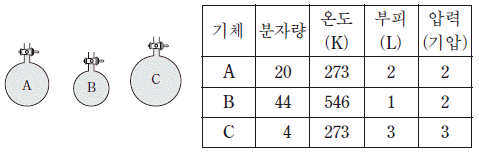
기체 A~C에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
18. 그림 (가)는 수소 원자의 주양자수(n)에 따른 에너지 준위 (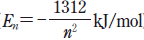 )와 전자 전이의 일부를, (나)는 수소 원자에서 핵으로부터의 거리에 따른 1s, 2s, 2p 오비탈의 전자 존재 확률을 나타낸 것이다.
)와 전자 전이의 일부를, (나)는 수소 원자에서 핵으로부터의 거리에 따른 1s, 2s, 2p 오비탈의 전자 존재 확률을 나타낸 것이다. 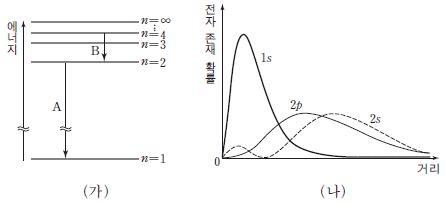
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
19. 그림은 1 기압에서 물질 A의 온도에 따른 밀도를 나타낸 것이고, 표는 A의 삼중점의 온도와 압력을 나타낸 것이다. t℃에서 A는 고체이다. 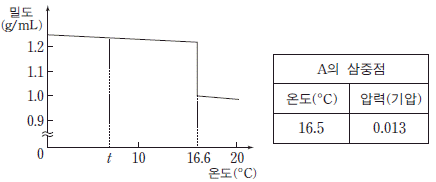
A에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, A의 고체상은 1 종류이다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
20. 그림은 온도 T, 부피 V 인 강철 용기에 탄화수소(CxHy)와 산소(O2)가 들어 있는 반응 전 상태와 CxHy가 모두 완전 연소된 반응 후의 상태를 나타낸 것이다. P전체는 용기 내 기체의 전체 압력이고 PO2는 O2 의 부분 압력이다. 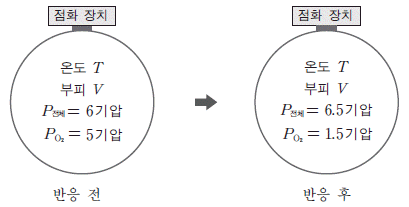
반응 후 이산화탄소의 몰분율로 옳은 것은? (단, 온도 T에서 반응물과 생성물은 모두 기체이다.) [3점]
- 2/13
- 4/13
- 6/13
- 8/13
- 10/13






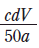
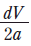
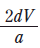

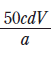
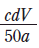 " 이다.
" 이다.
(가)는 이온 결정으로, 이온들이 전하를 서로 교환하여 결합하는 것을 말한다. 이온 결정은 전기적으로 중성인 결정이며, 일반적으로 금속과 비금속의 화합물에서 나타난다.
(나)는 공유 결정으로, 원자들이 전자를 공유하여 결합하는 것을 말한다. 공유 결정은 전기적으로 중성인 결정이며, 일반적으로 비금속 화합물에서 나타난다.
따라서, "이온 결정, 공유 결정"이 정답이다.