1과목: 과목구분없음
1. 다음은 액체에 대한 학생들의 대화이다. 
제시한 의견이 옳은 학생만을 있는 대로 고른 것은?
- X
- Z
- X, Y
- Y, Z
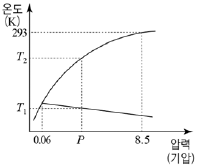
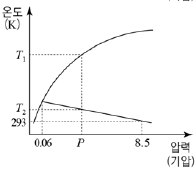
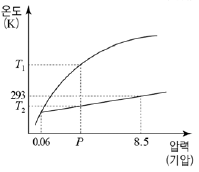
- X, Y, Z
2. 표는 물질 (가)~(다)에 대한 자료이다. 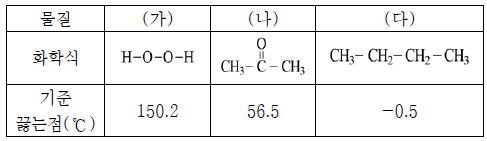
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
3. 그림은 일정한 온도에서 A 수용액 (가)와 (나)를 나타낸 것이다. 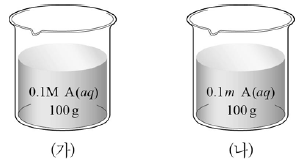
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, (가)의 밀도는 1 gmL이며, A의 분자량은 60이다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
4. 그림 (가)는 이산화황(SO2)과 질소(N2) 기체 혼합물에 산화 칼슘(CaO) 가루를 넣은 것을, (나)는 (가)의 온도를 높여 이산화황(SO2)이 모두 제거된 상태를 나타낸 것이다. 질소(N2)는 반응하지 않는다. 
(가)에서 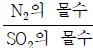 는? (단, 모든 기체는 이상 기체로 가정하고, 고체의 부피, 피스톤의 마찰은 무시한다.)
는? (단, 모든 기체는 이상 기체로 가정하고, 고체의 부피, 피스톤의 마찰은 무시한다.)
- 1/4
- 1/3
- 4/5
- 3
- 4
5. 그림은 어떤 이온 화합물 결정의 단위세포 모형이며, 단위세포 한 변의 길이는 2a이다. 입자는 한 변의 길이가 a인 정육면체 하나에 대해서만 나타내었다. 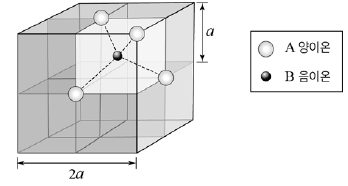
A 양이온은 면심 입방 구조이고, B 음이온은 한 변의 길이가 a인 8개의 정육면체 중심에 각각 위치한다. 이 화합물의 화학식으로 옳은 것은? (단, A와 B는 임의의 원소 기호이다.)
- AB
- AB2
- AB3
- A2B
- A2B3
6. 그림 (가)는 t1℃에서 진공인 용기에 액체 A와 B를 넣고 평형에 도달한 상태를, (나)는 액체 A와 B의 증기 압력 곡선을 순서 없이 나타낸 것이다. 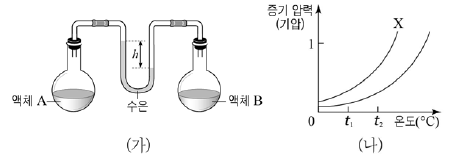
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
7. 다음은 물질 X에 대한 자료이다. 
물질 X의 상평형 그림으로 가장 적절한 것은? [3점]
8. 그림 (가)는 온도 T에서 고체 염화 나트륨(NaCl)이 자발적으로 용해되는 과정의 모형을, (나)는 이 과정의 ⊿H와 T⊿S를 나타낸 것이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, ⊿H = ⊿H1 + ⊿H2이다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
9. 다음은 25℃에서 3가지 물질의 표준 환원 전위(E°)와 이 물질과 관련된 산환 환원 반응의 표준 자유 에너지 변화(⊿G°)를 나타낸 것이다. 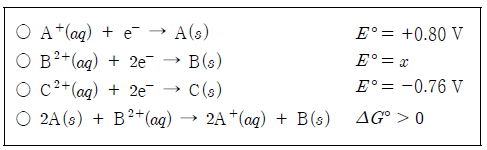
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, A~C는 임의의 금속 원소 기호이다.) [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄷ
- ㄴ, ㄷ
10. 다음은 25℃에서 HA와 HB의 이온화 반응식과 이온화 상수(Ka)를 나타낸 것이다. 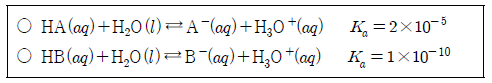
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
11. 그림은 25℃, 1 기압에서 아이오딘화 수소(HI) 기체가 생성되는 반응과 관련된 엔탈피(H) 변화를 나타낸 것이다. 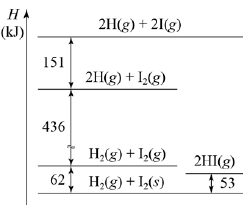
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
12. 그림은 고체 X와 Y의 용해도 곡선을 나타낸 것이다. 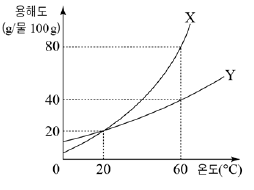
60℃에서 포화 상태의 X수용액 xg과 Y 수용액 yg의 온도를 20℃로 낮추어 석출되는 고체 X와 Y의 질량비가 3 : 2일 때, x/y 는? (단, 물의 증발은 무시한다.)
- 1/3
- 1/2
- 4/7
- 9/14
- 9/7
13. 다음은 기체 A가 반응하여 기체 B가 생성되는 반응의 열화학 반응식이다. 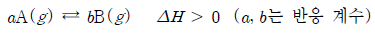
표는 온도 T1과 T2에서 각각 1 L의 강철 용기에 1.0 몰의 기체 A를 넣고 반응시켜 평형 상태에 도달했을 때 A와 B의 몰 농도(M)를 나타낸 것이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
14. 그림은 1 기압에서 어떤 반응의 온도(T)에 따른 엔탈피 변화 (⊿H)와 자유 에너지 변화(⊿G)를 나타낸 것이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
15. 그림 (가)는 물 100 g에 A를, (나)는 물 50 g에 A 3g이 녹아 있는 용액에 B를 녹인 용액이다. 그래프는 (가)와 (나)에서 각각 A와 B xg을 녹인 용액의 끓는점을 나타낸 것이다. 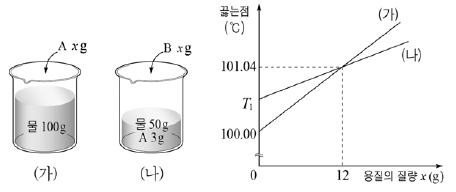
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, A와 B는 비휘발성, 비전해질이며 서로 반응하지 않고, 대기압은 일정하다. 물의 몰랄 오름 상수(Kb)는 0.52 ℃/m이다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
16. 그림 (가)는 금속 이온 X2+, Y+이 녹아 있는 수용액의 전기 분해 장치를, (나)는 2 A의 전류를 흘려준 시간에 따른 X2+의 몰수를 나타낸 것이다. 수소 기체는 3t 이후에 발생하였다. 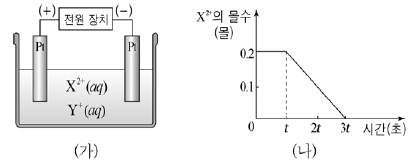
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, X, Y는 임의의 원소 기호이고, 패러데이 상수는 96500 C/몰이다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
17. 다음은 기체 X와 Y의 열화학 반응식이다. 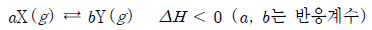
그림은 강철 용기에서 X와 Y 혼합 기체의 시간에 따른 전체 압력과 어느 한 기체의 부분 압력을 나타낸 것이다. 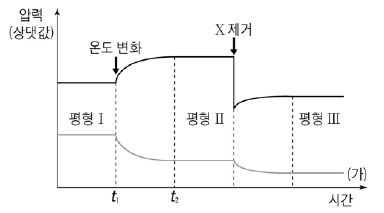
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, t2이후 온도는 변하지 않는다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
18. 표는 25℃에서 0.1M 산 HA(aq) 100mL에 0.1M NaOH(aq)을 넣은 결과이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 25℃에서 물의 이온곱 상수(Kw)는 1×10-14이고, 모든 수용액의 온도는 일정하다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
19. 표는 25℃, 1기압에서 3가지 물질의 반응 엔탈피(ΔH)를 나타낸 것이다. 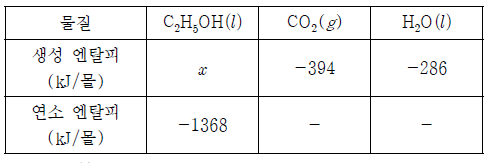
C2H5OH(l)의 생성 엔탈피(⊿H) x는?
- -116
- -278
- -556
- -688
- -3014
20. 다음은 일정한 온도에서 기체의 반응에 대한 실험이다. 
이에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? (단, 연결관의 부피는 무시한다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ







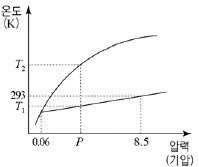
 "
"