1과목: 과목구분없음
1. 그림은 물(H2O) 분자 사이의 결합 (A)을 나타낸 것이다. 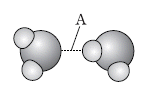
A에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
2. 다음은 어떤 에너지원에 대한 설명이다. 
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
3. 다음은 이산화탄소(CO2)분자량을 구하기 위한 실험 과정의 일부이다. 
실험에서 얻은 측정량을 이용하여 CO2의 분자량을 계산할 때, 더 측정해야 하는 값만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
4. 그림은 수소 화합물(XHn) (가)~(다)의 분자량에 따른 기준 끓는점을 나타낸 것이다. (가)~(다)의 X는 각각 P, S, Cl중 하나이다. 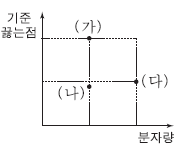
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, P, S, Cl의 원자량은 각각 31, 32, 35.5이다.)[3점]
- ㄱ
- ㄴ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
5. 다음은 물(H2O)에 대한 실험이다. 
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
6. 표는 반응 조건 Ⅰ과 Ⅱ에서 일어나는 반응 A(g)→B(g)에 대한 자료이고, 그림은 온도 TⅠ과 TⅡ에서 A(g)의 분자 운동에너지 분포 곡선을 나타낸 것이다. 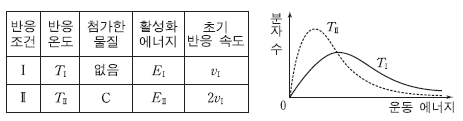
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, Ⅰ과 Ⅱ에서 A의 초기 농도는 같다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
7. 다음은 금속 A~C의 산화 환원 반응식과 이와 관련된 자료이다. 
A(s)와 C(s)를 전극으로 사용하고 이 두 전극을 각각 1M A2+(aq)과 1M C+(aq)에 담긴 화학 전지를 만들었다. 25℃에서 이 전지의 표준 전지 전위(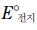 )는? [3점]
)는? [3점]
- a-c
- a-2c
- a+2c
- -a+c
- -a+2c
8. A와 B가 반응하여 C를 생성한다. 그림 (가)는 온도 T1에서 A의 초기 농도([A<]sub>0)가 0.2M일 때 B의 초기 농도([B]0)에 따른 초기 반응 속도(v0)를 (나)는 온도 T2에서 [B]0가 0.4M일 때 [A]0에 따른 v0을 나타낸 것이다. 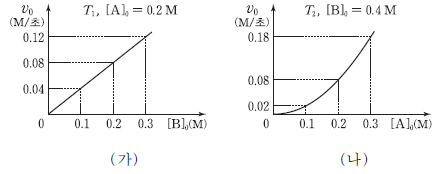
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
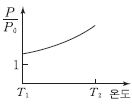
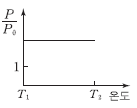
9. 그림은 물에 대한 X(s)의 용해도 곡선이다. 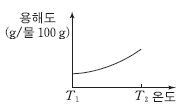
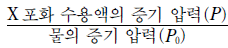 을 온도에 따라 나타낸 것으로 가장 적절한 것은? (단, X는 비휘발성, 비전해질성이고, X 포화 수용액은 라울 법칙을 따른다.)
을 온도에 따라 나타낸 것으로 가장 적절한 것은? (단, X는 비휘발성, 비전해질성이고, X 포화 수용액은 라울 법칙을 따른다.)
10. 다음은 1기압에서 A수용액에 대한 실험과 자료이다. 
x는? (단, A는 비휘발성, 전해질이고, (가)와 (나)에서의 온도는 같다.)
- 5/11
- 1/2
- 3/2
- 25/11
- 5/2
11. 그림 (가)와 같이 실린더에 들어 있는 물질 A가 단위 시간 당 일정한 열을 흡수한다. 
그림 (나)는 가열 시간에 따른 A의 상을 나타낸 것이다. A의초기 온도는 40℃이고, A의 기준 어느점과 기준 끓는점은 각각 80℃와 220℃이다. 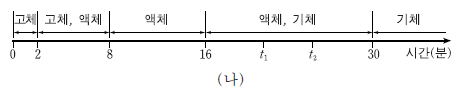
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 대기압은 1기압이고 피스톤의 질량과 마찰은 무시한다.) [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
12. 그림은 0.1M HA(aq) 10mL에 xM NaOH(aq)을 5mL 첨가한 것을 나타낸 것이다. 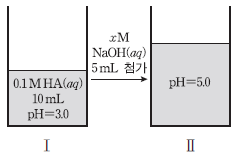
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 수용액의 온도는 일정하다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
13. 그림은 반응물( )과 생성물(
)과 생성물( )을 포함하는 초기 상태(Ⅰ)의 기체 혼합물이 자발적으로 반응하여 평형 상태(Ⅱ)에 도달한 것을 모형으로 나타낸 것이다. 이 반응의 엔탈피 변화와 자유 에너지 변화는 각각 ⊿H와 ⊿G이다.
)을 포함하는 초기 상태(Ⅰ)의 기체 혼합물이 자발적으로 반응하여 평형 상태(Ⅱ)에 도달한 것을 모형으로 나타낸 것이다. 이 반응의 엔탈피 변화와 자유 에너지 변화는 각각 ⊿H와 ⊿G이다. 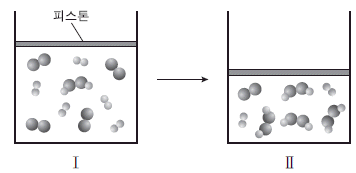
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 온도와 대기압은 일정하고 피스톤의 마찰은 무시한다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
14. 다음은 물질 X의 2가지 상변화에 대한 열화학 반응식이다. 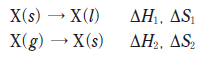
표는 X의 상평형 그림에서 온도와 압력이 다른 3가지 상태 (가)~(다)에 대한 자료이다. 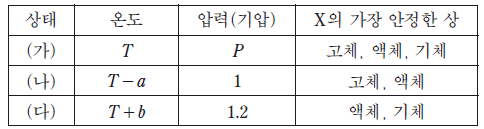
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, a와 b는 양의 값이다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
15. 그림 (가)는 1기압에서 반응 X(α)→X(β)의 온도에 따른 자유 에너지 변화(⊿G)를, (나)는 X의 상평형 그림을 나타낸 것이다. X(α)와 X(β)의 상은 각각 고체, 액체, 기체 중 하나이다. 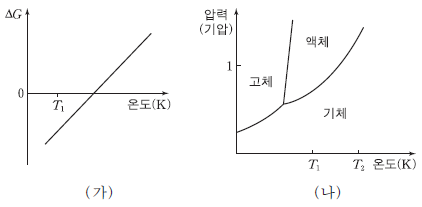
1기압에서 이 반응에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
16. 다음은 25℃에서 NaH과 관련된 자료이다. 
이 자료로부터 구한 반응 NaH(s) → Na+(g) + H-(g)의 반응 엔탈피(⊿H)는? [3점]
- 692KJ
- 804KJ
- 877KJ
- 933KJ
- 1022KJ
17. 다음은 A로부터 B와 C가 생성되는 열화학 반응식이다. 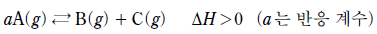
그림 (가)는 A(g), B(g), C(g)가 평형에 도달한 것을 (나)와 (다)는 조건을 변화시켜 새로운 평형에 도달한 것을 나타낸 것이다. 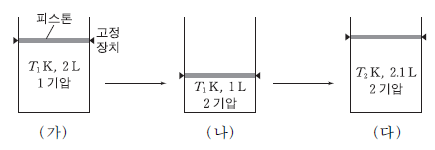
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 실린더 속 기체의 전체 질량은 일정하다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
18. 다음은 A로부터 B가 생성되는 화학 반응식이다. 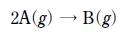
그림은 1몰의 A(g)를 강철 용기에 넣고 반응시켰을 때 시간에 따른 용기 내 전체 기체의 압력을 나타낸 것이다. 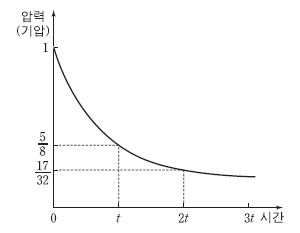
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, 온도는 일정하다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
19. 다음은 C와 CO2로부터 CO가 생성되는 화학 반응식과 평형상수(K)이다. 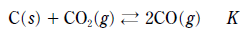
그림은 온도 T1에서 2L의 강철 용기에 CO2(g)를 넣은 후, C(s)를 첨가하고 가열하여 반응시켰을 때 반응 전과 반응 후 평평 상태를 나타낸 것이다. T2에서 K=1.8이고 C(s)의 밀도는 2.2g/mL이다. 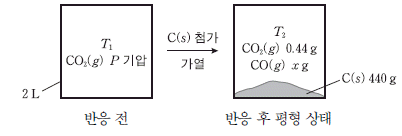
P는? (단, C와 O의 원자량은 각각 12와 16이고, RT1=20기압·L/몰이다.)
- 9/10
- 1
- 10/9
- 14/9
- 19/10
20. 표는 용액 (가)~(라)에 대한 자료를 그림은 1기압에서 (가)~(다)를 각각 가열할 때 시간에 따른 용액의 온도를 나타낸 것이다. 용매로 사용한 A와 B의 기준 끓는점은 각각 78℃, 80℃이다. 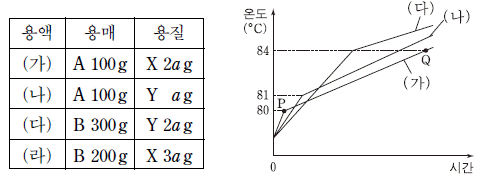
이에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은? (단, X와 Y는 비휘발성, 비전해질이다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ






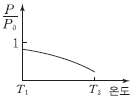
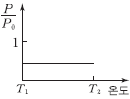

 "이다.
"이다.