1과목: 과목 구분 없음
1. 1 bar, 100℃의 액상의 물이 같은 온도에서 수증기로 상태의 변화가 있을 때 엔탈피[kJ/kg] 변화량으로 가장 가까운 값은? [단, 1 bar, 100℃ 물과 수증기의 포화상태에서의 비 내부에너지(internal energy)는 각각 420kJ/kg, 2,500kJ/kg이며 수증기는 이상기체(=0.46J/g · K)로 간주한다.]
- 2,080
- 2,252
- 2,126
- 2,034
2. 수소와 질소가 정상상태에서 각각 100mol/min의 같은 유량으로 <보기>와 같이 암모니아를 만드는 반응기에 공급된다. 반응기 밖으로 나오는 암모니아의 유량이 50mol/min이라면 반응기에서 배출되는 기체의 총 유량 [mol/min]은? (단, 조건 이외의 추가 유입물질과 유출 물질은 없다.)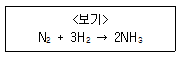
- 200
- 150
- 100
- 50
3. 열역학에서 상태 함수(state function)가 아닌 것은?
- 일
- 엔탈피
- 엔트로피
- 내부에너지
4. 어떤 버너가 효율적인 완전 연소를 위해 50% 과잉공기로 운전하도록 설계되었다. 버너에 메탄(CH4)을 30L/min의 유량으로 공급한다면 공급해야할 공기의 유량[L/min]은? (단, 공기 중 산소의 농도는 20mol%로 가정한다.)
- 450
- 300
- 90
- 60
5. 관 유동에서 Re(Reynolds number)가 1,600으로 계산 되었다. Fanning 마찰계수(fF)의 값은?
- fF=0.000625
- fF=0.0025
- fF=0.005
- fF=0.01
6. 2성분계 혼합물을 상압에서 정류하고자 한다. 비점에서 정류탑에 공급되는 혼합 용액 중 휘발성 성분의 조성이 60mol%이고, 최소환류비가 0.8로 주어질 때 탑상 제품중 휘발성 성분의 조성(xp)은? (단, 휘발성 성분의 상대휘발도는 2로 일정하다.)
- xp=0.75
- xp=0.81
- xp=0.87
- xp=0.93
7. 총압력 250kPa과 300K의 기체혼합물 1kmol에는 부피비로 20% CH4, 30% C2H6 그리고 50% N2를 포함하고 있다. 이들 기체의 절대속도는 모두 같은 방향(x방향)으로 각각 15m/s, -10m/s 그리고 -5m/s이다. 이 혼합기체의 몰평균 속도(molar average velocity)에 기준한 확산 플럭스 JCH4[mol/m2· s]로 가장 옳은 것은? (단, 기체상수 R=8.31J/mol · K이다.)
- 351
- 301
- 251
- 201
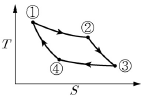
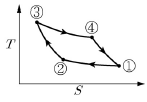
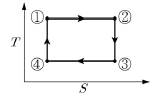
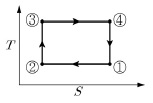
8. <보기>의 카르노(Carnot) 엔진 사이클의 PV선도를 TS선도로 바르게 나타낸 것은?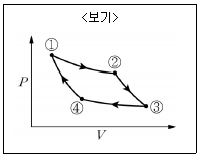
9. 전달함수가 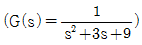 로 주어지는 2차 제어시스템의 비례상수(gain, Kc), 시간상수(time constant, τ)와 감쇠비(damping ratio, δ)는?
로 주어지는 2차 제어시스템의 비례상수(gain, Kc), 시간상수(time constant, τ)와 감쇠비(damping ratio, δ)는?
- Kc=1/3, τ=1/9, δ=1/2
- Kc=1/9, τ=1/2, δ=1/3
- Kc=1/3, τ=1/2, δ=1/9
- Kc=1/9, τ=1/3, δ=1/2
10. McCabe-Thiele 법으로 증류탑을 설계할 때, 이 탑의 어떤 단(n)에서 조작선의 식을 작도하였더니 <보기>와 같이 y 절편이 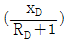 이었다. 이 조작선의 기울기(slope)는? (단, RD는 환류비이다.)
이었다. 이 조작선의 기울기(slope)는? (단, RD는 환류비이다.)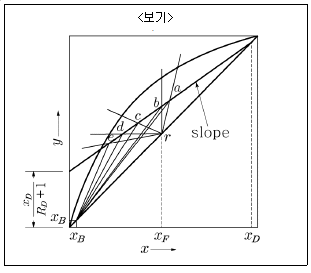
-
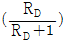
-
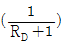
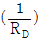
- 1
11. 90℃에서 80mol% 벤젠과 20mol% 톨루엔이 혼합된 이상 용액이 기-액 평형에 있다고 할 때, 기상에서 톨루엔의 몰분율은? (단, 90℃에서 벤젠과 톨루엔의 증기압은 각각 P*벤젠=900mmHg, P*톨루엔=400mmHg이다.)
- 0.1
- 0.3
- 0.7
- 0.9
12. 뉴턴 유체(Newtonian fluid)가 단면적이 0.1m2인 원통형 관을 통해 층류(laminar flow)로 흐르고 있다. 이 유체의 최대 유속(maximum velocity)이 6cm/s일 때, 부피 유량[cm3/s]은?
- 300
- 600
- 3,000
- 6,000
13. <보기>와 같은 특징을 갖는 피드백제어기는?
- 비례 제어기
- 비례-적분 제어기
- 비례-미분 제어기
- 비례-적분-미분 제어기
14. Prandtl수(Pr)에 대한 설명으로 가장 옳은 것은?
- Pr은 운동량확산계수에 대한 열확산계수의 비이다.
- Pr이 1보다 클 때 유체동역학적 층은 열경계 층보다 얇다.
- 기체의 점도와 열확산계수는 온도에 따라 같은 율로 증가되기 때문에 기체의 Pr은 온도에 거의 무관하다.
- 액상금속의 경우 기체나 액체에 비해 매우 높은 Pr을 갖는다.
15. 5질량(wt)%의 NaOH 수용액 100g을 20질량(wt)%의 수용액으로 만들려고 한다. 증발된 물의 양[mol]으로 가장 가까운 것은? (단, NaOH과 물의 몰질량은 각각 40g/mol과 18g/mol이다.)
- 75
- 25
- 4.2
- 1.4
16. 기초반응(elementary reaction)인 A→B 반응을 연속교반탱크반응기(CSTR)에서 진행하여 얻은 반응물 A의 전화율은 60%이다. 동일한 조건에서 같은 크기의 플러그흐름반응기(PFR)에서 진행할 경우, 반응물 A의 전화율은? (단, e-1.5=0.223으로 계산한다.)
- 22.3%
- 33.3%
- 66.7%
- 77.7%
17. 비중이 1이고 점도가 1cP인 물이 내부 지름 2cm의 관속을 1m/s의 속도로 흐를 때 Re(Reynolds number)는?
- 2
- 20
- 2,000
- 20,000
18. 열교환기에서 유체가 관다발에 직각으로 흐르는 흐름 형태는?
- 향류흐름
- 교차흐름
- 병류흐름
- 다중통과흐름
19. 높이 2m, 지름 2m인 원통형 탱크에 깊이 1m까지 물이 차 있다. 탱크 위에 지름 cm의 관을 접속시켜서 평균 유속 m/s로 들여보낸다면 탱크를 채우는 데 걸리는 시간은?
- 314초
- 31,400초
- 3,140초
- 10,000초
20. 각 성분의 생성 Gibbs에너지( 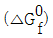 )가 <보기>와 같다면 298K에서 메탄가스(CH4)의 연소반응에 대한 반응 Gibbs에너지(reaction Gibbs energy,
)가 <보기>와 같다면 298K에서 메탄가스(CH4)의 연소반응에 대한 반응 Gibbs에너지(reaction Gibbs energy, 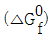 및 이 반응의 자발성에 대한 설명으로 가장 옳은 것은?
및 이 반응의 자발성에 대한 설명으로 가장 옳은 것은?
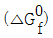 =-817kJ/mol, 자발적인 반응
=-817kJ/mol, 자발적인 반응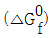 =-817kJ/mol, 비자발적인 반응
=-817kJ/mol, 비자발적인 반응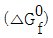 =817kJ/mol, 자발적인 반응
=817kJ/mol, 자발적인 반응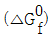 =817kJ/mol, 비자발적인 반응
=817kJ/mol, 비자발적인 반응






 "가 옳은 답이다.
"가 옳은 답이다.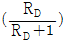 " 이다.
" 이다.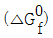 =-817kJ/mol, 자발적인 반응"이 정답이다.
=-817kJ/mol, 자발적인 반응"이 정답이다.
증기화 엔탈피는 다음과 같이 계산할 수 있다.
ΔH = Hvap = CpΔT
여기서 Cp는 비열(capacity)이고, ΔT는 온도 변화량이다. 이 문제에서는 물과 수증기가 모두 100℃이므로 ΔT는 0이 된다. 따라서 증기화 엔탈피는 Cp에 비례한다.
물의 Cp는 4.18 J/g·K이고, 수증기의 Cp는 2.08 J/g·K이다. 따라서 수증기의 증기화 엔탈피는 다음과 같이 계산할 수 있다.
Hvap = CpΔT = 2.08 J/g·K × (100℃ - 0℃) = 208 J/g
수증기의 밀도는 0.46 g/L이므로, 1 kg의 수증기는 2174 L이 된다. 따라서 1 kg의 수증기의 증기화 엔탈피는 다음과 같다.
ΔH = Hvap × m = 208 J/g × 1000 g = 208000 J = 208 kJ
따라서 가장 가까운 값은 2,252이다.