1과목: 과목 구분 없음
1. 계단입력에 과소 감쇠 응답(Under damping response)을 보이는 2차계에 대한 설명으로 가장 옳지 않은 것은?
- 오버슈트(overshoot)는 정상상태값을 초과하는 정도를 나타내는 양으로 감쇠계수(damping factor)만의 함수이다.
- 응답이 최초의 피크(peak)에 이르는 데에 소요되는 시간은 진동주기의 반에 해당한다.
- 오버슈트(overshoot)와 진동주기를 측정하여 2차계의 공정의 주요한 파라메타들을 추정할 수 있다.
- 감쇠계수(damping factor)가 1에 접근할수록 응답의 진폭은 확대된다.
2. 정상상태의 일정한 압력에서 운전되는 등온의 단일상 흐름반응기에서 A + B → R + S 반응이 진행된다. CA0=100, CB0=300인 기체공급물에 대하여 전화율 XA는 0.90일 때 XB, CA 및 CB는?
- 0.3, 10, 210
- 0.1, 10, 210
- 0.3, 90, 210
- 0.3, 10, 10
3. <보기>와 같이 비가역 연속 1차반응이 회분식 반응기에서 일어날 때 R의 최대농도(CR,max)와 최대농도가 되는 반응시간(tmax)은? (단, k1=1min-1, k2=2min-1, CA0=3mol/l, CR0=CS0=0mol/l이다.)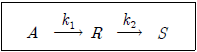
- 3/emol/l, ln2min
- 3/emol/l, ln0.5min
- 0.75mol/l, ln2min
- 0.75mol/l, ln0.5min
4. <보기>의 기상 반응은 25℃에서의 발열반응이다. 이 반응을 800℃에서 실시할 때, 발열반응인지 여부와 반응열은? (단, 반응물의 25℃와 800℃에서의 평균비열은  ,
, 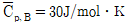 ,
, 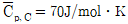 로 계산한다.)
로 계산한다.)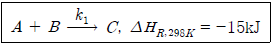
- 발열반응, -500J
- 발열반응, -1,500J
- 흡열반응, 500J
- 흡열반응, 1,500J
5. 물질의 기본적 성질에 대한 미분형 관계식으로 가장 옳은 것은? (단, H=엔탈피, U=내부에너지, S=엔트로피, G=깁스에너지, A=헬름홀츠에너지, P=압력, V=부피, T=절대온도이다.)
- dU=TdS-VdP
- dH=TdS-VdP
- dA=-SdT-PdV
- dG=SdT+VdP
6. 혼합 흐름 반응기에 반응물 A가 원료로 공급되고, <보기>와 같은 연속반응이 진행된다. 이때 B의 농도가 최대가 되는 반응기 공간시간은? (단, k1=2min-1, k2=1min-1이고, 원료 반응물의 농도는 CA0=2mol/l 이다.)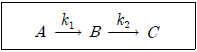
- 2 min
- 1/2 min
- √2 min
- 1/√2 min
7. <보기 1>의 압력(P)-부피(V) 상도에 대한 설명으로 옳은 것을 <보기 2>에서 모두 고른 것은?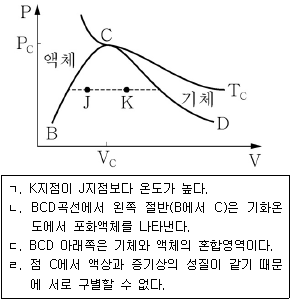
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
- ㄴ, ㄷ, ㄹ
8. A성분/B성분의 2성분계는 근사적으로 라울의 법칙을 따른다. 각 순수성분의 증기압은 75℃에서 PAsat=60kPa이고 PBsat=40kPa이다. 75℃에서 A성분 50mol%와 B성분 50mol%로 구성된 액체혼합물과 평형을 이루는 증기의 A성분 몰분율 조성은?
- 0.5
- 0.6
- 0.7
- 0.8
9. 반응열에 대한 설명 중에서 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
10. 대기압이 1기압일 때, 압력이 큰 순서로 나열된 것은? (단, 다른 조건이 없으면 압력은 절대압이다.)
- 3×107Pa > 1bar > 2×105N/m2 > 2.7mH2O > 380mmHg
- 2×105N/m2 > 3×107Pa > 1bar > 12.7psi > 15inHg
- 3×107Pa > 2×105N/m2 > 1bar > 1.5mH2O > 12.7psi
- 3×107Pa > 2×105N/m2 > 1bar > 12.7psi > 380mmHg
11. 12wt% NaHCO3 수용액 5kg을 50℃에서 20℃로 온도를 낮추어 결정화를 유도하였다. 이때 석출되는 NaHCO3의 질량은? (단, 20℃에서 NaHCO3의 포화 용해도는 9.6g NaHCO3/100gH2O으로 계산한다.)
- 0.4224kg
- 0.1776kg
- 0.6234kg
- 0.2010kg
12. 메탄올 33mol%인 메탄올/물 혼합 용액을 연속증류하여 메탄올 99mol% 유출액과 물 97mol% 관출액으로 분리하고자 한다. 유출액 100mol/hr을 생산하기 위해 필요한 공급액의 양은?
- 300mol/hr
- 320mol/hr
- 340mol/hr
- 360mol/hr
13. 기체 흡수탑에서 발생할 수 있는 현상 중 편류(Channeling)에 대한 설명은?
- 흡수탑에서 기체의 상승 속도가 높아서, 액체가 범람하는 현상
- 흡수탑 내에서 액체가 어느 한 곳으로 모여 흐르는 현상
- 흡수탑 내에서 기상의 상승속도가 증가함에 따라, 각 단의 액상체량(Hold up)이 증가해 압력손실이 급격히 증가하는 현상
- 액체의 용질 흡수량 증가에 따라 증류탑 내부 각 단에서 증기의 용해열에 의해 온도가 상승하는 현상
14. 친전자성 방향족 치환반응이 가장 잘 일어나는 물질은?
15. <보기>는 가스 A, B, C의 세 성분으로 된 기체혼합물의 분석치이다. 이때 성분 B의 분자량은?
- 30
- 40
- 50
- 60
16. 생쥐는 20kPa(절대압력) 압력까지 생존할 수 있다. <보기 1>에서 보인 것처럼 탱크에 연결된 수은 마노미터의 읽음이 60cmHg이고 탱크외부의 기압은 100kPa이다. 옳은 것을 <보기 2>에서 모두 고른 것은? (단, 80cmHg=100kPa로 계산한다.)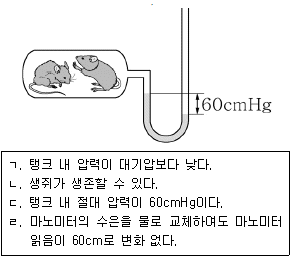
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄷ, ㄹ
- ㄱ, ㄴ, ㄷ
17. 외측이 반경 r1, 내측이 반경 r2인 쇠구슬이 있다. 구의 안쪽과 표면의 온도를 각각 T1℃, T2℃라고 할 때 이 구슬에서의 열손실[kcal/h] 계산식은? (단, 구벽의 재질은 일정하며 열전도도는 kav[kcal/m⋅h⋅℃]로 일정하다.)
- 4πkav(T1-T2)/(r1-r2)
- 4πkavln(T1/T2)/ln(r1/r2)
- 4πkav(T1-T2)/ln(r1/r2)
- 4πkav(T1-T2)/(1/r1-1/r2)
18. 800kg/h의 유속으로 각각 50wt% 벤젠과 자일렌의 혼합용액이 유입되어 벤젠은 상층에서 300kg/h, 자일렌은 하층에서 350kg/h로 분리되고 있다. 이때 상층에 섞여있는 자일렌(q1)과 하층에 섞여있는 벤젠(q2)의 유속은?
- q1: 60kg/h, q2: 90kg/h
- q1: 90kg/h, q2: 60kg/h
- q1: 50kg/h, q2: 100kg/h
- q1: 100kg/h, q2: 50kg/h
19. 비중이 0.8인 액체가 나타내는 압력이 2.4kgf/cm2일 때, 이 액체의 높이는?
- 10m
- 20m
- 30m
- 40m
20. DNA(Deoxyribonucleic acid)에 대한 설명으로 옳은 것을 <보기>에서 모두 고른 것은?
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄷ, ㄹ
- ㄴ, ㄷ, ㄹ






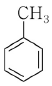
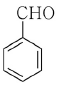
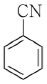
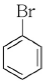
 " 입니다. 이유는 이 분자가 친전자성 방향족 화합물이기 때문입니다. 친전자성 방향족 화합물은 반응성이 높아서 치환반응이 잘 일어납니다.
" 입니다. 이유는 이 분자가 친전자성 방향족 화합물이기 때문입니다. 친전자성 방향족 화합물은 반응성이 높아서 치환반응이 잘 일어납니다.