1과목: 화공열역학
1. 비압축성 유체(incompressible fluid)의 성질을 나타내는 식이 아닌 것은?
2. 정압열용량 Cp는 7/2R이고 정적열용량 Cv는 5/2R인 1몰의 이상기체가 압력 10bar, 부피 0.05m3에서 압력 1bar로 정용과정을 거쳐 변화할 때 기계적인 가역과정으로 가정하면 이 계에 부가된 열량 Q와 이 계가 한 일 W는 각각 얼마인가?
- Q=-11250J, W=0
- Q=-15750J, W=0
- Q=0, W=-11250J
- Q=0, W=-15750J
3. 오토(Otto)엔진관 디절(Diesel)엔진에 대한 설명 중 틀린 것은?
- .디젤 엔진에서는 압축 과정의 마지막에 연료가 주입된다.
- 디젤 엔진의 효율이 높은 이유는 오토 엔진보다 높은 압축비로 운전할 수 있기 때문이다.
- 디젤 엔진의 연소 과정은 압력이 급격히 변화하는 과정 중에 일어난다.
- 오토 엔진의 효울은 압축비가 클수록 좋아진다.
4. 어떤 물질의 부피팽창률은 a/V, 등온압축률은 b/V일 때 이 물질의 상태 방정식은? (단, a,b는 상수이다.)
- V=aT+bP+const.
- V=aT-bP+const.
- V=bT+aP+const.
- V=bT-aP+const.
5. 일정한 T,P에 있는 닫힌계가 평형상태에 도달하는 조건에 해당하는 것은?
- (dGt)T.P=0
- (dGt)T.P>0
- (dGt)T.P<0
- (dGt)T.P=1
6. 다음 중 등엔트로피 과정이라고 할 수 있는 것은?
- 가역 단열과정
- 가역과정
- 단열과정
- 비가역 단열과정
7. 1몰의 이상기체에 대하여 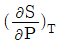 와 같은 값을 가지는 것은? (단, R은 기체상수, Cp는 정압비열이다.)
와 같은 값을 가지는 것은? (단, R은 기체상수, Cp는 정압비열이다.)
8. 1atm, 25℃에서 물의 등온 압축률 k는 4.5×10-5(atm)-1이다. 25℃등온하에서 물의 밀도를 1%증가시키기 위해서는 약 몇 기압까지 물을 압축시켜야 하는가? (단, 압력변화에 관계없이 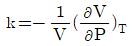 로서 일정 하다.)
로서 일정 하다.)
- 22
- 44
- 222
- 2244
9. 열과 일 사이의 에너지 보존의 원리를 표현한 것은?
- 열역학 제0법칙
- 열역학 제1법칙
- 열역학 제2법칙
- 열역학 제3법칙
10. 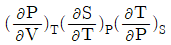 와 동일한 열역학 식은?
와 동일한 열역학 식은?
11. 열역학성질 중 부분 몰 성질(partial molar property) 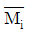 에 해당하지 않는 것은? (단, H는 엔탈피, S는 엔트로피, f는 퓨개시티, r는 활동도계수이다.)
에 해당하지 않는 것은? (단, H는 엔탈피, S는 엔트로피, f는 퓨개시티, r는 활동도계수이다.)
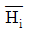
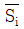
- fi
- RTlnri
12. 단열과정을 나타내는 식이 아닌 것은? (단, r는 비열비이다.)
- TVr-1=constant
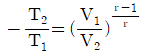
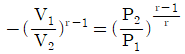
- PVr=constant
13. 어떤 유체가 장치 속으로 1.8km/min의 유속으로 들어 간다. 들어가고 나갈 떄의 그 유체의 운동에너지의 차가 1kcal/kg 이 되려면 유체가 장치를 나갈 때의 속도는 약 몇 km/min 이어야 하는가?
- 5.77
- 6.24
- 9.63
- 11.57
14. 줄-톰슨(Joule-Thomson)계수 μ를 다음과 같이 나타낼 때 이상기체일 경우 μ의 값은?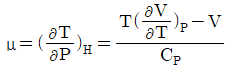
- 1
- 0
- -1
- ∞
15. 등온과정에서 이상기체의 초기 압력이 1atm, 최종압력이 10atm일 때 엔트로피 변화 △S를 옳게 나타낸 것은?
- △S=-R
- △S=-2.303R
- △S=4.606R
- △S=RTln5
16. 엔트로피에 관한 설명 중 틀린 것은?
- 엔트로피는 혼돈도(randomness)를 나타내는 함수이다.
- 융점에서 고체가 액화될 때의 에트로피 변화는
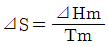 표시할 수 있다.
표시할 수 있다. - 위치에너지의 감소는 열역학적으로 엔트로피 감소에 대응된다.
- 엔트로피 감소는 질서도(orderliness)의 증가를 의미한다.
17. 카르노 사이클(carnot cycle)에 관한 설명 중 틀린 것은?
- 순환 가역과정이다.
- 등엔트로피 과정은 2개이다.
- 등온과정은 2개이다.
- 등압과정은 2개이다.
18. 다음 반응식과 같이 진공에서 CaCO3가 부분적으로 열분해하여 평형을 이루고 있는 계의 자유도는?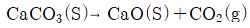
- 0
- 1
- 2
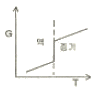
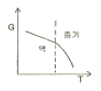
- 3
19. 정압과정으로 액체로부터 증기로 바뀌는 순수한 물질에 대한 깁스 자유에너지 G와 온도 T의 그래프를 옳게 나타낸 것은?
20. 압력 240kPa에서 어떤 액체의 상태량이 Vf는 0.00177m3/kg, VO는 0.105m3/kg, Hf는 181kJ/kg, Hg는 496kJ/kg일 때 이 압력에서의 Ufg는 약 몇 kJ/kg인가? (단, V는 비체적, U는 내부에너지, H는 멘탈피, 하첨자 f는 포화액, g는 건포화증기를 나타내고 Ufg는 Ug-Uf이다.)
- 24.8
- 290.2
- 315.0
- 339.8
2과목: 화학공업양론
21. 20℃에서 물 100g에 녹는 결정 황산나트륨(Na2SO4ㆍ10H2O)은 56.4g이다. 이 온도에서 황산나트륨의 용해도(g Na2SO4/100g H2O)는 약 얼마인가? (단, Na의 원자량23, S의 원자량 32이다.)
- 0.189
- 0.249
- 18.9
- 24.9
22. Lㆍatm와 단위가 같은 것은?
- 힘
- 질량
- 속도
- 에너지
23. 질소에 아세톤이 14.8vol% 포함되어 있다. 20℃, 745mmHg에서 이 혼합물의 상대포화도는 약 몇 % 인가? (단, 20℃에서 아세톤의 포화증기압은 184.8mmHg이다.)
- 73
- 60
- 53
- 40
24. 70℃에서 메탄올의 증기압은 1.14bar이고 에탄올의 증기압은 0.72bar이다. 70℃, 1bar에서 혼합증기와 평형을 이루고 있는 혼합용액 중 메탄올의 몰분율은? (단, 혼합용액은 이상용액으로 간주한다.)
- 0.277
- 0.612
- 0.667
- 0.79
25. 다음 [그림]은 증류장치를 도식한 것이다. 여기서 QC는 Condenser에서 제거된 열량, Qr는 Reboiler에서 가열한 열량, F는 공급량, D는 탑상부 제품량, B는 탑하부 유출량, CP는 각 stream의 평균비열을 의미한다. 이 계의 총괄에너지수지(over all energy balance)계산식을 옳게 표시한 것은?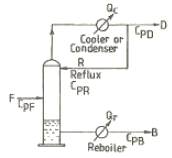
- Qr-QC=F∫CPFdT+D∫CPDdT-B∫CPBdT
- Qr-QC=D∫CPCdT+B∫CPBdT-F∫CPFdT
- Qr-QC=D∫CPDdT+B∫CPBdT-F∫CPFdT
- Qr-QC=F∫CPFdT+D∫CPDdT-F∫CPRdT
26. 20wt% 황산 100kg에 80wt% 황산을 섞어서 50wt%의 황산 수용액을 만들고자 할 때 80wt% 황산의 필요한 양은 몇 kg인가?
- 100
- 120
- 140
- 160
27. 1기압 20℃의 공기가 10L의 용기에 들어있다. 공기 중 산소만 제거하여 전체 체적을 질소만 차지한다면 압력은 약 몇 mmHg가 되는가? (단, 공기는 질소 79%, 산소 21%로 되어 있다.)
- 160
- 510
- 600
- 760
28. Ethylene glycol의 열용량 값이 다음과 같은 온도의 함수일 때, 0℃~100℃ 사이의 온도 범위 내에서 열용량의 평균값은 몇 cal/gㆍ℃인가?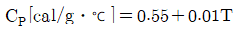
- 0.60
- 0.65
- 0.70
- 0.75
29. NaCl 수용액이 15℃에서 포화되어 있다. 이 용액 1kg을 65℃로 가열하면 약 몇 g의 NaCl을 더 용해시킬 수 있는가? (단, 15℃에서의 용해도는 358g/1000g H2O이고, 65℃에서의 용해도는 373g/1000g H2O 이다.)
- 7.54
- 10.53
- 15.05
- 20.3
30. 동일한 부피를 가진 수소와 산소의 무게를 같은 온도에서 측정하였더니 같은 값이었다. 수소의 압력이 2atm이라면 산소의 압력은 몇 atm인가?
- 0.102
- 0.125
- 0.225
- 0.250
31. 40wt%의 수분을 함유한 목재를 수분함량이 10wt%가 되도록 건조하였다면 원목재 1kg당 증발된 물의 양은 약 몇 g 인가?
- 113.3
- 223.3
- 333.3
- 443.3
32. 이상기체에서 단열공정(adiabatic process)에 대한 관계를 옳게 나타낸 것은? (단, K는 비열비이다.)
33. 편대수(Semi-log) 용지에 그래프를 그릴 때 직선으로 나타내는 식은?
- y=abx
- y=axn
- y=c+axn
- y=x/(c+ax)
34. 20℃, 730mmHg에서 상대습도가 75인 공기가 있다. 공기의 mol습도는? (단, 20℃에서 물의 증기압은 17.5mmHg이다.
- 0.0012
- 0.0076
- 0.018
- 0.0375
35. 개천의 유량을 측정하기 위하여 dilution method를 사용하였다. 처음 개천물을 분석하였더니 Na2SO4의 농도가 180ppm이있다. 1시간에 걸쳐 Na2SO4 10kg을 혼합한 후 하류에서 Na2SO4를 측정하였떠니 3300ppn이었다. 이 개천물의 유량은 약 몇 kg/h인가?
- 3195
- 3250
- 3345
- 3395
36. 표준상태에서 56m3의 용적을 가진 프로판기체를 완전히 액화하였을 때 얻을 수 있는 액체 프로판은 몇 kg인가?
- 28.6
- 110
- 125
- 246
37. 다음과 같은 일반적인 베르누이의 정리에 적용되는 조건이 아닌 것은?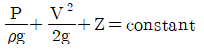
- 직선관에서만의 흐름이다.
- 마찰이 없는 흐름이다.
- 정상 상태의 흐름이다.
- 같은 유선상에 있는 흐름이다.
38. 산소 75vol%와 메탄 25vol%로 구성된 혼합가스의 평균 분자량은?
- 14
- 18
- 28
- 30
39. 순수한 수소와 질소를 고온, 고압에서 다음과 같이 반응시켜서 암모니아를 제조한다. 반응기에서의 수소의 전화율은 10%이고, 수소는 30kmol/s, 질소는 20kmol/s로 도입될 때 반응기에서의 배출되는 질소의 양은 몇 kmol/s인가?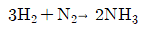
- 19
- 21
- 24
- 27
40. 과잉공기 백분율(%) 계산식을 옳게 나타낸 것은?
3과목: 단위조작
41. 정류탑에 원액을 500kmol/h로 공급할 때 정류부에서의 증기유량이 40kmol/h라면 환류량은 몇 kmol/h 인가? (단, 환류비는 3 이다.)
- 10
- 20
- 25
- 30
42. 벤젠과 톨루엔의 2 성분계 정류조작에 있어서의 자유도(degrees of freedom)는 얼마인가?
- 0
- 1
- 2
- 3
43. 이중 열교환기의 총괄전열계수가 69kcal/m2ㆍhㆍ℃이고 더운 액체와 찬 액체를 향류로 접촉시켰더니 더운 면의 온도가 65℃에서 25℃로 내려가고 찬 면의 온도가 20℃에서 53℃로 올라갔다. 단위 면적당의 열교환량은 약 몇 kcal/m2ㆍh인가?
- 498.2
- 551.7
- 2415
- 2760
44. 교반기 중 점도가 높은 액체의 경우에는 적합하지 않으나 저정도 액체의 다량 처리에 많이 사용되는 교반기는?
- 프로펠러(propeller)형 교반기
- 리본(ribbon)형 교반기
- 앵커(anchor)형 교반기
- 나선형(screw)g형 교반기
45. 상대휘발도 aAB를 옳게 나타낸 것은? (단, PA, PB는 각 A와 B순수 성분의 증기압, x와 y는 액상, 기상의 몰분율을 나타내고 PA>PB이다.)
46. 단면이 가로 5cm, 세로 20cm 인 직사각형 관로의 상담 직경은 몇 cm인가?
- 16
- 12
- 8
- 4
47. 다단 증류조작에서 환류비가 증가하는 경우에 대한 설명으로 옳은 것은?
- 정류탑의 단수가 늘어난다.
- 일정한 처리량을 위해서는 정류탑의 지름이 커져야 한다.
- 제품의 순도는 낮아진다.
- 유출액량이 증가한다.
48. 원관 내의 유체흐름에 따른 패닝(Fanning) 마찰계수 f에 대한 설명으로 틀린것은?
- 층류 흐름일 경우 f와 NRe는 반비례한다.
- 층류 흐름일 경우 f는 관 거칠기에 큰 영향을 받지 않는다.
- f는 속도두에 반비례한다.
- 층류 흐름일 경우 난류의 경우 보다 작은 f 값을 갖는다.
49. 증류에 있어서 원료 흐름 중 기화된 증기의 분율을 f라 할 때 f 에 대한 표현 중 틀린 것은?
- 원료가 포화액체일 때 f=0
- 원료가 포화증기일 때 f=1
- 원료가 증기와 액체 혼합물일 때 0<f<1
- 원료가 과열증기일 때 f<1
50. 충전탑의 높이가 2m이고 이론 단수가 5이면 이론단의 상당높이 HETP는 몇 m인가?
- 0.4
- 2.5
- 4
- 10
51. 점도 0.00018poise, 밀도 1.44kg/m3인 유체가 내경 50mm인 관을 평균속도 15m/s로 흐르고 있을 때 레이놀드 수를 구하면?
- 20000
- 40000
- 60000
- 80000
52. 공비혼합물 중 한 성분과 친화력이 크고 비교적 비휘발성인 첨가제를 가해 그 성분의 증기분압을 낮춰 분리시키는 방법은?
- 진공 증류
- 수증기 증류
- 공비 증류
- 추출 증류
53. 전열면적이 1m2인 나무의 평균 열전도도가 100℃에서 0.06W/mㆍ℃이다. 이 나무의 두께가 100mm일 때 100℃에서 열저항(thermal resistance)은 약 몇 ℃/W인가?
- 0.83
- 1.67
- 2.52
- 4.24
54. 공비 혼합물의 성질 중 틀린 것은?
- 보통의 증류방법으로 고순도의 제품을 얻을 수 없다.
- 비점도표에서 글소 또는 극대점을 나타낼 수 있다.
- 상대 휘발도가 1 이다.
- 전압을 변화시켜도 공비 혼합물의 조성과 비점이 변하지 않는다.
55. 정류탑에 공급되는 원료가 찬 액체상태일 때 공급선(feed line)의 기울기 m을 옳게 나타낸 것은?
- 1.0<m<∞
- -∞<m<0
- m<0
- 0<m<1
56. 다음 그림은 다공성 고체의 건조에 대한 자유분수 X와 건조속도 R의 관계를 나타낸 것이다. 이 그래프에 대한 설명으로 옳지 않은 것은?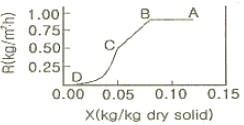
- AB구간에서 고체 내부로부터 표면으로의 물공급이 충분하여, 표면이 물로 충분히 젖어 있다.
- AB구간에서 고체 표면온도는 공기의 건구온도에 접근한다.
- BC구간에서 고체 기공 속의 물은 연속상이다.
- CD구간에서 고체에는 온도구배가 생긴다.
57. 흡수탑의 높이가 18m, 전달단위수 NTU(number of transferunit)가 3일 때 전달단위높이 HTU(height of a transferunit)는 몇 m 인가?
- 54
- 6
- 2
- 1/6
58. 파이프(pipe)와 튜브(tube)에 대한 설명 중 틀린 것은?
- 파이프의 벽두께는 Schedule Number로 표시할 수 있다.
- 튜브의 벽두께는 BWG(birmingham wire gauge)번호로 표시할 수 있다.
- 동일한 외경에서 Schedule Number 가 클수록 벽두께가 두껍다.
- 동일한 외경에서 BWG가 클수록 벽두께가 크다.
59. 다음 중 프라우드 수(Froude number)에 해당하는 것은? (단, g는 중력가속도, v는 속도, L은 길이이다.)
60. 5m/s의 평균유속으로 내경 3cm관을 흐르는 물이 내경이 6cm로 확대된관을 흐를 때 급격한 확대에 의한 손실은 약 몇 kgfㆍm/kg인가?
- 0.19
- 0.32
- 0.72
- 1.43
4과목: 반응공학
61. 단면적이 A, 길이가 L인 파이프 내에 평균속도를 U로 유체가 흐르고 있다. 입구 유체온도와 출구 유체온도 사이의 전달함수는? (단, 파이프는 단열되어 파이프로부터 유체로 열전달은 없다.)
62. 다음 제어에 관한 설명 중 옳은 것은?
- 폐의 동특성은 공정의 동특성에 의해 결정되며 제어기의 조율에는 무관하다.
- 적분공정의 경우는 비례제어기만으로도 설정점 변화를 오프셋없이 따라 갈 수 있다.
- 폐루프의 안정성은 제어기의 조율에 관계없이 공정에 의해서 이미 결정된다.
- 시간지연이 있는 일차공정의 경우 제어기 이득 크기에 관계없이 폐루프는 안정하다.
63. 제어계의 특성방정식의 근(극점)이 양의 실수값을 가질 때 시스템이 나타내는 특성으로 옳은 것은?
- 시스템은 안정하며, 응답은 진동하면서 감소한다.
- 시스템은 불안정하며, 응답은 진동하면서 증가한다.
- 시스템은 안정하며, 응답은 기하급수적으로 감소한다.
- 시스템은 불안정하며, 응답은 기하급수적으로 증가한다.
64. 다음 중 1차계의 시간상수에 대한 설명이 아닌 것은?
- 시간의 단위를 갖는 계의 특정상수이다.
- 그 계의 용량과 저항의 곱과 같은 값을 갖는다.
- 직선관계로 나타나는 입력함수와 출력함수 사이의 비례상수이다.
- 단위계단 변화시 최종치의 63%에 도달하는데 소요되는 시간과 같다.
65. 함수 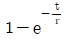 의 라플라스 변환은?
의 라플라스 변환은?
66. 다음 중 cascade제어에 관한 설명으로 옳은 것은?
- 직접 측정되지 않는 외란에 대한 대처에 효과적일 수 없다.
- Slave루프는 master루프에 비해 느린 동특성을 가져야 한다.
- 외란이 master루프에 영향을 주기 전에 slave루프가 외란을 미리 제거할 수 있다.
- Slave루프를 재튜닝해도 master루프를 재튜닝할 필요는 없다.
67. coshωt의 Laplace변환은?
68. 다음 중 Bernoulli의 법칙을 이용한 head-type 차압유량계는?
- Corriolos flowmeter
- Hot-wire anemometer
- Pitot tube
- Vortex shedder
69. 다음 전달함수를 갖는 계 중 sin응답에서 Phase lead를 나타내는 것은?
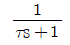
- e-τs
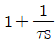
- 1+τs
70. 변환기(transducer)의 변화폭(span)을 늘리고 밸브의 크기를 줄였을 경우 제어성능을 유지하기 위해서 제어기 이득을 어떻게 재조정해야 하는지 옳게 설명한 것은?
- 크게 조정한다.
- 작게 조정한다.
- 변화폭과 밸브 크기 변화에 무관하므로 그냥 놔둔다.
- 변화폭과 밸브 크기 변화에 영향이 서로 상쇄되므로 그냥 나둔다.
71. 그림과 같은 액위계(liquid level system)에서 단면적은 3ft2, qo=8√hft3/min 이고 평균 조작수위 h=4ft일 때 시상수(time constant)는 얼마인가?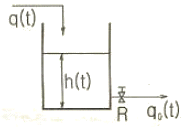
- 4/9min
- (3√3)/4min
- 3/4min
- 3/2min
72. 공정유체 10m3를 담고 있는 완전혼합이 일어나는 탱크에 성분 A를 포함한 공정유체가 1m3/h로 유입되며 또한 동일한 유량으로 배출되고 있다. 공정유체와 함께 유입되는 성분 A의 농도가 1시간을 주기로 평균치를 중심으로 진폭 0.3mol/L 진동하며 변한다고 할 때 배출되는 A의 농도변화의 진폭은 약 몇 mol/L 인가?
- 0.5
- 0.05
- 0.005
- 0.0005
73. 시간지연의 크기가 τ인 순수한 시간지연 공정의 전달 함수는?
74. 어떤 1차계의 전달함수는 1/(2S+1)로 주어진다. 크기 1, 지속시간 1인 펄스입력변수가 도입되었을 때 출력은? (단, 정상상태에서의 입력과 출력은 모두 0 이다.)
- 1-e-t/2-{1-e-(t-1)/2}u(t-1)
- 1-e-(t-1)/2u(t-1)
- 1-te-t/2u(t-1)
- 1-{e-t/2+e-(t-1)/2}u(t-1)
75. X1에서 X2로의 전달함수와 X2에서 X3로의 전달함수가 각각 다음과 같이 표현될 때 X1에서 X3로의 전달함수는?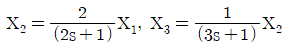
76. 다음 입력과 출력의 그림에서 나타내는 것은? (단, L은 이동거리[cm]이고 V는 이동속도[cm/s]이다.)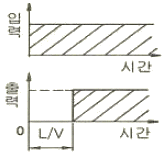
- CR회로의 동작응답
- 용수철계의 응답
- 데드타임의 공정응답
- 적분요소의 계단상 응답
77. 다음 미분방정식을 라플라스 변환시키면?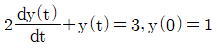
78. 그림과 같은 닫힌루프계에서 입력 R에 대한 출력 Y의 전달함수는?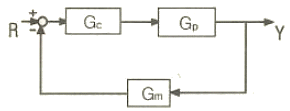
79. 다음 전달함수로 표현된 공정의 위상각은?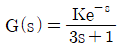
- tan-1(3ω)
- tan-1(-3ω)
- -1(-3ω)+ω
- -1(-3ω)-ω
80. 다음 제어기 중 편차(offset)를 일으키지 않는 것은?
- 비례 - 미분 제어기
- on - off 제어기
- 비례 - 적분 제어기
- 비례 제어기
5과목: 공정제어
81. 질산제조방법 중 상압법과 가압법에 대한 설명으로 옳은 것은?
- 상압법에 비교하여 가압법은 산화율이 떨어진다.
- 가압법은 산화 및 흡수탑의 용적이 매우 커서 시설비가 높다.
- 가압법은 생성된 질산의 농도가 상압법보다 낮다.
- Frank-caro process는 가압법에 해당한다.
82. 석유계 아세탈렌의 제조법이 아닌 것은?
- 아크 분해법
- 부분 연소법
- 저온 분유법
- 수증기 분해법
83. 염화비닐 수지를 성형가공시 가열에 의한 유동성을 향상 시키기 위하여 사용하는 것은?
- 안정제
- 가소제
- 정촉매
- 부촉매
84. 다음 중 테레프탈산 합성을 위한 원료로 이용되지 않는 것은?
- p-자일렌
- 톨루엔
- 벤젠
- 무수프탈산
85. 다음 중 복합비료에 대한 설명으로 틀린 것은?
- 비료 3요소 중 2종 이상을 하나의 화합물 상태로 함유하도록 만든 비료를 화성비료라 한다.
- 화성비료는 비효성분의 총량에 따라서 저농도과 고농도 화성비료로 구분할 수 있다.
- 배합비료는 주로 산성과 염기성의 혼합을 사용하는 것이 좋다.
- 질소, 인산 또는 칼륨을 포함하는 단일비료를 2종 이상 혼합하여 2성분 이상의 비료요소를 조정해서 만든 비료를 배합비료라 한다.
86. 다음 중 증기압이 최저가 되는 황산의 농도는?
- 97.2%
- 98.3%
- 99.8%
- 100%
87. 다음 중 염기성 비료로서 산성토양의 개량 및 잡초, 해충, 병원균의 구제에도 사용되는 비료는?
- Urea
- NH4Cl
- CaCN2
- (NH4)SO4
88. 다음과 같은 반응으로 하루 4ton의 염소가스를 생산하는 공장이 있다. 이 공장에서 하루동안 얻어지는 NaOH의 양은 약 몇 ton인가? (단, 나트륨의 원자량은 23이고, CI의 원자량은 35.5이다.)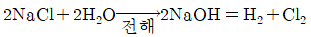
- 4.5
- 7.8
- 9.0
- 14.3
89. 1000ppm의 처리제를 사용하여 반도체 폐수 1000m3/day를 처리하고자 할 때 하루에 필요한 처리제는 몇 kg 인가?
- 1
- 10
- 100
- 1000
90. 석유화학 공정 중 전화(conversion)와 정제로 구분할 때 전화공정에 해당하지 않는 것은?
- 분해(cracking)
- 알킬화(alkylation)
- 스위트닝(swwtening)
- 개질(reforming)
91. 황산제조에서 연실의 주된 작용이 아닌 것은?
- 반응열을 발산시킨다.
- 생성된 산무의 응축을 위한 표면을 부여한다.
- Glover 탑에서 나오는 가스의 혼합과 SO2를 산화시키기 위하여 시간과 공간을 부여한다.
- 가스 중의 질소산화물을 H2SO4에 흡수시켜 회수하여 황질황산을 공급한다.
92. 접촉식 황산제조에 있어 사용하는 바나듐 계동의 촉매를 사용할 경우 전화기 내의 온도 범위를 옳게 나타낸 것은?
- 100~200℃
- 200~300℃
- 400~600℃
- 600~800℃
93. 아디프산과 헥사메틸렌디아민을 원료로 하여 제조되는 물질은?
- 나일론 6
- 나일론 66
- 나일론 11
- 나일론 12
94. 황산 용액의 포화조에 암모니아 가스를 주입하여 황산암모늄을 제조할 때 85wt%황산 1000kg을 포화조에서 암모니아 가스와 반응시키면 약 몇 kg의 황산암모늄 결정이 석출되겠는가? (단, 반응온도에서 황산암모늄 용해도는 97.5g/100gㆍH2O이며, 수분의 증발 및 분리공정 중 손실은 없다.)
- 788.7
- 895.7
- 998.7
- 1095.7
95. 원유를 증류할 때 상압증류공정의 탑저에서 나오는 전사유(Reduced Crude)나 감압증류공정에서 나오는 유분을 경유유분과 함께 제품규격에 맞게 배합한 것은?
- 나프다
- 등유
- 중유
- 아스팔트
96. 벤젠을 니트로화하여 니트로벤젠을 만들 때에 대한 설명으로 옳지 않은 것은?
- HNO3과 H2SO4의 혼산을 사용하여 니트로화 한다.
- NO+2이 공격하는 친전자적 치환반응이다.
- 발열반응이다.
- D, V, S의 값은 7이 가장 적합하다.
97. 황산 존재하에서 C2H5OH에 KBr을 작용시키면 생성되는 주 생성물은?
- CH3-O-CH3
- C2H5OBr
- C2H5Br
- CH3CHO
98. 부식전류가 크게 되는 원인으로 가장 거리가 먼 것은?
- 용존 산소농도가 낮을 때
- 온도가 높을 때
- 금속이 전도성이 큰 전해액과 접촉하고 있을 때
- 금속표면의 내부응력의 차가 클 때
99. 다음 중 밭농사를 주로 하는 지역에서는 사용되나 흡습성이 강하고 논농사에는 부적합한 비료로서 Fauser법으로 생산하는 것은?
- NH4Cl
- NH4NO3
- NH2CONH2
- (NH4)2SO4
100. 아세틸렌을 원료로 하여 합성되지 않는 물질은?
- 아세트알데히드
- 염화비닐
- 메틸알코올
- 아세트산 비닐
6과목: 화학공업개론
101. 다음은 단열 조작선의 그림이다. 조작선을 기울기는 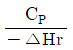 로 나타내는데 이 기울기가 큰 경우에는 어떤 형태의 반응기가 가장 좋겠는가? (단, CP는 열용량, △Hr은 반응열을 나타낸다.)
로 나타내는데 이 기울기가 큰 경우에는 어떤 형태의 반응기가 가장 좋겠는가? (단, CP는 열용량, △Hr은 반응열을 나타낸다.)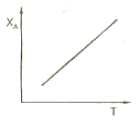
- 플러그 흐름
- 혼합 흐름
- 교반형
- 회분식
102. 다음 Arrhenius식에 대한 설명으로 옳지 않은 것은?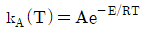
- A는 지수 앞자리인자 또는 빈도인자이다.
- 활성화에너지의 단위는 J/mol 또는 cal/mol이다.
- e-E/RT는 반응이 일어나기에 충분한 최소에너지 E를 가지는 분자들 사이의 충돌분율을 나타낸다.
- 활성화에너지 E는 전환이 된 후 분자들이 가져야 하는 최소에너지이다.
103. 비가역 1차 액상반응 A→R이 플러그흐름 반응기에서 전화율이 50%로 반응된다. 동일조건에서 반응기의 크기만 2배로 하면 전화율은 몇 %가 되는가?
- 67
- 70
- 75
- 100
104. 회분식반응기에서 A→R, A→R, -rR=3C0.5Amol/Lㆍh, CAD=1mol/L의 반응이 일어날 때 1시간 후의 전화율은?
- 0
- 1/2
- 2/3
- 1
105. 불균일 촉매반응에서 확산이 반응율속영역에 있는지를 알기 위한 식과 관계없는 것은?
- Thiele modulus
- Weisz-Prater식
- Mears식
- Langmuir-Hishelwood식
106. 어떤 반응에서 1/CA을 시간 t로 플롯하여 기울기 1인 직선을 얻었다. 이 반응의 속도식은?
- -rA=CA
- -rA=2CA
- -rA=C2A
- -rA=2C2A
107. 0차 반응의 반응물 농도와 시간과의 관계를 옳게 나타낸 것은?
108. 같은 조건에서 반응온도를 10℃에서 20℃로 올렸을 때 반응속도가 3배로 되었다. 이 때의 활성화에너지는 약 몇 kcal/mol인가?
- 11.44
- 18.18
- 20.43
- 35.62
109. 반응차수 n이 1보다 큰 경우 이상 반응기의 가장 효과적인 배열 순서는? (단, 플러그흐름 반응기와 작은 혼합흐름 반응기의 부피는 같다.)
- 플러그흐름 반응기 → 큰 혼합흐름 반응기 → 작은 혼합흐름 반응기
- 큰 혼합흐름 반응기 → 작은 혼합흐름 반응기 → 플러그흐름 반응기
- 플러그흐름 반응기 → 작은 혼합흐름 반응기 → 큰 혼합흐름 반응기
- 작은 혼합흐름 반응기 → 플러그흐름 반응기 → 큰 혼합흐름 반응기
110. 정용 회분식 반응기에서 단분자형 0차 비가역 반응에서의 반응이 지속되는 시간 t의 범위는? (단, CAO는 A성분의 초기농도, k는 속도상수를 나타낸다.)
111. 다음 중 불균일 촉매반응(heterogeneous catalytic reaction)의 단계가 아닌 것은?
- 생성물의 탈착과 확산
- 반응물의 물질전달
- 촉매표면에 반응물의 흡착
- 촉매표면에 구조변화
112. 기체반응 2A→R+S를 1atm, 100℃등온하의 회분식 반응기에서 반응시킨 결과, 20%의 inert gas를 포함한 반응물 A의 90%를 반응시키는데 5분이 걸렸다. 동일 조성의 반응물을 1atm, 100℃ 하에서 운전되는 플러그 흐름 반응기에 100mol/h로 공급하여 90%의 전화율을 얻고자 한다면 반응기 체적은 약 몇 L로 해야 하는가?
- 255
- 319
- 3100
- 4220
113. 다음과 같은 반응에서 최초 혼합물인 반응물 A가 25%, B가 25%인 것에 불활성기체가 50% 혼합되었다고 한다. 반응이 완결되었을 때 용적변화율 εA는 얼마인가?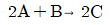
- -0.125
- -0.25
- 0.5
- 0.875
114. 다음 각 그림의 빗금친 부분의 넓이 가운데 플러그 반응기의 공간시간 τp를 나타내는 것은? (단, 밀도 변화가 없는 반응이다.)
115. 다음 반응에서 체적팽창률(fratrional change in volume, εA의 값은?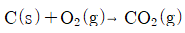
- -1/2
- 0
- 1/2
- 1
116. 그림과 같은 반응물과 생성물의 에너지 상태가 주어졌을 때 반응열 관계로 옳은 것은?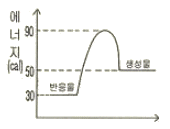
- 발열반응이며, 발열량은 20cal 이다.
- 발열반응이며, 발열량은 50cal 이다.
- 흡열반응이며, 흡열량은 20cal 이다.
- 흡열반응이며, 흡열량은 50cal 이다.
117. 어떤 이상기체가 600℃에서 다음 반응식과 같은 2차 반응이 일어날 때 반응속도상수 kc값은 70[Lㆍmol-1ㆍs-1]이었다고 하면 반응물 A분압의 감소속도[atmㆍs-1]를 반응속도로 할 때 반응속도 상수는 약 몇 atm-1ㆍmin-1인가?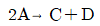
- 58.67
- 68.67
- 78.67
- 88.67
118. 성분 A의 비가역 반응에 대한 연속교반탱크반응기의 설계식으로 옳은 것은? (단, NA는 A성분의 몰수, V는 반응기 부피, t는 시간, FAO는 초기 유입 A의 몰유량, FA는 출구 A의 몰유량, rA는 반응속도이다.)
119. 효소반응에 의해 생체 내 단백질을 합성할 때에 대한 설명 중 틀린 것은?
- 실온에서 효소반응의 선택성은 일반적인 반응과 비교해서 높다.
- Michaelis-Menten식이 사용될 수 있다.
- 효소반응은 시간에 대해 일정한 속도로 진행된다.
- 효소와 기질은 반응 효소-기질 복합체를 형성한다.
120. 어떤 단일 성분 물질의 분해반응은 1차 반응으로 99%까지 분해하는데 6646초가 소요되었다면 30%까지 분해하는데는 약 몇 초가 소요되는가?
- 515
- 540
- 720
- 813





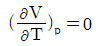
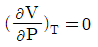
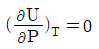
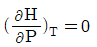

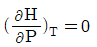 "이다. 이유는 비압축성 유체의 밀도는 일정하다는 것이 특징이기 때문에 밀도와 관련된 식이 아닌 것이다. 나머지 보기들은 비압축성 유체의 특징을 나타내는 식이다.
"이다. 이유는 비압축성 유체의 밀도는 일정하다는 것이 특징이기 때문에 밀도와 관련된 식이 아닌 것이다. 나머지 보기들은 비압축성 유체의 특징을 나타내는 식이다.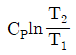
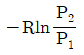
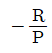
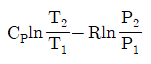
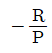 "이다.
"이다.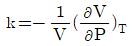
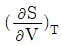
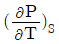
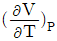
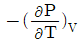
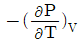 "가 정답인 이유는, 이 식은 Gibbs 자유에너지의 변화를 나타내는 식으로, 열역학에서 중요한 개념인 Gibbs 자유에너지와 관련이 있기 때문이다. 다른 보기들은 열역학에서 다른 개념들을 나타내는 식들이다.
"가 정답인 이유는, 이 식은 Gibbs 자유에너지의 변화를 나타내는 식으로, 열역학에서 중요한 개념인 Gibbs 자유에너지와 관련이 있기 때문이다. 다른 보기들은 열역학에서 다른 개념들을 나타내는 식들이다.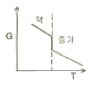
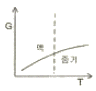
 "이다.
"이다.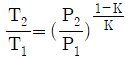
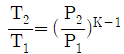
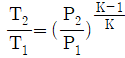
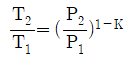
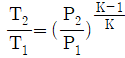 " 이다.
" 이다.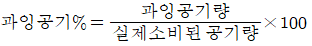
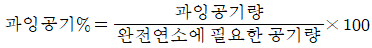

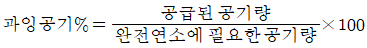
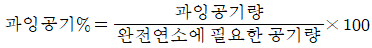 "이다.
"이다.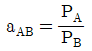
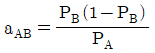
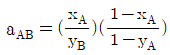
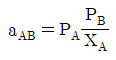
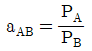 "이다.
"이다. 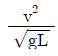
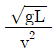
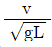
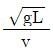
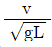 "이 프라우드 수에 해당한다.
"이 프라우드 수에 해당한다. 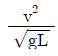 "은 레이놀즈 수, "
"은 레이놀즈 수, "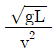 "는 마하 수, "
"는 마하 수, "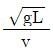 "는 웨버 수에 해당한다.
"는 웨버 수에 해당한다.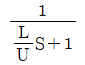
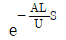
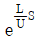
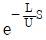
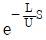 "가 된다.
"가 된다.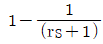
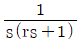
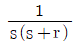
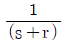
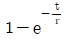 의 라플라스 변환은
의 라플라스 변환은 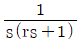 이다. 이유는 라플라스 변환의 정의에 따라,
이다. 이유는 라플라스 변환의 정의에 따라, 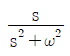
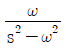
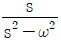
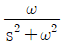
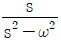 이다. 이유는 coshωt의 정의에 따라 coshωt = (e^(ωt) + e^(-ωt))/2 이므로, Laplace변환의 선형성에 의해 coshωt의 Laplace변환은 (1/2) * (L{e^(ωt)} + L{e^(-ωt)}) = (1/2) * (1/(s-ω) + 1/(s+ω)) =
이다. 이유는 coshωt의 정의에 따라 coshωt = (e^(ωt) + e^(-ωt))/2 이므로, Laplace변환의 선형성에 의해 coshωt의 Laplace변환은 (1/2) * (L{e^(ωt)} + L{e^(-ωt)}) = (1/2) * (1/(s-ω) + 1/(s+ω)) = 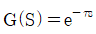
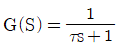
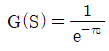
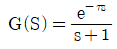
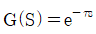 "가 정답이다.
"가 정답이다.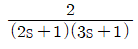
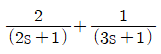
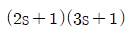
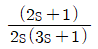
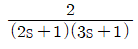 "이 정답이다.
"이 정답이다.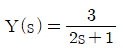
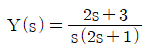
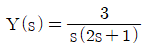
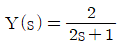
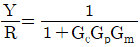
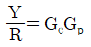
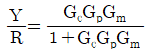
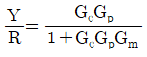
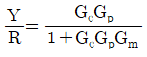 " 입니다.
" 입니다.


 " 이다.
" 이다.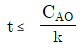
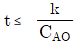
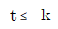
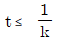
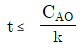 "이다.
"이다.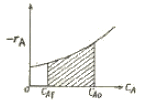
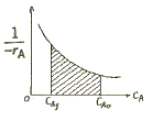
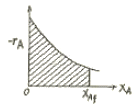
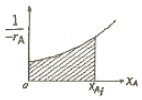
 "가 정답이다.
"가 정답이다.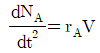
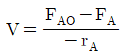
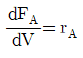
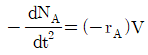
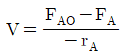 "이다. 이유는 연속교반탱크반응기의 설계식은 Fick의 2번째 법칙을 이용하여 유도할 수 있다. Fick의 2번째 법칙은 다음과 같다.
"이다. 이유는 연속교반탱크반응기의 설계식은 Fick의 2번째 법칙을 이용하여 유도할 수 있다. Fick의 2번째 법칙은 다음과 같다.